
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
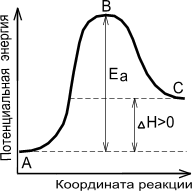
Энергетическая диаграмма химической реакции.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты. Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
где k – константа скорости реакции; А – предэкспоненциальный множитель или предэкспонента, почти не зависящий от температуры; R – универсальная газовая постоянная; Еа – энергия активации реакции; Т – температура в оК.
6. Энергия активации. Понятие о теории активных соударений и переходного состояния.
Любая химическая реакция начинается со столкновения частиц. От частоты столкновения зависит скорость реакции. Однако далеко не каждое столкновение частиц приводит к их химическому взаимодействию. В 1889 г. Аррениус выдвинул теорию активных соударений. Чтобы произошла реакция, то есть чтобы образовались новые частицы, необходимо сначала ослабить, или разорвать связи между атомами в исходных веществах, на что надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным и не приведет к химическому взаимодействию. Эффективными оказываются лишь столкновения между такими частицами, которые в момент столкновения обладают некоторым избытком энергии по сравнению со средней (для данной температуры) энергией всех частиц. Эта избыточная энергия называется энергией активации.
Энергия активации – это избыточное количество энергии по сравнению со средним запасом энергии, которым должны обладать частицы, чтобы в момент столкновения они могли вступить в химическое взаимодействие. Реакционноспособные частицы, обладающие избытком энергии равным или большим энергии активации, называются активными. Только активные частицы, обладающие в момент столкновения необходимым избытком энергии, могут вступать в химическое взаимодействие. Скорость реакции как раз и зависит от числа активных столкновении, которые приводят к перестройке электронных структур частиц и возникновению новых химических связей, то есть новых частиц. Энергия активации представляет собой усредненную избыточную энергию активных молекул, вступающих в реакцию, по сравнению со средней энергией всех исходных частиц. Энергия активации необходима для преодоления энергетического барьера отталкивания между электронными оболочками реагирующих частиц, а также отталкивания одноименно заряженных ядер друг от друга.
Рис. 3.5. Энергетическая схема реакции Н2 + I2 ↔ 2HI. По оси ординат отложена потенциальная энергия системы, по оси абсцисс – ход реакции или путь реакции: Еисх – средний уровень энергии всех исходных частиц Н2 и I2; Екон – средний уровень энергии конечных частиц HI; ЕI – энергия активации взаимодействия исходных частиц, то есть прямой реакции; Е2 – энергия активации взаимодействия молекул HI, то есть обратной реакции; Е3 – энергия промежуточного активированного комплекса; ∆Н – тепловой эффект реакции.
Реакционный путь, то есть превращение исходных веществ Н2 и I2 в продукт реакции HI протекает через энергетический барьер с образованием промежуточного активированного комплекса, которому соответствует энергия Е3. Только те частицы Н2 и I2 могут перейти в активированное состояние и затем в продукты реакции, которые обладают энергией достаточной для преодоления энергетического барьера, то есть избыточной энергией, равной или большей энергии активации Е1. Энергия активации обратной реакции Е2 больше, чем Е1, так как более высокой энергетический барьер необходимо преодолеть молекулам HI, чтобы перейти в продукты реакции Н2 и I2. Разность энергий активации прямой (Е1) и обратной (Е2) реакций равна её тепловому эффекту ∆Н. В нашем случае ∆Н < 0 (экзотермическая реакция). Тепловой эффект ∆Н можно определить также как разность между Екон и Еисх.
В 1935 г. Эйринг Г. и Поляни М. Предложили теорию образования активированного комплекса или переходного состояния, по которому исходные вещества переходят в продукты реакции через образование промежуточного активированного комплекса. Для реакции Н2 + I2 ↔ 2HI схематически можно изобразить
Н — Н Н ……. Н Н Н ↔ N O ↔ / \ I —— I I ……………… I I I
Активные молекулы Н2 и I2 при столкновении образуют активированный комплекс Н2 … I2, который отличается и от исходных молекул Н2 и I2, и от молекул HI. В этом комплексе связи HI начинают образовываться одновременно с разрывом связей Н – Н и I – I. В этом комплексе содержатся «полуразорвавшиеся» старые связи и «полуобразовавшиеся» новые связи (H – I). Это как бы «недораспавшиеся» исходные молекулы и вместе с тем «недообразовавшиеся» молекулы продуктов реакции. Именно для образования активированного комплекса и нужна энергия активации. Этот активированный комплекс или переходное состояние существует очень короткое время (примерно 10-12 ≈ 10-13 с), и представляет собой очень неустойчивое динамическое подвижное состояние, поэтому может превращаться и в продукты реакции (HI) и снова в исходные вещества (Н2 и I2). Таким образом, энергия активации представляет собой разность энергии активированного комплекса и энергии исходных молекул при данной температуре реакции. Необходимо отметить, что так как при образовании активированного комплекса ослабление связей в исходных молекулах Н2 и I2 происходит одновременно с образованием новых связей Н – I, то в результате этого энергия активации Е1 оказывается намного меньше, чем энергия, необходимая для полного разрыва связей в исходных молекулах (ЕН-Н + ЕI-I). Этим данным отвечает пунктирная кривая на рисунке. Иными словами, путь реакции через образование активированного комплекса энергетически более выгоден, чем путь реакции через полный разрыв связей в молекулах, вступающих в реакцию. Поэтому подавляющее большинство реакций проходит через образование промежуточных активированных комплексов.
7. Понятие о кинетике сложных реакций: параллельных, последовательных, сопряженных, обратимых, цепных. Фотохимические реакции. Примеры. Сложные реакции состоят из двух или большего числа простых реакций, в той или иной форме связанных между собой через исходные вещества и промежуточные продукты. К сложным реакциям относятся параллельные, последовательные, сопряженные и обратимые реакции. Теория сложных реакций основывается на положении, что при протекании в системе одновременно нескольких простых реакций каждая из них протекает самостоятельно и к каждой из них в отдельности применимы уравнения кинетики простых реакций. Параллельными называются реакции, в которых данное исходное вещество или исходные вещества могут реагировать одновременно в различных направлениях. Примером параллельных реакций является реакция разложения хлората калия при умеренных температурах. ┌→2KCl + 3O2 6KClO3 └→ 3KClO4 + KCl
Если параллельные реакции значительно различаются по скорости, то обычно реакцию, обладающую большей скоростью, называют главной (основной), а остальные побочными. Но иногда главной называют реакцию, приводящую к получению основного продукта, хотя бы она и обладала меньшей скоростью. Восстановление разбавленной азотной кислоты активными металлами типа цинк, алюминий, магний и т.п. может происходить одновременно до N2O, N2 и солей аммония. Последовательные реакции – это реакции, состоящие из нескольких стадий, следующие друг за другом. В этих реакциях какой-либо продукт, образующийся в одной из промежуточных стадий, расходуется в другой стадии. В общем виде последовательные реакции можно записать следующим образом: А где вещество В является промежуточным продуктом в процессе получения вещества С, а к1 и к2 – константы скорости двух стадий сложной реакции. Примером последовательных реакций является процесс гидролиза сахарозы. Последовательныереакции широко распространены и большинство реакций протекает через промежуточные стадии. Правда, характер промежуточных веществ из-за экспериментальных трудностей не всегда удается установить. К последовательным относятся, например, реакции термического крекинга углеводородов, которые протекают с последовательным превращением высокомолекулярных углеводородов во все более низкомолекулярные. Расчет скорости последовательных реакций в общем виде очень сложен. Однако, если одна из стадий обладает значительно меньшей скоростью (медленная стадия), чем остальные, то общая скорость реакции определяется скоростью именно этой стадии. Обратимые реакции – это реакции, протекающие одновременно в двух противоположных направлениях. Почти все реакции являются в той или иной степени обратимыми, но практически обратимыми называются реакции, в которых равновесие устанавливается не при ничтожно малых, а при ощутимых количествах исходных веществ. Например, синтез иодоводорода и аммиака из простых веществ: H2 + J2 Скорость обратимой реакции равна разности скоростей прямой и обратной реакций. Сопряженными реакциями называются реакции такого типа: А + В → Д, А + С → Е, из которых одна реакция может протекать самостоятельно, а другая реакция, например, вторая протекает лишь совместно с первой реакцией, то есть вторая реакция не может протекать без вещества В первой реакции и это вещество называется индуктором, так как оно индуцирует вторую реакцию. Вещество С второй реакции называется акцептором. Вещество А участвует в обоих реакциях и называется актором. Многие биохимические реакции, при которых происходят усложнение структуры молекулы, уменьшение энтропии и увеличение энергии Гиббса, оказываются возможными благодаря сопряжению с одновременно протекающими другими реакциями, характеризующимися отрицательными изменениями энергии Гиббса. Большое значение имеют цепные реакции, отличающиеся своеобразным механизмом. Для осуществления цепной реакции важно наличие высокоактивных частиц. Их роль могут выполнять свободные атомы или радикалы(частицы с неспаренным электроном), а также некоторые молекулы и ионы, обладающие большим избытком энергии. Примеры: пероксидное окисление липидов клеточных мембран, взрыв гремучего газа(смеси водорода и кислорода). Фотохимические реакции — химические реакции, которые инициируются воздействием электромагнитных волн, в частности — светом. Примерами фотохимических реакций являются: · фотосинтез в растениях, · распад бромида серебра в светочувствительном слое фотопластинки, · превращение молекул кислорода в озон в верхних слоях атмосферы, · фотоизомеризация, · фотореактивация — один из механизмов восстановления повреждений ДНК у прокариот, простейших, грибов, растений и беспозвоночных и т. п. Основными требованиями для фотохимических реакций являются: ü энергия источника излучения должна соответствовать энергии электронного перехода между орбиталями; ü излучение должно быть способным достичь целевых функциональных групп и не быть заблокированным реактором и другими функциональными группами.
Катализ – это явление изменения скорости реакции под действием определенных веществ (катализаторов). Катализатор – вещество, которое изменяет скорость реакции, активно участвуя в ней, но остающееся после реакции в неизменном состоянии и количестве. Необходимо сразу отметить, что катализатор может осуществить и такие реакции, которые без него не происходят в данных условиях, но принципиально осуществимы, то есть для них ∆G < 0. Если реакция термодинамически неосуществима (∆G > 0), то она не будет протекать даже в присутствии катализатора. Различают катализ положительный и отрицательный. Катализ принято считать положительным, когда катализатор увеличивает скорость реакции, и отрицательным, когда катализатор уменьшает скорость реакции. Посторонние вещества, присутствующие в зоне реакции, оказывают различное влияние на катализатор: одни нейтральны, другие усиливают действие катализатора, третьи его ослабляют или прекращают.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа реагирующие вещества и катализатор образуют одну фазу (газ или жидкий раствор), причем катализатор равномерно распределен в реакционном объеме. Например, реакция окисления СО кислородом в значительной степени ускоряется в присутствии паров воды пары воды 2СО + О2 → 2СО2 (3.23.)
В случае гетерогенного катализа (гетерогенной каталитической реакции) катализатор образует самостоятельную фазу. В этом случае реакция протекает на поверхности катализатора, поэтому его активность зависит от величины и свойств поверхности и химического состава поверхностного слоя катализатора. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора химическая реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более выгодны. Так как энергия активации понижается, то некоторые неактивные молекулы, энергия которых была недостаточна для активных столкновений, теперь становятся активными, вследствие чего скорость реакции возрастает.
На рисунке 3.6 показана энергетическая диаграмма хода реакции в присутствии (кривая 2) и в отсутствие (кривая 1) катализатора.
Рис. 3.6. Энергетическая схема реакции в отсутствие и в присутствии катализатора. Е1 и Екат1 – энергия активации реакции в отсутствие и в присутствии катализатора соответственно.
В присутствии катализатора энергия активации реакции уменьшается на величину ∆Е. Этим и объясняется ускоряющее действие катализатора в случае положительного катализа. Так как энергия активации в уравнении Аррениуса, характеризующего зависимость константы скорости реакции от температуры, стоит в показателе степени, то даже сравнительно небольшое её уменьшение под действием катализатора приводит к значительному возрастанию скорости и константы скорости реакции. Необходимо отметить, что если реакция А + В ↔ АВ будет обратимая, то из рис. 3.6 видно, что катализатор снижает энергию активации прямой и обратной реакции на одну и ту же величину ∆Е. Это значит, что в одно и то же число раз ускоряет и прямую, и обратную реакции, но не изменяет (не сдвигает) состояние равновесия, а лишь облегчает (или затрудняет в случае отрицательного катализа) достижение его.
Большинство биохимических процессов в живых организмах являются каталитическими. Биологические катализаторы, при помощи которых в живых организмах при невысокой температуре протекает множество биохимических превращений, из которых складывается обмен веществ, называются ферментами. Например, фермент, имеющийся в желудке (пепсин) катализирует расщепление белков. Каталаза вызывает в организме разложение пероксида водорода. Многие из биохимических процессов до сих пор вообще не удалось осуществить чисто химическим путем, то есть без участия ферментов.
Механизм действия ферментов считается таким же, как и обычных катализаторов, то есть они в реакции изменяют энергию активации. Энергии активации ферментативных реакций отличаются невысокими значениями (20¸80 кДж/моль). По некоторым свойствам ферменты отличаются от химических катализаторов: ü ферменты обладают более сильным каталитическим действием, причем они обычно сохраняют свою активность и будучи выделенными из организма; ü обладают, как правило, большей специфичностью. Каждый фермент катализирует определенный биохимический процесс или определенную группу реакций; ü
Рис. 3.7. Зависимость скорости ферментативной реакции от температуры.
Сейчас известно несколько тысяч ферментов. Они могут быть выделены из живых организмов и в ряде случаев получены в виде индивидуальных химических соединений. Выделенные ферменты находят широкое применение для приготовления лекарств, а также в промышленности и в быту (хлебопечение, квашение, винокурение и др.).
УЧЕНИЕ О РАСТВОРАХ 1. Растворы. Роль растворов в жизнедеятельности организмов. Вода как растворитель. Концентрация растворов и способы её выражения. Примеры.
Раствор – это гомогенная однофазная система переменного состава, состоящая из двух или более веществ, называемых компонентами раствора, причем соотношение компонентов раствора может изменяться в определенном интервале. Так, водный раствор сахара содержит два компонента: сахар и вода. Такое определение соответствует понятию истинного раствора. В истинном растворе каждый из компонентов распределен в массе другого компонента в виде молекул (сахар в воде), ионов (NaCl в воде) или атомов (гелий в воде). Растворы могут находится в трех агрегатных состояниях: газообразные растворы или смеси газов (например, воздух), жидкие растворы (водные растворы солей, биологические жидкости) и твердые растворы (сплав серебра и золота). Для биологии, физиологии, медицины, фармацевтического анализа наибольшее значение имеют жидкие растворы. Любой раствор состоит из растворенных веществ и растворителя, то есть среды, в которой растворенные вещества равномерно распределены в виде молекул, атомов или ионов. Обычно растворителем считается тот компонент раствора, который до растворения находится в таком же агрегатном состоянии, что и полученный раствор, то есть тот компонент, агрегатное состояние которого не изменяется при образовании раствора. Например, в водном растворе сахара (твердое вещество) растворителем является жидкая вода, так как полученный раствор является жидкостью. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, жидкие метанол и этанол или газообразные азот и кислород), то растворителем считается тот компонент, количество которого в растворе больше. В растворах электролитов вне зависимости от соотношения компонентов растворенным веществом считается электролит (например, 80%-ный раствор азотной кислоты в воде).
Очень велика роль растворов в жизнедеятельности живых организмов. И для медицины важнее всего жидкие растворы (особенно водные и спиртовые). Растворами являются важнейшие физиологические жидкости – кровь, слюна, желудочный сок, моча, спинно-мозговая жидкость и др. Процессы усвоения пищи человеком и животными связаны с переходом питательных веществ в растворенное состояние. Процессы обмена веществ и все основные биохимические процессы протекают в растворах. Биологические жидкости участвуют в транспорте питательных веществ к органам и тканям, а также в выведении из организма метаболитов (мочевины, углекислого газа и т.д.). Лекарственные вещества оказывают свое воздействие лишь в растворенном состоянии или должны перейти в организме в растворенное состояние.
Среди многих растворителей уникальное место занимает вода – это универсальный и важнейший растворитель, который растворяет многие вещества. Однако не все вещества хорошо растворяются в воде. Очень плохо в ней растворяются некоторые соли (серебро–хлорид, барий-сульфат и др.), кислоты (кремневая и др.), гидркоксиды (алюминия, железа, хрома и др.), оксиды многих d-элементов и другие вещества. Растворяющая способность воды определяется особенностями строения её молекулы и физико-химическими свойствами. Прежде всего вода хорошо растворяет многие ионные и полярные соединения. Такое свойство воды связано в значительной мере с её высокой диэлектрической проницаемостью (ε ≈ 80 при 20оС), которая показывает, что силы притяжения между ионами уменьшаются примерно в восемьдесят раз (по сравнению с вакуумом) при растворении ионных соединений в воде. В результате многие ионные и полярные соединения диссоциируют и отличаются высокой растворимостью в воде. Молекула воды – это диполь и она очень полярна. Кроме того, молекулы воды способны образовывать водородные связи друг с другом и с другими веществами (кислотами, спиртами и др.). Вода обладает такими аномальными свойствами, как высокие температуры плавления и кипения, высокое поверхностное натяжение, низкая вязкость, более высокая плотность в жидком состоянии, высокая теплоемкость и др. Вода является самым распространенным растворителем на нашей планете. У животных и растительных организмов содержание воды составляет обычно более 50%, а в ряде случаев содержание воды достигает 90-95%. Тело среднего человека массой 70 кг содержит примерно 40 кг воды.
Важной характеристикой раствора является его состав, который выражается как с помощью безразмерных единиц (долей или процентов), так и через размерные единицы – концентрации вещества – величины, измеряемой количеством этого вещества, содержащегося в определенной массе или объеме раствора или растворителя. Наиболее употребительны следующие способы выражения содержания растворенного вещества в растворе: массовая доля, объемная доля, молярная и моляльная концентрации, молярная концентрация эквивалента, молярная доля и титр. Массовая доля вещества в растворе W(X) есть отношение массы растворенного вещества m(X) к массе раствора m(p-pa):
Массовую долю компонента Х выражают в долях единицы, в процентах (%), промилле (тысячная часть процента). Массы раствора и данного компонента раствора измеряют в килограммах или граммах. Из приведенных формул (4.1.) вытекает, что массовая доля вещества, выраженная в процентах, равна массе вещества в 100 г раствора. Если раствор состоит из двух компонентов, то сумма массовых долей растворенного вещества и растворителя равна единице или 100%.
Пример 1. Рассчитайте массу КОН в 50 г водного раствора, в котором W(H2O) равна 90%. Решение. W(KOH) = 100% - 90% = 10%. Отсюда m(KOH) = 50г•0,1 = 5 г. Объемная доля вещества в растворе φ(Х) есть отношение объема данного вещества V(X) к общему объему раствора V(р-р).
Объемную долю компонента Х выражают в долях единицы или в процентах (%). Из приведенных формул (4.2.) вытекает, что объемная доля вещества, выраженная в процентах, равна объему вещества в 100 единицах объема раствора. Молярная концентрация вещества с(Х) равна отношению количества растворенного вещества n(X), содержащегося в растворе, к объему этого раствора V(р-р): с(Х) = где m(X) – масса растворенного вещества Х, г (кг), М(Х) – молярная масса растворенного вещества, г/моль или кг/моль, V(р-р) – объем раствора, л или м3.
Молярную концентрацию с(Х) выражают в моль/м3, моль/л, моль/дм3 или моль/см3. Чаще применяется в химии единица молярной концентрации -–моль/л. Для обозначения молярной концентрации вещества иногда после численного обозначения пишут букву М. Так, 2М HNO3 означает раствор, в каждом литре (дм3) которого содержится 2 моль азотной кислоты, то есть с(HNO3) = 2 моль/л. Молярную концентрацию растворенного вещества удобно использовать для определения количества вещества, содержащегося в данном объеме раствора. При одинаковой молярной концентрации равные объемы растворов различных веществ содержат одинаковое количество веществ (моль).
Пример 2. Рассчитайте количество и массу КОН, содержащегося в 400 мл 0,5 М раствора. Решение. n(KOH) = c(KOH) • V(p-p) = 0,5 моль/л • 0,4 л = 0,2 моль; m(KOH) = 0,2 моль • 56 г/моль = 11, 2 г. Моляльная концентрация вещества в(Х) равна отношению количества растворенного вещества n(X) к массе растворителя m(р-ль):
Моляльную концентрацию в(Х) выражают в единицах моль/кг. Для водного раствора соляной кислоты форма записи: в(HCl) = 0,2моль/кг, то есть в этом растворе на каждый килограмм растворителя (воды) приходится 0,2 моль HCl. Моляльная концентрация вещества в растворе в отличие от молярной концентрации не изменяется при изменении температуры. В химии кроме молярной концентрации вещества в различных расчетах широко используют также такой способ выражения концентрации как молярная концентрация эквивалента вещества. Эквивалентом называют реальную или условную частицу вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции эквивалентна одному электрону. Например, эквивалентом будут являться 1 атом натрия, половина атома двухвалентного кальция, третья часть атома трехвалентного алюминия, одна молекула одноосновной кислоты HNO3, половина молекулы двухосновной H2SO4. Фактор эквивалентности fэкв(Х) – это число, показывающее, какая часть реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
где Z – основность кислоты или кислотность основания данной кислотно-основной реакции, а также число электронов, присоединяемых или теряемых частицей (окислителем или соответственно восстановителем) в данной окислительно-восстановительной реакции. Например, fэкв(H2SO4)= (согласно полуреакции MnO4– + 8H+ + 5e = Mn2+ + 4H2O). Молярная масса эквивалента вещества (масса одного моля эквивалента вещества) равна произведению фактора эквивалентности на молярную массу вещества: М( М( Молярная масса эквивалента окислителя KMnO4 в кислой среде, согласно полуреакции MnO4- + 8H+ + 5e = Mn2+ + 4H2O, будет равна М( Молярная концентрация эквивалента вещества с(
где n( m(X) – масса растворенного вещества, г или кг; М(
Молярную концентрацию эквивалента с( При одинаковой молярной концентрации эквивалента равные объемы растворов различных веществ содержат одинаковое количество эквивалентов n( с1( Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их молярным концентрациям эквивалента. На основании этой зависимости можно вычислять объемы растворов, требуемые для проведения химической реакции. Кроме того, по объемам затраченных на реакцию растворов реагирующих веществ можно находить их молярные концентрации эквивалента.
Пример 3. Для полной нейтрализации 200 мл раствора серной кислоты потребовалось прибавить к этому раствору 50 мл 0,4 н. раствора NaOH. Рассчитайте молярную концентрацию эквивалента серной кислоты в исходном растворе. Решение. с( с(
Молярная доля вещества есть величина, равная отношению количества этого вещества к сумме количеств всех компонентов в растворе:
где х(Х) – молярная доля вещества Х в растворе; n(X) – количество вещества Х, моль; Σn(p-p) – суммарное количество всех компонентов раствора, моль.
Если раствор состоит из двух компонентов – А и В, то
где А – растворенное вещество, а В – растворитель.
Молярная доля выражается в долях единицы или в процентах. Очевидно, что х(А) + х(В) = 1.
Пример 4. Рассчитайте молярную долю NaOH в 10%-ным водном растворе. Решение. 100 г раствора содержит 10 г NaOH и 90 г воды. Отсюда n(NaOH) = 10г: 40 г/моль = 0,25 моль; n(H2O) = 90г: 18 г/моль = 5 моль.
Содержание вещества в растворе иногда указывают также в виде титра раствора. Титр раствора – это есть отношение массы растворенного вещества к объему раствора:
где m(X) – масса вещества, г; V(p-p) – объем раствора, мл.
Единица измерения титра раствора – г/см3, г/мл. Таким образом, титр раствора показывает массу растворенного вещества (г) в 1 мл раствора. Так, Т(H2SO4) = 0,2 г/мл означает раствор, в 1мл которого содержится 0,2 г серной кислоты. Титр раствора и молярная концентрация раствора связаны простым соотношением
2. Термодинамика растворения. Энтальпийный и энтропийный факторы растворения и их связь с механизмом растворения. Идеальные растворы.
Процесс растворения – обратимый процесс, положение равновесия которого определяется рядом факторов: Вещество + Растворитель ↔ Насыщенный раствор ± Q (4.11). Так как растворение – это сложный физико-химический процесс, поэтому при растворении вещества происходит как изменение энтальпии (∆Нраств), так и изменение энтропии (∆Sраств), то есть на обратимый процесс растворения могут оказывать влияние как энтальпийный, так и энтропийный факторы. При растворении изменение энтальпии ∆Нраств может быть как меньше нуля (растворение КОН или H2SO4 в воде), так и больше нуля (растворение KNO3 в воде). Изменение энтропии ∆Sраств при растворении тоже может быть больше нуля (растворение твердого вещества в воде) или меньше нуля (растворение газа в воде). Образование раствора из смешиваемых компонентов представляет собой самопроизвольный процесс, протекающий под влиянием двух внешних факторов (р и Т). Направление изобарно-изотермического процесса растворения и возможность его самопроизвольного протекания определяется по изменению энергии Гиббса: ∆Gраств = ∆Hраств - T•∆Sраств (4.12). Процесс растворения идет самопроизвольно, то есть вещество самопроизвольно может растворяться в каком-либо растворителе, если в результате процесса растворения энергия Гиббса уменьшается и ∆Gраств < 0. Величину ∆Hраств называют энтальпийным фактором растворения, а величину Т∆S называют энтропийным фактором растворения. Численное значение ∆Gраств показывает, как глубоко пойдет процесс растворения: чем отрицательнее значение ∆Gраств, тем образуется более устойчивый раствор. Если при растворении достигнуто состояние, когда ∆Gраств = 0, то наступает состояние равновесия и больше вещество растворяться не будет, то есть получился насыщенный раствор. При растворении твердых и жидких веществ в воде энтропия обычно увеличивается, так как растворяемые в
|
||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 7291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.44.171 (0.011 с.) |


 , (3.18)
, (3.18)
 │ (3.9)
│ (3.9) В
В  С
С 2HJ, N2 + 3H2
2HJ, N2 + 3H2  2NH3.
2NH3.

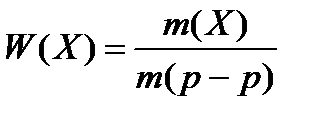 , или
, или  (4.1.).
(4.1.). , или
, или  (4.2.).
(4.2.). , (4.3.)
, (4.3.) (4.4.).
(4.4.). ,
,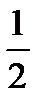 , fэкв(HCl) = 1, fэкв(H3PO4) =
, fэкв(HCl) = 1, fэкв(H3PO4) = 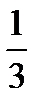 , fэкв(Al) =
, fэкв(Al) =  , fэкв(KMnO4) =
, fэкв(KMnO4) = 
 Х) = fэкв•М(Х) =
Х) = fэкв•М(Х) =  Н2SO4) =
Н2SO4) =  , (4.5.)
, (4.5.) или
или  .
. H2SO4) = 2 моль/л.
H2SO4) = 2 моль/л. .
. , (4.7)
, (4.7) ,
,  , (4.8)
, (4.8) , или 4,7%.
, или 4,7%. , (4.9.)
, (4.9.) (4.10).
(4.10).


