
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая кинетика и химическое равновесиеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций. Различают гомогенные и гетерогенные химические реакции. Гомогенные реакции протекают в объеме одной фазы – в жидком (водном) или газовом растворе. Например, 2СО(г) + О2(г) = 2СО2(г) (8) Гетерогенные реакции протекают на границе раздела фаз: г – ж, г – т, т – т и т.д. Например, 2С(т) + О2(г) = 2СО(г) (9) Скорость химической реакции (υ ) – это изменение количества вещества одного из реагентов за единицу времени в единице реакционного пространства. Она зависит от природы реагирующих веществ, температуры (Т), давления (Р), концентрации (С) реагирующих веществ и других факторов. Зависимость υ от С выражается законом действующих масс: При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Например, для гомогенной реакции (8) υ = k∙С2СО ×СО2, где k – константа скорости химической реакции, которая зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ; С – молярные концентрации веществ (моль / л). Для гетерогенной реакции (9) υ = k×СО2 , так как концентрации твердых веществ постоянны и приняты равными единице, т.е. СС = 1. Зависимость скорости химической реакции от температуры выражает правило Вант-Гоффа: при повышении температуры на каждые 10º скорость химической реакции увеличивается примерно в 2 – 4 раза. Математическое выражение закона Вант-Гоффа:
где υТ1 и υТ2 – скорости реакции при температурах Т1 и Т2; γ - температурный коэффициент скорости химической реакции. Он показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10º. По полноте протекания химических процессов различают необратимые и обратимые химические реакции. Необратимые реакции протекают только в одном направлении и завершаются полным превращением исходных веществ в продукты реакции. Обратимые реакции при одной и той же температуре протекают как в прямом, так и в обратном направлении и завершаются установлением в системе химического равновесия. Они не идут до конца, в системе всегда остаются исходные вещества: N2(г) + 3H2(г) ⇄ 2NH3(г) (11) Химическое равновесие – такое состояние химического взаимодействия, при котором скорости прямой и обратной реакций равны между собой, т.е. После наступления состояния равновесия концентрации реагирующих веществ при данных условиях остаются неизменными и называются равновесными концентрациями, обозначаются в квадратных скобках [ ]. Количественной характеристикой химического равновесия является константа химического равновесия К – величина, определяемая соотношением равновесных концентраций продуктов реакции и исходных веществ.Если в соотношение для константы равновесия входят равновесные концентрации, то ее обозначают символом Кс, а если используются парциальные давления газов (Рi), то – символом Кр. Например, для реакции (11):
Состояние химического равновесия устанавливается и сохраняется лишь при определенных условиях (температуре, давлении и концентрации реагирующих веществ). При изменении хотя бы одного из этих условий, т.е. при каком-либо внешнем воздействии, равновесие в системе нарушается, и система переходит в новое состояние равновесия. Этот переход называется смещением химического равновесия. Влияние внешних воздействий (изменение Т, Р или С) на состояние химического равновесия можно предсказать, пользуясь принципом Ле Шателье - Брауна: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия, т.е на внешнее воздействие система отвечает противодействием. Так увеличение концентрации какого-либо вещества вызовет противодействие системы – стремление уменьшить концентрацию этого вещества, что возможно путем смещения равновесия в направлении, при котором концентрация этого вещества будет уменьшаться. Повышение Робщ или Рi; приводит к смещению равновесия в сторону протекания той реакции, которая вызывает уменьшение Робщ и Рi и наоборот, понижение Робщ или Pj смещает равновесие в направлении той реакции, которая приводит к увеличению этих параметров. Повышение температуры вызывает смещение равновесия в направлении протекания той реакции, которая сопровождается поглощением теплоты, т.е. эндотермической (∆Н > 0). Понижение температуры будет вызывать смещение равновесия в сторону экзотермической реакции, сопровождающееся выделением теплоты (∆Н < 0). Примеры решения задач Пример 1. Как изменится скорость реакции 2NО(г) + О2(г) ⇄ 2NO2(г) , если Р е ш е н и е. 1) Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс, поэтому записываем математическое выражение этого закона для данной реакции в начальный момент времени: Согласно условию концентрацию NO увеличили в 2 раза, т.е. С'NO=2С NO, а концентрацию О2 уменьшили в 8 раз, т.е. С'o2 = Сo2 /8. 2) Записываем выражение для скорости реакции в конечный момент времени: υ' = k × (С' NO)2 × С'o2 или 3) Ответ: при одновременном увеличении концентрации NО в 2 раза и уменьшении концентрации О2 в 8 раз скорость реакции уменьшается в 2 раза. Пример 2. Определите, во сколько раз изменятся скорости прямой и обратной реакций в системе 2SO2 (г) + О2 (г) ⇄ 2SО3 (г), если объем газовой смеси уменьшить в 3 раза. Каково направление смещения равновесия в этой системе? Р е ш е н и е. 1) Записываем выражения для скоростей прямой и обратной реакций, используя закон действующих масс: 2) Рассматриваем, что происходит в реакционной системе при уменьшении ее объема. Уменьшение объема гомогенной системы в 3 раза приводит к увеличению концентрации каждого из реагирующих веществ также в 3 раза, т.е. математически это записываем в виде: С'so2 = 3С so2, С'о2 = 3Сo2 и С'so3 = 3С so3. 3) Записываем выражение для скоростей прямой и обратной реакций после изменения объема системы:
4) Определяем, во сколько раз изменяются скорости прямой и обратной реакций: Таким образом, при уменьшении объема газовой смеси в 3 раза скорость прямой реакции увеличится в 27 раз, а скорость обратной реакции – в 9 раз. 5) Устанавливаем направление смещения равновесия в этой системе. В связи с тем, что скорость прямой реакции увеличилась в 27 раз, а обратной – только в 9 раз, равновесие сместится в направлении протекания прямой реакции, т.е. в сторону образования SO3. Пример 3. Рассчитайте температурный коэффициент скорости химической реакции, если известно, что константа скорости этой реакции при 140°С равна 5,5 × 10-4, а при 185°С – 9,2 × 10-3. Дано: Т1 =140° С, k1 =5,5 × 10 -4; Т2= 185°С, k2 = 9,2∙× 10-3. Найти γ. Р е ш е н и е. 1) Зависимость скорости химической реакции от температуры описывается правилом Вант-Гоффа в форме: Но для проведения расчетов это уравнение необходимо прологарифмировать, т.е. 2) Рассчитываем температурный коэффициент скорости этой реакции. а) вычисляем температуру по абсолютной шкале: T1 = 140 + 273 = 413 К, Т2 = 185 + 273 = 458 К; б) рассчитаем численное значение γ:
отсюда Ответ: температурный коэффициент этой реакции равен 1,87. Пример 4. При синтезе аммиака N2 + ЗН2 ⇄ 2NНз равновесие установилось Дано: [ Н2 ]=2 моль/л, [ N2 ] = 4 моль/л, [ NH3 ] = 6 моль/л. Найти Кс, Сисх (Н2), Cиcx (N2). Р е ш е н и е. 1) Записываем выражение для константы равновесия в этой системе и рассчитываем ее значение: 2) Определяем исходные концентрации Н2 и N2. Для обратимых реакций ни одно из реагирующих веществ не расходуется полностью. Поэтому исходная концентрация вещества А складывается из равновесной концентрации этого вещества [А] и концентрации этого вещества, которая была израсходована на реакцию к моменту установления равновесия (условно обозначим ее X (А). Таким образом, выражение для исходной концентрации вещества А может быть представлено в виде: Сисх(А) = [А] + Х(А). а) Для определения Сисх(N2) и Сисх(Н2) обращаемся к уравнению реакции, согласно которому на образование 2 моль NH3 требуется 1 моль N2 и 3 моль Н2. Но поскольку равновесная концентрация NH3 равна 6 моль/л, то при этом было израсходовано 6/2 = 3 моль N2 и 3×(6 / 2) = 9 моль Н2. б) Рассчитаем Сисх(N2) и Сисх(Н2): Сисх(Н2) = [Н2] + Х(Н2) = 2 + 9 = 11 моль/л, Cисх(N2) = [N2] + X(N2) = 4 + 3 = 7 моль/л. Ответ: константа равновесия реакции равна 1,1. Исходные концентрации Н2 и N2 составляют 11 моль/л и 7 моль/л соответственно. Пример 5. Установите направление смещения равновесия в системе 2Н2О(г)+ 2О2(г) ⇄ 2Н2О2 (г), ∆ Н = – 483,7 кДж при понижении температуры и уменьшении общего давления. Р е ш е н и е. Влияние внешнего воздействия на состояние химического равновесия в системах, в которых протекают обратимые реакции, оценивается с помощью принципа Ле Шателье-Брауна. 1) Рассматриваем влияние температуры на состояние равновесия в данной системе. Термохимическое уравнение реакции показывает, что ∆Н < 0, следовательно, прямая реакция экзотермическая. При понижении температуры согласно принципу Ле Шателье-Брауна система будет стремиться ослабить внешнее воздействие (т.е. повысить Т), а это возможно за счет реакции, протекающей с выделением теплоты, т.е. экзотермической реакции. Следовательно, понижение температуры приведет к смещению равновесия в направлении протекания прямой реакции. 2) Оцениваем влияние изменения давления на состояние равновесия в данной системе. Из уравнения реакции видно, что прямая реакция сопровождается уменьшением объема системы 2V (Н2О) + 2V (О2) ≠ 2V (Н2О2), т.е. ∆V ≠ 0. Поэтому общее давление (Робщ) будет влиять на состояние равновесия в данной системе. Уменьшение Робщ согласно принципу Ле Шателье-Брауна вызовет противодействие системы (увеличение Робщ) за счет смещения равновесия в сторону протекания реакции, сопровождающейся увеличением Робщ, т.е. в сторону обратной реакции. Действительно, обратная реакция приводит к увеличению числа моль газообразных веществ в системе, а это значит, что при протекании обратной реакции Робщ в системе увеличивается. 1.7. Электролитическая диссоциация. Реакции ионного обмена Электролитическая диссоциация – это процесс распада молекул электролита на ионы под действием полярных молекул растворителя. Электролиты – это вещества, расплавы или водные растворы которых проводят электрический ток. К ним относятся растворы кислот, расплавы и растворы щелочей и солей. Неэлектролиты – это вещества, которые не проводят электрический ток. К ним относятся многие органические вещества. Электролиты, которые практически полностью диссоциируют на ионы, называются сильными; электролиты, которые частично диссоциируют на ионы, называются слабыми. Для количественной оценки полноты диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита называют отношение числа молекул, распавшихся на ионы, к общему числу молекул, находящихся в растворе. Обычно степень диссоциации (α) выражают в долях единицы или %:
где n – число частиц, подвергшихся электролитической диссоциации; n 0 – общее число частиц в растворе. Сильные электролиты – почти все соли, растворимые основания (NaOH, KOH, Ba(OH)2 и др.), неорганические кислоты (H2SO4, HCl, HNO3, HBr, HI и др). Слабые электролиты – нерастворимые основания и NH4OH, неорганические кислоты (H2CO3,, H2S, HNO2, H3PO4 и др.), органические кислоты и вода H2O. Сильные электролиты диссоциируют на ионы практически нацело (т.е. процесс диссоциации является необратимым) и одностадийно: HCl = H+ + Cl– H2SO4 = 2H+ + SO42– Слабые электролиты диссоциируют частично (т.е. процесс диссоциацииявляется обратимым) и ступенчато. Например, для многоосновных кислот на каждой стадии происходит отрыв одного иона водорода: 1. H2SO3 ⇄ H+ + HSO3- 2. HSO3- ⇄ H+ + SO32- Таким образом, число стадий многоосновных кислот определяется основностью кислоты (числом ионов водорода), а число стадий многокислотных оснований будет определяться кислотностью основания (или числом гидроксильных групп): NH4OH ⇄ NH4+ + OH–. Процесс электролитической диссоциации завершается установлением в системе состояния химического равновесия, которое характеризуется константой равновесия: Константа равновесия процесса электролитической диссоциации называется константой диссоциации – КД. Константа диссоциации зависит от природы электролита, природы растворителя, температуры, но не зависит от концентрации электролита. Между КД и α существует количественная связь:
Соотношение (13) называют законом разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора. Для слабых электролитов, когда α << 1, КД = α2С. Вода является слабым электролитом, поэтому диссоциирует обратимо: H 2O ⇄ H+ + OH– ∆H = +56,5кДж/моль Константа диссоциации воды: Степень диссоциации воды очень мала (это очень слабый электролит). Так как вода присутствует в большом избытке, то ее концентрация может считаться величиной постоянной и составляет КД [ H2O] = [H+]∙[OH-] = 55,6∙1,8∙10-16 = 10-14 [ H+]∙[OH-] = 10-14 = KW – ионное произведение воды Так как в воде концентрации катионов водорода и гидроксид-ионов равны, то: [ H+] = [OH-] = Растворение в воде других веществ (кислот, оснований, солей) изменяет концентрацию ионов Н+ или ОН–, а их произведение всегда остается постоянным и равным 10-14 при Т=250С. Концентрация ионов Н+ может служить мерой кислотности или щелочности раствора. Обычно для этой цели используется водородный показатель: pH = -lg[H+]. Таким образом, водородный показатель – это десятичный логарифм концентрации ионов водорода, взятый с обратным знаком.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 481; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.254.103 (0.014 с.) |


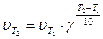 , (10)
, (10) .
. ,
, 


 = 1/2
= 1/2 ,
, 


 ;
; 

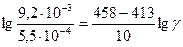 , lg 16,7 = 4,5 lgγ
, lg 16,7 = 4,5 lgγ , т.е. lg γ = 0,27, и тогда γ = 1,87.
, т.е. lg γ = 0,27, и тогда γ = 1,87.
 , (12)
, (12)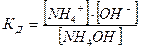
 (13)
(13)
 , тогда
, тогда .
.


