
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химического равновесия. Принцип Ле ШательеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Состояние химического равновесия существует при строго определенных условиях: концентрации, температуре, давлении. При изменении одного из этих условий равновесие нарушается вследствие неодинакового изменения скоростей прямой и обратной реакций. Переход из одного равновесного состояния в другое называется сдвигом или смещением положения равновесия. Если скорость прямой реакции становится больше скорости обратной реакции, равновесие смещается вправо. Если скорость прямой реакции становится меньше, чем скорость обратной, то равновесие смещается влево. С течением времени в системе устанавливается новое химическое равновесие, которое характеризуется новым равенством скоростей прямой и обратной реакций Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в направлении той реакции, которая ослабляет это воздействие.
Применительно к трем основным типам внешнего воздействия – изменению концентрации, давления и температуры – принцип Ле Шателье трактуется следующим образом. 1. При увеличении концентрации одного из исходных (реагирующих) веществ равновесие смещается в направлении той реакции, по которой это вещество расходуется; т.е. в сторону продуктов реакции; при уменьшении концентрации одного из реагирующих веществ равновесие смещается в сторону образования этого вещества, т.е. в сторону исходных веществ. При увеличении концентрации продуктов реакции равновесие смещается в сторону исходных веществ. 2. При изменении температуры изменяются скорости как прямой, так и обратной реакций, но в разной степени. Следовательно, для выяснения влияния температуры на химическое равновесие необходимо знать знак теплового эффекта реакции. При повышении температуры равновесие смещается в сторону эндотермической реакции (ΔН > 0, Q < 0), при понижении температуры – в сторону экзотермической реакции (ΔН < 0, Q > 0,). Так, в экзотермической реакции 2H2(г) + O2(г) «2H2O, 3. При увеличении давления равновесие смещается в сторону уменьшения числа молей газа, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону возрастания числа молей газов, т.е. в сторону увеличения давления. Если реакция протекает без изменения числа молей газообразных веществ, то давление не влияет на положение равновесия в этой системе.
2. Экспериментальная часть 2.1. Зависимость скорости реакции от концентрации реагирующих веществ Для наблюдения зависимости скорости реакции от концентрации реагирующих веществ используем реакцию взаимодействия раствора иодата калия
или в ионной форме:
Считая началом реакции момент сливания растворов реагентов, а концом – момент выделения свободного иода (появление синей окраски), можно установить время протекания реакции (τ) и определить относительную скорость реакции как 1/τ. Изменяя концентрацию раствора одного из реагентов, можно установить зависимость скорости реакции от концентрации реагирующих веществ при постоянной температуре. Для выполнения опыта используйте растворы: раствор А (0,002 н раствор иодата калия), раствор Б (0,02 н раствор сульфита натрия, содержащий в 500 мл 0,02 н раствора Порядок выполнения опыта. Приготовьте, используя мерный цилиндр и химические стаканы, раствор Б пяти различных концентраций согласно таблице 2.1. Для этого в каждый пронумерованный стакан налейте по 10 мл раствора Б и добавьте в каждый из них дистиллированную воду в количествах, указанных в таблице 2.1. Возьмите 2 пробирки, в одну из них внесите пипеткой 20 капель раствора А, в другую из стакана № 1 – 20 капель раствора Б (первый вариант концентрации). Быстро слейте растворы и одновременно включите секундомер (в процессе опыта пробирку не встряхивайте). В момент появления синего окрашивания выключите секундомер. Данные внесите в таблицу 2.1. Затем, в том же порядке выполните 2, 3, 4 и 5-й варианты опыта. Для каждого варианта рассчитайте относительную скорость процесса (1/τ, с‑1) и данные внесите в таблицу 2.1.
При оформлении анализа результатов опыта выполните задания и ответьте на вопросы: 1. Начертите график зависимости скорости реакции от концентрации реагирующих веществ, откладывая по оси абсцисс относительную концентрацию раствора сульфита натрия, по оси ординат – относительную скорость реакции. Объясните, какой вид имеет полученная зависимость? 2. Опишите Ваши наблюдения. Объясните, почему при повышении концентрации сульфита натрия синее окрашивание раствора(признак реакции) происходит быстрее. Как при этом изменяется (увеличивается или уменьшается) скорость исследуемой реакции? С чем это связано? 3. Какой кинетический закон устанавливает зависимость скорости реакции от концентрации реагирующих веществ? Запишите его выражение для исследуемой реакции. Подтверждает ли полученный результат выполнение этого закона? 4. Сделайте обобщенный вывод о влиянии концентрации реагирующих веществ на скорость физико-химических процессов.
2.2. Зависимость скорости реакции от температуры
Для изучения зависимости скорости реакции от температуры воспользуемся реакцией окисления щавелевой кислоты (H2C2O4) перманганатом калия (KMnO4) в присутствии серной кислоты. Уравнение реакции имеет вид
или в ионной форме
В кислой среде ион Порядок выполнения опыта. Возьмите 8 пробирок и поместите в 4 из них по 20 капель 0,1 н раствора H2C2O4. В остальные 4 пробирки внесите в каждую 20 капель KMnO4 и 20 капель концентрированной серной кислоты H2SO4 (строго соблюдайте указанную последовательность приготовления растворов). Охладите полученные смеси на воздухе (или под струей холодной воды) до комнатной температуры. Поместите пробирку с H2C2O4 и пробирку со смесью KMnO4 и H2SO4 в отверстие крышки, которой закрыт химический стакан, заполненный на 2/3 объема подогретой до
При оформлении анализа результатов опыта выполните задания и ответьте на вопросы: 1. Рассчитайте температурный коэффициент в интервалах: 30–40°С (u40°C/u30°C), 40–50°C (u50°C/u40°C), 50–60°C (u60°C/u50°C), вычислите его среднее значение (γср). Выполняется ли для исследуемой реакции правило Вант–Гоффа? От каких факторов зависит численное значение γ? 2. Постройте график зависимости скорости реакции от температуры, отложив по оси абсцисс температуру, по оси ординат – относительную скорость. Какой вид имеет полученная зависимость? 3. Опишите Ваши наблюдения. Объясните, почему при увеличении температуры обесцвечивание растворов (признак реакции) происходит быстрее. Как при этом изменяется (увеличивается или уменьшается) скорость исследуемой реакции? Как это связано с изменением числа активных частиц? 4. Сделайте обобщенный вывод о влиянии температуры на скорость физико-химических процессов.
2.3. Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ
В две пробирки поместите одинаковое количество (по одному полному микрошпателю) мела и мрамора. По возможности одновременно прилейте в пробирки одинаковые объемы (по 2 – 3мл) 10%-го раствора соляной кислоты. Реакция проводится при постоянных концентрациях всех веществ и комнатной температуре. Изменятся лишь природа реагирующих веществ, т.к. мел и мрамор отличаются по структуре. Наблюдайте выделение газа в обеих пробирках. Отметьте, в какой из пробирок выделение газа закончится быстрее?
При оформлении анализа результатов опыта выполните задания и ответьте на вопросы: 1. Напишите уравнения реакций взаимодействия мела и мрамора с соляной кислотой, учитывая, что мел и мрамор имеют одинаковую химическую формулу CaCO3. 2. Объясните различие скоростей реакций. Какой фактор в данном 3. Сделайте обобщенный вывод о влиянии величины поверхности реагирующих веществ на скорость гетерогенных физико-химических процессов. 2.4. Влияние концентрации реагирующих веществ на состояние равновесия
Смещение химического равновесия можно наблюдать на примере реакции взаимодействия хлорного железа (FeCl3) с роданидом калия (KCNS):
FeCl3 + 3KCNS «Fe(CNS)3 + 3KCL
Так как реакция обратима, то при смещении равновесия вследствие изменения концентрации реагирующих веществ интенсивность красного окрашивания раствора, обусловленного образованием роданида железа Fe(CNS)3, будет изменяться. Реакция протекает при постоянной температуре. Порядок выполнения опыта. Налейте в химический стакан 5 мл 0,01н раствора
При оформлении анализа результатов опыта выполните задания и ответьте на вопросы: 1. Запишите кинетическое условие равновесия исследуемой реакции. 2. Объясните, почему в первой и второй пробирках происходит усиление, а в третьей – ослабление окраски. Используя ЗДМ, объясните, как изменится скорость, и какой реакции (прямой или обратной) при каждом указанном (таблица 2.3) изменении концентрации веществ? К чему это приводит? В какую сторону смещается равновесие в каждом случае? 3. Сформулируйте принцип Ле Шателье. Подтверждает ли установленное в ходе опыта изменение скоростей реакций и смещение равновесия принцип Ле Шателье? 4. Запишите выражение константы равновесия (КС) для данной равновесной системы. Зависит ли численное значение константы равновесия от концентрации реагирующих веществ? 5. Сделайте общий вывод о влиянии концентрации реагирующих веществ на состояние равновесия.
2.5. Влияние температуры на состояние равновесия
При взаимодействии иода с крахмалом образуется вещество сложного состава – иодокрахмал, синего цвета. Реакцию можно представить схемой
иод + крахмал «иодокрахмал (∆H < 0).
Порядок выполнения опыта. В пробирку налейте 4 – 5 мл раствора крахмала и добавьте несколько капель 0,1 н раствора I2 до появления синего окрашивания. Разделите содержимое пробирки на две. Нагрейте одну пробирку с раствором, поместив ее в стакан с горячей водой. Затем охладите ее до комнатной температуры (под проточной водой), наблюдая в обоих случаях за изменением окраски растворов и сравнивая её с контрольной. При оформлении анализа результатов опыта ответьте на вопросы: 1. Объясните, почему и как (усиление или ослабление) при повышении или понижении температуры происходит изменение окраски. Почему, при повышении температуры в большей степени (результат опыта) увеличивается скорость обратной реакции, а при понижении температуры – увеличивается скорость прямой реакции? Объясните, как это связано с энергией активации и тепловым эффектом реакции. В какую сторону смещается равновесие при изменении температуры? 2. Подтверждают ли полученные в ходе опыта результаты принцип Ле Шателье? 3. Как изменится численное значение константы равновесия данной реакции при повышении температуры? Ответ необходимо обосновать. 4. Сделайте общий вывод о влиянии температуры на положение химического равновесия обратимой реакции.
3. Контрольные вопросы 1. Запишите выражение ЗДМ для реакций: а) 2NO(г) + О2(г) = 2NO2(г); б) CaO(кр) + CO2(г) = CaCO3(кр). Гомогенными или гетерогенными они являются? Как изменятся скорости реакций при уменьшении реакционных объемов в 3 раза? Ответ подтвердите расчетами. Каков физический смысл константы скорости реакции и от каких факторов зависит ее численное значение? 2. При повышении температуры от 298 до 318 К скорость реакции возросла в 9 раз. Вычислите энергию активации (Еа) и температурный коэффициент (g). От каких факторов зависят их численные значения и каков физический смысл этих величин? 3. Запишите выражение и вычислите константу равновесия реакции H2(г) + J2(г ↔ 2HJ(г) + Q при температуре 716 С, если известно, что константа скорости образования иодоводорода при этой температуре равна 1,6 10-2, а константа скорости его термического разложения равна 3 10-4.Эндо- или экзотермической является данная реакция? Какие вещества преобладают в системе в состоянии равновесия? Как повлияет понижение давления, температуры, введение в систему катализатора на смещение равновесия и численное значение константы равновесия данной реакции?
Литература 1. Коровин, Н. В. Общая химия / Н. В. Коровин. – М.: Высш. шк., 2000. 2. Фролов, В. В. Химия / В. В. Фролов. – М.: Высш. шк., 1986. 3. Забелина, И. А. Методическое пособие для самостоятельной подготовки к лабораторным работам по курсу «Химия». В 2 ч. Ч. 1 / И. А. Забелина, Л. В. Ясюкевич. – Минск: БГУИР, 1998. 4. Задачи и упражнения по общей химии / под ред. Н. В. Коровина. – М.: Высш. шк., 2006.
Лабораторная работа № 2 ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ, ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ Цель работы: на конкретных примерах изучить электрохимические процессы, протекающие на границе металл–электролит и в гальванических элементах. 1. Теоретическая часть Электрохимия имеет важное практическое значение для многих областей науки и техники. Исключительно велика роль электрохимических процессов и явлений в технологии изготовления и эксплуатации радиоэлектронных приборов и систем (электросинтез, электрохимическое травление, оксидирование, получение тонких пленок декоративного и специального назначения, антикоррозионные покрытия, создание контактов и др.). Процессы прямого превращения химической энергии в электрическую или электрической в химическую называются электрохимическими процессами. Электрохимические системы, в которых химическая энергия превращается в электрическую, называются гальваническими элементами. В основе электрохимических процессов лежат гетерогенные окислительно-восстановительные реакции, протекающие на границе раздела фаз: электрод – раствор (расплав) электролита. Скорость электрохимических процессов зависит как от природы электролита, его концентрации, величины рН (для водных растворов электролитов), внешних условий (T, P), наличия катализатора, так и от природы электродов, которая численно характеризуется величиной электродного потенциала.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 3424; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.012 с.) |

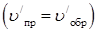 и новыми равновесными концентрациями всех веществ в системе.
и новыми равновесными концентрациями всех веществ в системе.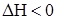 повышение температуры способствует обратной реакции, идущей с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ.
повышение температуры способствует обратной реакции, идущей с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ. с раствором сульфита натрия
с раствором сульфита натрия  в присутствии серной кислоты и крахмала (индикатора на свободный иод). Процесс взаимодействия протекает в несколько стадий. Суммарное уравнение реакции имеет вид
в присутствии серной кислоты и крахмала (индикатора на свободный иод). Процесс взаимодействия протекает в несколько стадий. Суммарное уравнение реакции имеет вид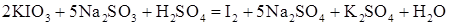 ,
,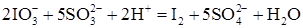 .
.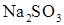 50 мл 2 н раствора серной кислоты и 50 мл
50 мл 2 н раствора серной кислоты и 50 мл 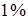 раствора крахмала). Реакция проводится при постоянной температуре (комнатной), постоянной концентрации иодата калия (раствор А) и переменной концентрации сульфита натрия (раствор Б, таблица 2.1).
раствора крахмала). Реакция проводится при постоянной температуре (комнатной), постоянной концентрации иодата калия (раствор А) и переменной концентрации сульфита натрия (раствор Б, таблица 2.1).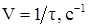
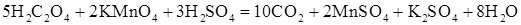
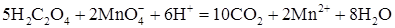 .
. восстанавливается в ион Mn2+, в результате цвет раствора изменяется: от красно–фиолетового цвета (цвет иона
восстанавливается в ион Mn2+, в результате цвет раствора изменяется: от красно–фиолетового цвета (цвет иона 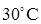 водой. Контроль температуры осуществляйте с помощью спиртового термометра (пробирки и термометр не должны касаться дна стакана). Выдержите пробирки с растворами в течение 1,5 – 2 мин, затем перелейте содержимое пробирки с подкисленным перманганатом калия в пробирку со щавелевой кислотой, не вынимая последнюю из стакана. Отметьте время по секундомеру с момента смешения растворов до полного их обесцвечивания и данные внесите в таблицу 2.2. Затем в той же последовательности выполните 2 – 4-й варианты опыта при температурах 40°C, 50°C, 60°C. Для каждого варианта рассчитайте относительную скорость реакции (1/τ, с-1) и данные внесите в таблицу 2.2.
водой. Контроль температуры осуществляйте с помощью спиртового термометра (пробирки и термометр не должны касаться дна стакана). Выдержите пробирки с растворами в течение 1,5 – 2 мин, затем перелейте содержимое пробирки с подкисленным перманганатом калия в пробирку со щавелевой кислотой, не вынимая последнюю из стакана. Отметьте время по секундомеру с момента смешения растворов до полного их обесцвечивания и данные внесите в таблицу 2.2. Затем в той же последовательности выполните 2 – 4-й варианты опыта при температурах 40°C, 50°C, 60°C. Для каждого варианта рассчитайте относительную скорость реакции (1/τ, с-1) и данные внесите в таблицу 2.2. случае влияет на увеличение скорости реакции? В каком случае поверхность взаимодействия больше и как это влияет на скорость реакции? Запишите выражение закона действия масс для каждой реакции.
случае влияет на увеличение скорости реакции? В каком случае поверхность взаимодействия больше и как это влияет на скорость реакции? Запишите выражение закона действия масс для каждой реакции.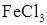 и добавьте 5 мл 0,01н раствора
и добавьте 5 мл 0,01н раствора 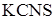 (или
(или 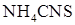 ). Полученный раствор разлейте на 4 пробирки. В первую пробирку добавьте 3 – 5 капель концентрированного раствора
). Полученный раствор разлейте на 4 пробирки. В первую пробирку добавьте 3 – 5 капель концентрированного раствора 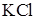 (или
(или 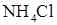 ) и встряхните пробирку несколько раз, чтобы ускорить растворение соли. Сравните интенсивность окраски полученных растворов с цветом раствора в четвертой пробирке (контрольной). Результаты наблюдений запишите в таблице 2.3.
) и встряхните пробирку несколько раз, чтобы ускорить растворение соли. Сравните интенсивность окраски полученных растворов с цветом раствора в четвертой пробирке (контрольной). Результаты наблюдений запишите в таблице 2.3.


