
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молярная и эквивалентная концентрации связаны соотношениемСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
См=Сн·Э. При растворении в воде или других растворителях, состоящих из полярных молекул, электролиты подвергаются электролитической диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. Необходимым условием электролитической диссоциации является наличие в растворяемом веществе ионных и полярных связей, а также полярность самого растворителя, численно характеризуемая величиной диэлектрической проницаемости (e). Диэлектрическая проницаемость воды равна 81, что обусловливает ее высокую ионизирующую способность. Для количественной оценки процесса электролитической диссоциации введено понятие степени диссоциации (a). Отношение числа молекул, распавшихся на ионы (N), к общему числу молекул (NO) называется степенью диссоциации (a).
Численное значение (a) зависит от природы растворенного вещества, температуры, концентрации раствора и принимает значение, меньше или равное единице (a £ 1). С точки зрения электролитической диссоциации кислотой называется вещество, отщепляющее в водном растворе ионы Н+, а основанием – отщепляющее ионы ОН–. Отрицательный ион, образующийся после отщепления иона Н+ от молекулы кислоты, называется кислотным остатком, а положительный ион, образующийся после отщепления от молекулы основания ОН–, называется основным остатком. Многоосновные кислоты и многокислотные основания диссоциируют ступенчато (с отрывом на каждой ступени по одному иону Н+ или ОН–). Например: H2SO3 ↔ H+ + HSO Cu(OH)2 ↔ CuOH+ + OH–; CuOH+ ↔ Cu2+ + OH–. Соли – вещества, которые при диссоциации распадаются на положительно заряженные катионы (преимущественно металлы) и отрицательно заряженные анионы кислотных остатков. В зависимости от численного значения a все электролиты условно делят на сильные (a ® 1) и слабые (a << 1). К сильным электролитам относятся хорошо растворимые соли, основания щелочных или щелочноземельных металлов (NaOH, Ba(OH)2 и др.), большинство минеральных кислот (Н2SO4, HCl, HNO3,HBr, HClO4 и др.). К слабым электролитам относятся почти все органические кислоты, некоторые минеральные кислоты (H2CO3, H2S, HCN, HF, HClO, HNO2, H2SO3 и др.), многие основания металлов (Cu(OH)2, Fe(OH)2, Ni(OH)2 и др.), труднорастворимые соли (ВаSO4, CaSO4, AgCl), гидроксид аммония (NH4OH) и вода (Н2О). Согласно теории электролитической диссоциации сильные электролиты полностью диссоциируют на ионы и процесс диссоциации протекает необратимо, например, H2SO4 ® 2H+ + SO42–. Концентрацию ионов в сильном электролите можно рассчитать, пользуясь соотношением С± = n×a×СМ, (2.7) где n – число ионов данного вида, на которые распадается одна молекула. Примечание. Определяемая на опыте величина “a” для сильных электролитов является лишь “кажущейся”, так как истинная степень диссоциации для сильных электролитов составляет 100% (a = 1). Поэтому если в условии задачи не указана степень диссоциации сильного электролита, ее следует принять равной 1. В растворах слабых электролитов одновременно имеются молекулы и ионы растворенного вещества, процесс диссоциации протекает обратимо и его можно записать в виде АmВn ↔ mА+ + nВ–. Применив к уравнению закон действующих масс, запишем выражение для константы равновесия (КС) или, в данном случае, константы диссоциации (КД):
где Константа диссоциации (КД) зависит от природы диссоциирующего вещества, растворителя, температуры и не зависит от концентрации раствора. Она характеризует способность электролита распадаться на ионы. Чем больше численное значение КД, тем в большей степени диссоциирует электролит. При ступенчатой диссоциации многоосновных кислот и многокислотных оснований КД при переходе от первой к последующим ступеням резко уменьшается: H2CO3 ↔ H+ + HCO3–, КД1 = 4,5×10-7; HCO3– ↔ H+ + CO Численные значения КД при 298 К некоторых слабых электролитов приведены в прил. 1. Взаимосвязь между КД и a устанавливается законом разбавления Оствальда:
где СМ – молярная концентрация электролита, моль/л. Для слабых электролитов (a << 1) это выражение упрощается: КД = a2 × СМ, или a = Из соотношения (2.10) следует, что с уменьшением концентрации раствора (разбавлением) a увеличивается. Концентрацию катионов и анионов в слабом электролите можно рассчитать, пользуясь соотношением (2.7), подставив в него значение a из (2.10) С± = a ×СМ =
Для слабых электролитов, диссоциируемых ступенчато, n = 1.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 445; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.104 (0.006 с.) |

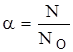 . (2.6)
. (2.6) ; HSO
; HSO  (2.8)
(2.8) – концентрации ионов в растворе электролита, моль/л;
– концентрации ионов в растворе электролита, моль/л;  – концентрация недиссоциированных молекул, моль/л.
– концентрация недиссоциированных молекул, моль/л. , КД2 = 4,7×10-11.
, КД2 = 4,7×10-11. (2.9)
(2.9) . (2.10)
. (2.10)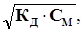 моль/л. (2.11)
моль/л. (2.11)


