
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Зависимость скорости реакции от концентрацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реагирующих веществ С помощью бюреток приготовить три раствора тиосульфата различной концентрации. С этой целью отмерить в первую пробирку 6 мл раствора тиосульфата натрия, во вторую – 4 мл того же раствора и 2 мл воды, в третью – 2 мл того же раствора и 4 мл воды. В три другие пробирки отмерить по 3 мл раствора серной кислоты. Быстро прилить кислоту в первую пробирку и встряхнуть ее несколько раз. Отмерить время от начала реакции до помутнения раствора. Так же поступить с другими приготовленными растворами тиосульфата. Требования к результатам опыта: Результаты опыта занести в табл. 1. Таблица 1
1. Рассчитать относительную скорость реакции по соотношению V = 100/τ. 2. Выразить графически зависимость скорости реакции от концентрации реагирующих веществ, откладывая на оси абсцисс относительную концентрацию, а на оси ординат – относительную скорость реакции. 3. Пояснить, какой линией выражается найденная зависимость. Проходит ли она через начало координат и почему? 4. Сделать вывод о зависимости скорости реакции от концентрации.
Опыт 2. Зависимость скорости реакции от температуры Налить в три пробирки по 3 мл раствора тиосульфата натрия, в три другие пробирки – по 3 мл раствора серной кислоты. Первую пару пробирок (кислота – тиосульфат) и термометр поместить в стакан с водой комнатной температуры. Через 3-5 мин, когда растворы в пробирках примут температуру воды, записать показания термометра. Слить растворы в одну пробирку и встряхнуть ее несколько раз. Определить время от начала реакции до появления заметной мути. Для следующего определения в стакан подлить горячей воды так, чтобы температура стала на 10 0С выше. Поместить вторую пару пробирок и оставить их на 3-5 мин, поддерживая температуру постоянной. Слить содержимое пробирок и отметить время. Повторить опыт с третьей парой пробирок, повысив температуру еще на 10 0С. Требования к результатам опыта: Данные опыта занести в табл. 2.
Таблица 2.
1. Рассчитать относительную скорость реакции по соотношению V = 100/τ. 2. Вычислить температурный коэффициент скорости реакции g, разделив V2 на V1 и V3 на V2. Найти среднее значение gср. = 3. Выразить графически зависимость скорости реакции от температуры, откладывая на оси абсцисс температуру, а на оси ординат – относительную скорость. Проходит ли кривая через начало координат и почему? 4. Сделать вывод о влиянии температуры на скорость химической реакции. Примеры решения задач Пример 4.1. Как изменится скорость реакции каждой из реакций 2NO (г) + Cl2 (г) = 2NOCI (г) (1); СаО (к) + СО2 (г) = СаСО3 (к) (2), если в каждой системе увеличить давление в 3 раза? Решение. Реакция (1) гомогенная, и согласно закону действия масс начальная скорость реакции равна v = k∙ Увеличение давления в каждой из систем в 3 раза приведет к уменьшению объма системы в 3 раза и увеличению концентрации каждого из реагирующих газообразных веществ в 3 раза. При новых концетрациях скорости реакций: v' = k∙(3 Пример 4.2. Реакция между веществами А и В выражается уравнением 2А + В = D. Начальные концентрации составляют: СА = 5 моль/л, СВ = 3,5 моль/л. Константа скорости равна 0,4. Вычислить скорость реакции в начальный момент и в тот момент, когда в реакционной смеси останется 60% вещества А. Решение. По закону действия масс v = Пример 4.3. Через некоторое время после начала реакции 2NO + O2 = 2NO2 концентрации веществ составляли (моль/л):
Решение. Исходные концентрации NO и O2 находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль 2NO2 расходуется 2моль NO. По условию задачи образовалось 0,216 моль NO2, на что израсходовалось 0,216 моль NO. Значит, исходная концентрация NO равна:
По уравнению реакции на образование 2 моль NO2 необходимо 1 моль О2, а для получения 0,216 моль NO2 требуется 0,216 / 2 = 0,108 моль/ О2. Исходная концентрация О2 равна: Таким образом, исходные концентрации составляли:
Пример 4.4. При 323 К некоторая реакция заканчивается за 30 с. Определить, как изменится скорость реакции и время ее протекания при 283 К, если температурный коэффициент скорости реакции равен 2. Решение. По правилу Вант-Гоффа находим, во сколько раз изменится скорость реакции:
Скорость реакции уменьшается в 16 раз. Скорость реакции и время ее протекания связаны обратно пропорциональной зависимостью. Следовательно, время протекания данной реакции увеличится в 16 раз и составит 30 × 16 = 480с = 8 мин. Задачи 4.1. Реакция протекает по уравнению 3Н2 + СО = СН4 + H2O Начальные концентрации реагирующих веществ были (моль/л): (Ответ: увеличится в 5 раз). 4.2. Реакция разложения N2O идет по уравнению 2N2O = 2N2 + O2. Константа скорости реакции равна 5·10–4. Начальная концентрация
4.3. Реакция между веществами А и В выражается уравнением А + 2В = D. Начальные концентрации: СА = 0,3 моль/л и СВ = 0,4 моль/л. Константа скорости равна 0,8. Вычислить начальную скорость реакции и определить, как изменилась скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,1 моль. (Ответ: 3,84 . 10-2; уменьшилась в 6 раз). 4.4. Чему равен температурный коэффициент скорости реакции, если при понижении температуры на 30°, время протекания реакции увеличилось в 64 раза? (Ответ: 4). 4.5. Вычислить, при какой температуре реакция закончится за 45 мин, если при 20 0С на это потребуется 3 ч. Температурный коэффициент скорости реакции равен 3 (Ответ: 32,6 0С). 4.6. Как изменится скорость реакции CO + Cl2 = COCl2, если повысить давление в 3 раза и одновременно повысить температуру на 30 0С (γ = 2)? (Ответ: увеличится в 72 раза). 4.7. Реакции протекают по уравнениям С (к) + О2 (г) = СО2 (г) (1); 2СО (г) + О2 (г) = 2СО2 (г) (2) Как изменится скорость (1) и (2) реакций, если в каждой системе: а) уменьшить давление в 3 раза; б) увеличить объем сосуда в 3 раза; в) повысить концентрацию кислорода в 3 раза? (Ответ: а) уменьшится в (1) в 3, во (2) в 27 раз); б) уменьшится в (1) в 3, во (2) в 27 раз); в) увеличится в (1) и (2) в 3 раза). 4.8. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости равна 0,16. Исходные концентрации водорода и иода соответственно равны 0,04 моль/л и 0,05 моль/л. Вычислить начальную скорость реакции и ее скорость, когда концентрация Н2 станет равной 0,03 моль/л. (Ответ: 3,2 . 10-3; 1,9 . 10-3). 4.9. Окисление серы и ее диоксида протекает по уравнениям: S (к) + О2 (г) = SO2 (г) (1); 2SO2 (г) + О2 (г) = 2SO3 (г) (2) Как изменится скорость (1) и (2) реакций, если в каждой системе: а) увеличить давление в 4 раза; б) уменьшить объем сосуда в 4 раза; в) повысить концентрацию кислорода в 4 раза? (Ответ: а) увеличится в (1) в 4, во (2) в 64 (раза); б) увеличится в (1) в 4, во (2) в 64 раза); в) увеличится в (1) и (2) в 4 раза). 4.10. Константа скорости реакции 2А + В = D равна 0,8. Начальные концентрации: СА= 2,5 моль/л и СВ = 1,5 моль/л. В результате реакции концентрация вещества СВ оказалась равной 0,6 моль/л. Вычислить, чему стала равна СА и скорость реакции. (Ответ: 0,7 моль/л; 0,235). 4.11. Реакция протекает по уравнению 4HCl + O2 = 2H2O + 2Cl2 Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): 4.12. Начальные концентрации веществ в реакции СО + Н2О ↔ СО2 + Н2 были равны (моль/л): CCO = 0,5; (Ответ: CCO = 0,14; 4.13. Как изменится скорость реакции 2СО + О2 = СО2, если: а) объем реакционного сосуда увеличить 3 раза; б) увеличить концентрацию СО в 3 раза; в) повысить температуру на 40 0С (γ = 2)? (Ответ: а) уменьшится в 27 раз; б) увеличится в 9 раз; в) увеличится в 16 раз). 4.14. При 10 0С реакция заканчивается за 20 минут. Сколько времени будет длиться реакция при повышении температуры до 40 0С, если температурный коэффициент равен 3? (Ответ: 44,4 с). 4.15. Реакция протекает по уравнению CO + Cl2 = COCl2 Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): 4.16. Скорость реакции А + 2В = АВ2 при СА = 0,15 моль/л и СВ = 0,4 моль/л равна 2,4 ∙ 10-3. Определить константу скорости и скорость реакции, когда концентрация В станет 0,2 моль/л. (Ответ: 0,1; 2 ∙ 10-4). 4.17. Как изменится скорость реакции 2А + В = А2В, если концентрацию вещества А увеличить в 3 раза, концентрацию вещества В уменьшить в 2 раза, а температуру повысить на 40 0С (γ = 2)? (Ответ: увеличится в 72 раза). 4.18. Реакция идет по уравнению 2H2S + 3O2 = 2SO2 + 2H2O. Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): а) концентрацию водяного пара в этот момент; б) исходные концентрации аммиака и кислорода. (Ответ: 4.19. Две реакции протекают при 25 0С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, второй – 3. Найти отношение этих скоростей при 75 0С. (Ответ: v2 / v1 = 7,59). 4.20. Реакция идет по уравнению N2 + 3H2 = 2NH3. Через некоторое время после начала реакции концентрации участвующих в ней веществ были (моль/л): (Ответ:
Лабораторная работа 5
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1050; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.008 с.) |


 ∙
∙  ; реакция (2) гетерогенная и ее скорость выражается уравнением v = k∙
; реакция (2) гетерогенная и ее скорость выражается уравнением v = k∙  . Концентрация веществ, находящихся в твердой фазе (в данной реакции СаО), не изменяется в ходе реакции, поэтому не включается в уравнение закона действия масс.
. Концентрация веществ, находящихся в твердой фазе (в данной реакции СаО), не изменяется в ходе реакции, поэтому не включается в уравнение закона действия масс. )2 ∙3
)2 ∙3  . В начальный момент скорость v1 = 0,4 × 52 × 3,5 = 35. По истечении некоторого времени в реакционной смеси останется 60% вещества А, т. е. концентрация вещества А станет равной 5 × 0,6 = 3 моль/л. Значит, концентрация А уменьшилась на 5 – 3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3,5 – 1 = 2,5 моль/л. Следовательно, v2 = 0,4 × 32 × 2,5 = 9.
. В начальный момент скорость v1 = 0,4 × 52 × 3,5 = 35. По истечении некоторого времени в реакционной смеси останется 60% вещества А, т. е. концентрация вещества А станет равной 5 × 0,6 = 3 моль/л. Значит, концентрация А уменьшилась на 5 – 3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3,5 – 1 = 2,5 моль/л. Следовательно, v2 = 0,4 × 32 × 2,5 = 9. = 0,12;
= 0,12; 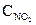 = 0,216. Найти исходные концентрации NO и O2.
= 0,216. Найти исходные концентрации NO и O2.
 =
=  = 2–4 =
= 2–4 = 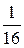 .
. = 0,8; CCO = 0,6. Как изменится скорость реакции, если концентрацию водорода увеличить до 1,2 моль/л, а концентрацию оксида углерода до 0,9 моль/л?
= 0,8; CCO = 0,6. Как изменится скорость реакции, если концентрацию водорода увеличить до 1,2 моль/л, а концентрацию оксида углерода до 0,9 моль/л? = 0,32 моль/л. Определить скорость реакции в начальный момент и в тот момент, когда разложится 50 % N2O. (Ответ: 5,12 . 10-5; 1,28 . 10-5).
= 0,32 моль/л. Определить скорость реакции в начальный момент и в тот момент, когда разложится 50 % N2O. (Ответ: 5,12 . 10-5; 1,28 . 10-5). = 0,85;
= 0,85;  = 0,6;
= 0,6;  = 0,2;
= 0,2;  = 1,2. Вычислить исходные концентрации хлора и СО. (Ответ:
= 1,2. Вычислить исходные концентрации хлора и СО. (Ответ:  = 0, 009;
= 0, 009;  = 0,003. Вычислить:
= 0,003. Вычислить: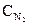 = 0,8;
= 0,8;  = 0,1. Вычислить концентрации веществ в момент, когда концентация N2 стала 0,5 моль/л.
= 0,1. Вычислить концентрации веществ в момент, когда концентация N2 стала 0,5 моль/л.


