
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение концентрации раствора кислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: изучить способы выражения концентрации растворов, научиться рассчитывать концентрацию растворов. Задание: приготовить приблизительно 0,1 н раствор соляной кислоты и установить нормальность и титр кислоты. Выполнить требования к результатам работы, оформить отчет, решить задачу.
Теоретическое введение Один из методов определения концентрации растворов – объемный анализ. Он сводится к измерению объемов реагирующих веществ, концентрация одного из которых известна. Такое измерение производится постепенным прибавлением одного раствора к другому до окончания реакции. Этот процесс называется титрованием. Окончание реакции определяется с помощью индикатора. При определении объемов растворов целесообразно использовать следующие способы выражения концентрации растворов: Молярная концентрация эквивалентов вещества В или нормальность (
где nэк(В) – количество эквивалентов вещества В, моль; mB – масса вещества В, г; Мэк(В) – молярная масса эквивалентов вещества В, г/моль; Vр – объем раствора, л. Массовая доля растворенного вещества В (ωВ) – отношение (обычно – процентное) массы растворенного вещества к массе раствора:
где mB – масса вещества В, г; mр – масса раствора, г. Если выражать массу раствора через его плотность (ρ) и объем (Vр), то
Титр раствора вещества В (ТВ) показывает массу растворенного вещества, содержащегося в 1 мл (см3) раствора:
где mB – масса растворенного вещества В, г; Vp – объем раствора, мл. Титр также можно рассчитать по формуле:
где Мэк(В) – молярная масса эквивалентов вещества В, г/моль;
Выполнение работы Опыт 1. Приготовление приблизительно 0,1 н раствора соляной кислоты Налить (под тягой) в цилиндр концентрированный раствор соляной кислоты и ареометром определить его плотность. По измеренной плотности по таблице 1 найти массовую долю (%) кислоты в растворе. Рассчитать массу кислоты, необходимую для приготовления 250 мл 0,1 н раствора HCl по формуле:
где m – масса кислоты, г; Мэк(HCl) – молярная масса эквивалентов кислоты, г/моль; сэк – молярная концентрация эквивалентов, моль/л; V – объем кислоты, л. Полученную величину (m) пересчитать на объем, который требуется для приготовления 250 мл 0,1 н раствора кислоты по формуле:
где V – объем кислоты, мл; m – масса кислоты,г; ω – массовая доля в % HCl, найденная по таблице 1; ρ – плотность кислоты, г/см3, измеренная ареометром. Пипеткой отобрать рассчитанный объем раствора кислоты, перенести его в мерную колбу, разбавить водой до метки и хорошо перемешать.
Опыт 2. Установление нормальности и титра кислоты Отмерить пипеткой 10 мл приготовленного раствора кислоты, перенести его в коническую колбу, добавить 1-2 капли фенолфталеина. В бюретку налить 0,1 н раствор NaOH. Оттитровать раствор кислоты. Для этого медленно приливать из бюретки щелочь в колбу с раствором кислоты, непрерывно перемешивая его в процессе титрования. Место, в которое падают капли щелочи, окрашивается в розовый цвет, исчезающий при взбалтывании. Титрование проводить до тех пор, пока от одной капли щелочи раствор примет неисчезающую окраску. Титрование повторить. Результаты не должны отличаться более чем на 0,1 мл. Требования к результату опыта: Данные опыта занести в таблицу:
Вычислить: 1. Молярную концентрацию эквивалентов раствора кислоты по закону эквивалентов: сэк (HCl)∙V(HCl) = сэк (NaOH)∙V(NaOH), откуда
где сэк (HCl) и сэк (NaOH) – молярные концентрации эквивалентов растворов; V(HCl) и V(NaOH) – объемы реагирующих растворов. 2. Титр раствора НСl по формуле:
Таблица 1. Плотность раствора соляной кислоты
Примеры решения задач В химической практике наиболее употребительны следующие способы выражения концентрации растворов: Молярная концентрация вещества В или молярность (сВ или М) – отношение количества растворенного вещества к объему раствора:
где nB – количество вещества В, моль; mB – масса вещества В, г; МВ – молярная масса вещества В, г/моль; Vр – объем раствора, л. Молярная концентрация эквивалентов вещества В или нормальность (
где nэк(В) – количество эквивалентов вещества В, моль; mB – масса вещества В, г; Мэк(В) – молярная масса эквивалентов вещества В, г/моль; Vр – объем раствора, л. Моляльная концентрация вещества В или моляльность (сm(B)) – отношение количества растворенного вещества к массе растворителя:
где nВ – количество вещества В, моль; mB – масса вещества В,г; mS – масса растворителя, г; МВ - молярная масса вещества В, г/моль. Массовая доля растворенного вещества В (ωВ) – отношение (обычно – процентное) массы растворенного вещества к массе раствора:
где mB – масса вещества В, г; mр – масса раствора, г. Если выражать массу раствора через его плотность (ρ) и объем (Vр), то
Молярная (мольная) доля вещества В (х В, безразмерная величина) ─ отношение количества данного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель. Если раствор состоит из одного растворенного вещества и растворителя, то молярная доля вещества (хВ) равна:
а молярная доля растворителя (хs):
где nB – количество растворенного вещества, моль; nS – количество вещества растворителя, моль. Сумма молярных долей всех веществ раствора равна единице. Титр раствора вещества В (ТВ) показывает массу растворенного вещества, содержащегося в 1 мл (см3) раствора:
где mB – масса растворенного вещества В, г; Vp – объем раствора, мл. Титр также можно рассчитать по формулам:
где Мэк(В) – молярная масса эквивалентов вещества В, г/моль;
где ωВ – массовая доля вещества В; ρ – плотность раствора, г/см3. Пример 5.1. Водный раствор содержит 354 г H3PO4 в 1 л. Плотность раствора ρ = 1,18 г/мл. Вычислить: а) массовую долю (%) H3PO4 в растворе; б) молярную концентрацию; в) молярную концентрацию эквивалентов; г) моляльность; д) титр; е) молярные доли H3PO4 и Н2О. Решение. а) Для расчета массовой доли воспользуемся формулой (5):
б) Молярная масса H3PO4 равна 98 г/моль. Молярную концентрацию раствора находим из соотношения (1):
в) Молярная масса эквивалентов H3PO4 равна
г) Для определения моляльности по формуле (3) необходимо рассчитать массу растворителя в растворе. Масса раствора составляет 1,18 ∙ 1000 = 1180 г. Масса растворителя в растворе mS = 1180 – 354 = 826 г. Моляльная концентрация раствора равна:
д) Титр раствора можно рассчитать по формулам (8), (9), (10):
е) В 1 л раствора содержится 3,61 моль H3PO4 (см. пункт б). Масса растворителя в растворе 826 г, что составляет Молярные доли H3PO4 и Н2О рассчитываем по формулам (6) и (7):
Пример 5. 2. Сколько миллилитров 50 %-ного раствора HNO3, плотность которого 1,32 г/мл, требуется для приготовления 5 л 2 %-ного раствора, плотность которого 1,01 г/мл? Решение. При решении задачи пользуемся формулой (5). Сначала находим массу азотной кислоты в 5 л 2 %-ного раствора:
Чтобы ответить на вопрос задачи, надо определить, в каком объеме раствора с массовой долей HNO3 50 % содержится 101 г HNO3:
Таким образом, для приготовления 5 л 2 %-ного раствора HNO3 требуется 153 мл 50 %-ного раствора HNO3. Пример 5. 3. На нейтрализацию 50 мл раствора 25 мл 0,5 н раствора щелочи. Чему равна нормальность кислоты? Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать VA ∙ cэк(А) = VB ∙ сэк(B) 50 ∙ сэк(кислоты) = 25 ∙ 0,5, отсюда сэк(кислоты) = Следовательно, для реакции был использован 0,25 н раствор кислоты.
Задачи 5. 1. В одном литре раствора содержится 10,6 г карбоната натрия Na2CO3. Рассчитать молярную концентрацию, молярную концентрацию эквивалентов и титр раствора. (Ответ: 0,1 М; 0,2 н; 10,6∙10-3 г/мл) 5.2. Вычислить молярную концентрацию и молярную концентрацию эквивалентов 20 %-ного раствора хлорида кальция плотностью 1,178 г/мл. (Ответ: 2,1 М; 4,2 н). 5.3. Сколько моль HNO3 содержится в 250 мл раствора с массовой долей кислоты 30 % и плотностью, равной 1,18 г/мл? (Ответ: 1,40 моль). 5.4. Водный раствор содержит 5 г CuSO4 в 45 г воды. Плотность раствора равна 1,107 г/мл. Вычислить массовую долю (%) CuSO4 в растворе, а также моляльность и мольные доли CuSO4 и Н2О. (Ответ: 9 %; 0,694 моль/кг; 0,012; 0,988). 5.5. Вычислить титры растворов: а) 0,05 М NaCl; б) 0,004 н Ca(OH)2; в) 30 %-ного КОН, ρ = 1,297 г/мл. (Ответ: а) 0,00292 г/мл; б) 0,148 ∙ 10‾3 г/мл; в) 0,389 г/мл). 5.6. Чему равна нормальность 30 %-ного раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Получился раствор плотностью 1,054 г/мл. Вычислить массовую долю (%) NaOH в полученном растворе. (Ответ: 9,96 н; 6,3 %). 5.7. В 1 кг воды растворили 666 г КОН, плотность раствора равна 1,395 г/мл. Вычислить массовую долю КОН в полученном растворе, молярность и мольные доли щелочи и воды. (Ответ: 40 %; 9,96 моль/л; 0,176; 0,824). 5.8. Какой объем 2 М раствора К2СО3 надо взять для приготовления 1 л 0,25 н раствора? (Ответ: 62,5 мл). 5.9. Из 600 г 5 %-ного раствора сульфата меди упариванием удалили 100 г воды. Чему равна массовая доля CuSO4 в оставшемся растворе? (Ответ: 6 %). 5.10. Какой объем 50 %-ного КОН (ρ = 1,538 г/мл) требуется для приготовления 3 л 6 %-ного раствора (ρ = 1,048 г/мл)? (Ответ: 245,3 мл). 5.11. Из 5 л раствора гидроксида калия с массовой долей КОН 50 % и плотностью 1,538 г/мл надо приготовить раствор с массовой долей КОН 18 %. Какой объем воды потребуется? (Ответ: 17,5 л). 5.12. Вычислить моляльную и молярную концентрацию эквивалентов 20,8 %-ного раствора HNO3 плотностью 1,12 г/мл. Сколько граммов кислоты содержится в 4 л этого раствора? (Ответ: 4,17 моль/кг; 3,7 н; 931,84 г). 5.13. Сколько миллилитров 0,2 М раствора Na2CO3 требуется для реакции с 50 мл 0,5 М раствора CaCl2? (Ответ: 125 мл). 5.14. Плотность 15 %-ного раствора Н2SO4 1,105 г/мл. Вычислить молярность, моляльность и молярную концентрацию эквивалентов раствора серной кислоты. (Ответ: 1,69 моль/л; 1,8 моль/кг; 3,38 моль/л). 5.15. Сколько миллилитров раствора соляной кислоты с плотностью 1,195 г/мл, содержащей 38 % HCl, нужно для приготовления 1 л 2 н раствора? (Ответ: 160,7 мл). 5.16. При растворении 18 г Н3РО4 в 282 мл воды получили раствор фосфорной кислоты, плотность которого 1,031 г/мл. Вычислить молярную, моляльную, молярную концентрацию эквивалентов полученного раствора и его титр. (Ответ: 0,63 М; 0,65 моль/кг; 1,89 н; 0,062 г/мл). 5.17. На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г щелочи, израсходовано 24 мл 0,25 н раствора кислоты. Вычислить молярную массу эквивалентов щелочи. (Ответ: 40 г/моль). 5.18. На нейтрализацию 31 мл 0,16 н раствора щелочи требуется 217 мл раствора H2SO4. Чему равны нормальность и титр раствора H2SO4? (Ответ: 0,023 н; 1,127∙10‾3 г/мл). 5.19. Смешали 10 мл 10 %-ного раствора HNO3 (ρ = 1,056 г/мл) и 100 мл 30 %-ного раствора HNO3 (ρ = 1,184 г/мл). Вычислить массовую долю HNO3 в полученном растворе. (Ответ: 28,36 %). 5.20. Вычислить массовую долю (%) нитрата серебра в 1,4 М растворе, плотность которого 1,18 г/мл. (Ответ: 20,2 %). Лабораторная работа 6
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 5385; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.156.84 (0.007 с.) |

 (В) или н) – отношение количества эквивалентов растворенного вещества к объему раствора:
(В) или н) – отношение количества эквивалентов растворенного вещества к объему раствора: , моль/л,
, моль/л,
 ,
,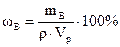
 , г/мл,
, г/мл, , г/мл,
, г/мл,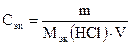 , откуда m = сэк · Мэк(HCl) · V,
, откуда m = сэк · Мэк(HCl) · V, , откуда V =
, откуда V =  ,
, , моль/л
, моль/л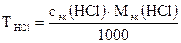 , г/мл
, г/мл , моль/л, (1)
, моль/л, (1)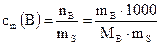 , моль/кг, (3)
, моль/кг, (3) , (6)
, (6)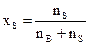 , (7)
, (7)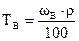 , г/мл, (10)
, г/мл, (10) %
% =
=  3,61 моль/л.
3,61 моль/л. 32,7 г/моль. Молярную концентрацию эквивалентов рассчитываем по формуле (2):
32,7 г/моль. Молярную концентрацию эквивалентов рассчитываем по формуле (2): =
=  10,83 моль/л.
10,83 моль/л.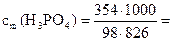 4,37 моль/кг
4,37 моль/кг =
=  0,354 г/мл,
0,354 г/мл, 0,354 г/мл,
0,354 г/мл, 0,354 г/мл.
0,354 г/мл. 45,9 моль.
45,9 моль. 0,073;
0,073; 0,927.
0,927. 101 г.
101 г. 153 мл
153 мл 0,25 моль/л
0,25 моль/л


