
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Электролиз раствора иодида калияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В U-образную трубку налить приблизительно до половины раствора иодида калия. Вставить в оба колена трубки угольные электроды и подключить прибор к источнику постоянного электрического тока. Наблюдать окрашивание раствора у анода и выделение газа на катоде. Отключить ток и прибавить 2-3 капли раствора фенолфталеина в катодное пространство. Что наблюдается? Требования к результатам опыта: 1. Составить схему электролиза водного растворов иодида калия. Написать уравнения электродных и суммарной реакций. Указать продукты электролиза. 2. Какое вещество обусловливает окраску индикатора? Указать рН раствора.
Опыт 2. Электролиз раствора сульфата натрия В U-образную трубку налить раствор сульфата натрия. Погрузить электроды, включить ток и наблюдать выделение пузырьков газа на электродах. Через 1-2 мин отключить ток и добавить в оба колена трубки по несколько капель раствора лакмуса. В какие цвета окрашивается лакмус? Требования к результатам опыта: 1. Составить схему электролиза водного раствора сульфата натрия. Написать уравнения электродных и суммарной реакций. Указать продукты электролиза. 2. Указать вещества, которые образуются у катода и анода и изменяют окраску индикатора. Каково значение рН в анодном и катодном пространстве? Опыт 3. Электролиз раствора сульфата меди Налить в U-образную трубку раствор сульфата меди. Пользуясь угольными электродами, пропускать ток в течение 4-5 мин. Что выделяется на электродах? Требования к результатам опыта: 1. Составить схему электролиза водного раствора CuSO4. Написать уравнения электродных и суммарной реакций. Указать продукты электролиза. 2. Назвать вещество, которое образуется у анода (в анодном пространстве) и указать рН среды.
Опыт 4. Электролиз с растворимым анодом Присоединить электрод с отложившейся в предыдущем опыте медью к положительному полюсу источника тока, а другой электрод – к отрицательному полюсу, пропускать электрический ток. Наблюдать растворение меди с анода и выделение ее на катоде. Требование к результатам опыта: Составить схему электролиза раствора сульфата меди с медным анодом. Написать уравнения электродных реакций.
Примеры решения задач Пример 8.1. Сколько граммов никеля выделится на катоде при пропускании через раствор сернокислого никеля NiSO4 тока силой 5 А в течение 10 мин? Привести схемы электродных процессов, протекающих при электролизе с инертным анодом. Определить продукты электролиза. Решение. В водном растворе сульфат никеля (II) диссоциирует: NiSO4 = Ni2+ + SO42–. Стандартный электродный потенциал никеля (–0,250 В) выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Ni2+ и выделение металлического никеля. При электролизе сернокислых солей на инертном аноде происходит электрохимическое окисление воды с выделением кислорода. Катод Ni2+, Н2О Анод SO42–, Н2О На катоде: Ni2+ + 2ē = Ni На аноде: 2Н2О – 4ē = 4Н+ + О2 Продукты электролиза – Ni и О2, У анода: 4Н+ + 2SO42– = 2Н2SO4 Масса вещества, выделившегося на электроде при электролизе, определяется по законам Фарадея, математическое выражение которых имеет вид: m = где m – масса вещества, выделившегося на электроде, г; Мэк – молярная масса эквивалентов этого вещества, г/моль; Q – количество электричества, прошедшего через электролит, Кл; F – постоянная Фарадея, равная 96500 Кл/моль∙экв. Q = I ∙ t, где I – сила тока, А; t – время, электролиза, с. Подставляя в формулу (1) вместо Q его значение, получаем m Молярная масса эквивалентов никеля (молярная масса атомов никеля – 58,71 г/моль) равняется 58,71 / 2 = 29,36 г/моль. Подставляя это значение, а также силу тока и время электролиза (в секундах) в формулу m Пример 8.2. Сколько времени нужно пропускать через раствор кислоты ток силой 10 А, чтобы получить 5,6 л водорода (при н. у.)? Решение. Продукт электролиза представляет собой газообразное вещество, поэтому для решения воспользуемся уравнением V газа Так как 1 моль эквивалентов водорода занимает при нормальных условиях объем 11,2 л, то искомое количество времени прохождения тока: t Пример 8.3. При проведении электролиза водного раствора хлорида двухвалентного металла затрачено 3561 Кл электричества. В результате процесса на катоде выделилось 2,19 г этого металла. Определить металл, водный раствор хлорида которого подвергли электролизу. Привести схему электродных процессов. Определить продукты электролиза. Решение. Находим молярную массу эквивалентов металла: Мэк Катод Sn2+, Н2О Анод С1–, Н2О Катодный процесс: Sn2+ + 2ē = Sn Анодный процесс: 2С1– –2ē = С12 Продукты электролиза – Sn и С12. Пример 8.4. При электролизе раствора CuSO4 на угольном аноде выделилось 350 мл кислорода при нормальных условиях. Сколько граммов меди выделилось на катоде? Привести уравнения электродных процессов, определить продукты электролиза. Решение. В водном растворе сульфат меди(II) диссоциирует по схеме: CuSO4 = Cu2+ + SO42-. Электродный потенциал меди (+0,337 В) значительно больше потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде происходит процесс восстановления ионов Cu2+. При электролизе водных растворов сульфат-анионы не окисляются на аноде. На нем происходит окисление воды. Катод Cu2+, Н2О Анод SO42–, Н2О На катоде: Cu2+ + 2ē = Сu На аноде: 2Н2О – 4ē = 4Н+ + О2. Продукты электролиза – Сu и О2. У анода: 4Н+ + 2SO42– = 2Н2SO4 Один моль эквивалентов кислорода при н.у. занимает объем 5,6 л. Следовательно, 350 мл составляют 0,35 / 5,6 = 0,0625 моль. Столько же молей эквивалентов выделилось на катоде. Отсюда, масса меди m = Пример 8.5. Будут ли, и в какой последовательности, восстанавливаться на катоде одновременно присутствующие в растворе (в равных концентрациях) ионы А13+, Ni2+, Sn2+, Au3+ и Mg2+? Напряжение достаточно для выделения любого металла. Решение. На катоде сначала восстанавливаются катионы, имеющие большее значение электродного потенциала (таблица стандартных элекродных потенциалов) Поэтому, в первую очередь, на катоде будут восстанавливаться ионы Au3+ (+1,498 В), далее Sn2+ (–0,136 В) и, наконец, Ni2+ (–0,250 В). Ионы А13+ (–1,662 В) и Mg2+ (–2,363 В), имеющие значения электродного потенциала значительно отрицательнее потенциала восстановления ионов Н+ из воды (–0,41 В), при электролизе водных растворов не восстанавливаются на катоде. При электролизе их солей протекает восстановление молекул воды: 2Н2О + 2ē = Н2 + 2ОН–.
Задачи 8.1. Водный раствор, содержащий смесь нитратов серебра, калия, цинка с одинаковыми концентрациями, подвергли электролизу. Указать значение молярной массы вещества, которое будет восстанавливаться на катоде в первую очередь. Привести уравнения электродных процессов, происходящих на графитовых электродах для всех солей. 8.2. При электролизе водных растворов каких из приведенных ниже веществ на катоде выделяется только металл: хлорид бария, хлорид меди (II), иодид калия, нитрат серебра, сульфид натрия? Привести соответствующие уравнения электродных процессов. 8.3. При электролизе водных растворов каких из приведенных ниже веществ на катоде выделяется только водород: хлорид калия, хлорид никеля (II), бромид кальция, нитрат серебра, иодид натрия? Привести соответствующие уравнения электродных процессов. 8.4. Среди приведенных ниже соединений указать вещества, продукты электролиза которых одинаковы как для растворов, так и для расплавов: фторид серебра, хлорид меди (II), иодид калия, гидроксид натрия. Привести соответствующие уравнения электродных процессов. 8.5. Сколько граммов меди выделилось на катоде при электролизе раствора CuSO4 в течение 40 мин при силе тока 1,2 А? Привести уравнения электродных процессов. (Ответ: 0,948 г). 8.6. Для выделения 1,75 г некоторого металла из раствора его соли потребовалось пропускать ток силой 1,8 А в течение 1,5 ч. Вычислить молярную массу эквивалентов металла. (Ответ: 17,37 г/моль). 8.7. При электролизе раствора CuCl2 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде. Привести уравнения электродных процессов. (Ответ: 1,59 г). 8.8. При электролизе в течение 1 ч водного раствора нитрата висмута Bi(NO3)3 на катоде выделилось 14 г висмута. Выход по току составляет 94%. Вычислить силу тока. (Ответ: 5,73 А). 8.9. Через электролизеры с водными растворами нитрата ртути (II) и нитрата серебра пропустили одинаковое количество электричества. При этом выделилась ртуть массой 401,2 г. Чему равна масса выделившегося серебра? Привести уравнения электродных процессов. (Ответ: 432 г). 8.10. При электролизе водного раствора SnCl2 на аноде выделилось 4,48 л хлора (условия нормальные). Найти массу выделившегося на катоде олова. Привести уравнения электродных процессов. (Ответ: 23,74 г). 8.11. Сколько минут следует пропускать ток силой 0,5 А через раствор нитрата серебра для выделения 0,27 г серебра? Привести уравнения электродных процессов. (Ответ: 8 мин). 8.12. При какой силе тока можно получить на катоде 0,5 г никеля, подвергая электролизу раствор сульфата никеля в течение 25 мин? (Ответ: 1,1 А). 8.13. Раствор содержит ионы Fe3+, Cu2+, Sn2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточно для выделения любого металла? Ответ обосновать. 8.14. При электролизе раствора AgNO3 в течение 50 мин при силе тока 3 А на катоде выделилось 9,6 г серебра. Определить выход серебра в процентах от теоретически возможного. Привести уравнения электродных процессов. (Ответ: 95,4%). 8.15. Какие вещества и в каком объеме можно получить при нормальных условиях на нерастворимом аноде при электролизе водного раствора КОН, если пропустить ток силой 13,4 А в течение 2 ч? Привести уравнения электродных процессов. (Ответ: 1,2 л; 5,6 л). 8.16. Сколько времени потребуется для выделения на катоде 4 г вещества при электролизе расплава хлорида кальция при токе силой 1А? Привести уравнения электродных процессов. (Ответ: 5,36 ч). 8.17. Через водный раствор сульфата цинка пропущено 8407 Кл электричества. При этом на катоде выделилось 1,9 г цинка. Рассчитать катодный выход цинка по току. Привести уравнения электродных процессов. (Ответ: 67%). 8.18. Вычислить объем кислорода (нормальные условия), выделившегося у анода при электролизе водного раствора сульфата меди, если сила тока составляла 5 А, а продолжительность электролиза 1 ч. (Ответ: 1,04 л). 8.19. Вычислить количество электричества, которое необходимо пропустить через раствор хлорида натрия, чтобы получить 1 т гидроксида натрия. Привести схемы электродных процессов. (Ответ: 2412,5×109 Кл). 8.20. При электролизе водного раствора СuCl2 с медным анодом масса анода уменьшилась на 1,4 г. Определить расход электричества при этом, если выход по току составляет 73%. Составить уравнения электродных процессов, определить продукты электролиза. (Ответ: 5825 Кл).
Библиографический список 1. Глинка Н. Л. Общая химия. – М.: Интеграл-Пресс, 2009. –727 с. 2. Коровин Н. В. Общая химия. – М.: Высш. шк., 2008. – 558 с. 3. Глинка Н. Л. Задачи и упражнения по общей химии. – М.: Интеграл-Пресс, 2009. – 240 с. 4. Задачи и упражнения по общей химии /под ред. Н. В. Коровина. – М.: Высш. шк., 2008. – 255 с.
Приложение Таблица 1. Стандартные энтальпии образования ∆fН0298 , энтропии S0298 и энергии Гиббса образования ∆fG0298 некоторых веществ при 298 К (25 °С)
Таблица 2. Растворимость солей и оснований в воде (Р – растворимое, М – малорастворимое, H – практически нерастворимое вещество, прочерк – означает, что вещество не существует или разлагается водой)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1831; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.44.207 (0.008 с.) |

 , (1)
, (1)
 .
.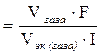 =
=  4825 c =1ч 20мин 25с.
4825 c =1ч 20мин 25с.
 = 59,347 г/моль. Умножая эту величину на 2 (валентность металла) получаем 118,69 г/моль, что соответствует молярной массе атомов олова. Следовательно, электролизу подвергли раствор SnCl2. В водном растворе хлорид олова (II) диссоциирует: SnС12 = Sn2+ + 2С1–. Стандартный электродный потенциал олова (II) (–0,136 В) существенно выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Sn2+ и выделение металлического олова. На аноде будут окисляться анионы хлора.
= 59,347 г/моль. Умножая эту величину на 2 (валентность металла) получаем 118,69 г/моль, что соответствует молярной массе атомов олова. Следовательно, электролизу подвергли раствор SnCl2. В водном растворе хлорид олова (II) диссоциирует: SnС12 = Sn2+ + 2С1–. Стандартный электродный потенциал олова (II) (–0,136 В) существенно выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Sn2+ и выделение металлического олова. На аноде будут окисляться анионы хлора. × 0,0625 = 1,98 г.
× 0,0625 = 1,98 г.


