
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скачек потенциала на границе металл / раствор.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
При погружении металла в водный раствор его соли (такая система называется электродом I рода) часть катионов кристаллической решетки сольватируется полярными молекулами воды и переходит в раствор, заряжая его положительно. Металл, в котором появился избыток электронов, заряжается отрицательно. Отрицательный заряд металла препятствует дальнейшему переходу катионов в раствор, и в системе устанавливается равновесие, которому соответствует определенное значение равновесного скачка потенциала между металлом и раствором, величина которого зависит от природы металла, концентрации ионов металла в растворе и температуры. Некоторые металлы (например, золото, платина) обладают столь прочной кристаллической решеткой, что катионы не могут освободиться. Если такой металл погрузить в электролит, содержащий ионы, в состав которых входят элементы в различных степенях окисления (такие системы называют окислительно-восстановительными, или редокс-электродами), то будет происходить обмен электронами между инертным электродом и ионами, что также приведет к образованию двойного электрического слоя и возникновению равновесного скачка потенциала. Двойной электрический слой и соответствующая разность потенциалов возникают также при ионообменных процессах на границах: стекло/раствор, ионообменная смола/раствор и др. Энергию, необходимую для отрыва иона от металла обозначим через UMe, а выделяющуюся при гидратации (сольватации) иона в растворе —через Uсольв. Энергия UMe зависит только от природы металла, энергия Uсольв зависит от природы ионов, их активности в растворе и от природы растворителя. Если металлическую пластинку (электрод) опустить в раствор своей соли, то в зависимости от соотношения UMe / Uсольв возможны различные начальные электродные процессы. 1. При Uсольв > UMe в начальный момент ионы Mez+ преимущественно будут переходить в раствор. Возможен и обратный процесс — дегидратация ионов Меz+ и осаждение его на поверхности металла. Однако в начальный момент он будет протекать с меньшей скоростью, чем первый процесс. При Uсольв > UMe металлическая пластинка заряжается отрицательно — на ней избыток электронов, а прилегающий к ней слой растворителя — положительно — избыток катионов, которые электростатическими силами удерживаются в непосредственной близости у поверхности электрода. Образуется двойной электрический слой, несколько напоминающий плоский конденсатор. Возникает скачок потенциала между металлом и раствором.
По мере протекания рассматриваемых процессов на электроде будет изменяться соотношение UMe / Uсольв и, наконец, наступит такой момент, когда UMe = Uсольв , скорости обоих процессов выравняются, устанавливается равновесие, скачок потенциала— электродный потенциал достигает равновесного значения, 2. При UMe > Uсольв в начальный момент ионы Меz+ преимущественно переходят из раствора на поверхность электрода. Металлическая пластинка заряжается положительно, а прилегающий к электроду раствор отрицательно — избыток анионов. При UMe = Uсольв устанавливается динамическое равновесие. Устройство, которое позволяет получить электрическую работу за счет энергии химической реакции, называют гальваническим элементом. Гальванический элемент состоит из двух электродов, представляющих собой систему из электронного проводника (обычно металла) и раствора одного или нескольких электролитов, находящегося с ним в контакте. На границе фаз такой системы по причинам, указанным выше, существует скачок потенциала. Разность потенциалов на концах разомкнутого гальванического элемента называется его электродвижущей силой (э. д. с.). Электродвижущая сила гальванического элемента (Е) слагается из скачков потенциала на границах фаз. При работе гальванического элемента химическая энергия реакции, протекающей в нем, переходит в электрическую энергию. В качестве примера рассмотрим гальванический элемент, состоящий из серебряного и медного электродов, которые погружены соответственно в растворы AgNO3 и CuSO4. Рассматриваемый элемент может быть записан в виде (–) Cu / CuSO4 // AgNO3 / Ag (+), (1) где вертикальная черточка обозначает поверхность раздела металл — раствор, а двойная вертикальная — раствор — раствор. В результате работы элемента на медном электроде будут образовываться и переходить в раствор ионы меди (процесс окисления):
а на серебряном электроде будут разряжаться ионы Ag+ и осаждаться металлическое серебро (процесс восстановления):
Процессы окисления и восстановления в гальваническом элементе протекают раздельно. Электрод, на котором протекает процесс окисления (2а), является отрицательным, а тот электрод, на котором происходит восстановление (2б), — положительным. Во внешней же цепи элемента отрицательные заряды — электроны будут двигаться от медного электрода к серебряному. Суммарный химический процесс, протекающий в элементе (1) слагается из отдельных процессов у электродов и выражается уравнением
Если электродные процессы и химическая реакция в гальваническом элементе могут быть осуществлены в прямом (при работе элемента) и обратном (при пропускании электрического тока через элемент в противоположном направлении) направлениях, то такие электроды и гальванический элемент носят название обратимых. В частности, гальванический элемент (1) можно отнести к обратимым элементам. При его работе протекают на электродах процессы (2а) и (2б). При пропускании же через него электрического тока в обратном направлении на медном электроде будут разряжаться ионы Сu2+ и выделяться металлическая медь, а на серебряном электроде — образовываться ионы Ag+ и переходить в раствор. В этом случае электрохимическая реакция (3) будет протекать справа налево. Максимальная полезная электрическая работа при постоянных температуре и давлении равна убыли энергии Гиббса — zFE = – где z — количество электронов, участвующих в электродных процессах; F— число Фарадея; Е — э. д. с. гальванического элемента. Пусть в гальваническом элементе при постоянной температуре и постоянном давлении протекает обратимая реакция
Если реакция совершила один пробег, то изменение энергии Гиббса может быть определено из уравнения изотермы реакции
где Кa — константа равновесия рассматриваемой химической реакции; ai — активность i -го реагента в момент приготовления гальванического элемента. Из (4) и (6) следует
Если активности каждого реагента равны единице (все вещества вступают в реакцию в стандартных состояниях), то уравнение (7) запишется в виде
где Е° — стандартная э. д. с. гальванического элемента. Подставляя это выражение в (7), получаем в общем виде уравнение
связывающее э.д.с. гальванического элемента с активностями реагирующих веществ. Подставляя в последнее уравнение значения R = 8,314 Дж/(моль-К), F = 96485 Кл/моль экв и заменив натуральный логарифм десятичным, получим при 298,15 К:
В частности, для э.д.с. гальванического элемента (1), в котором протекает суммарная реакция (3), будем иметь
Так как активность чистого твердого вещества принимается равной единице, то последнее уравнение для э. д. с. гальванического элемента (1) принимает вид
или
ТИПЫ ЭЛЕКТРОДОВ. Электроды первого рода. К ним в первую очередь относятся электроды, обратимые относительно катиона, и металлоидные, обратимые относительно аниона. В общем виде схема электрода, обратимого по отношению к катиону Меz+, записывается так Mez+/Me, например, Cu2+/Cu а электродная обратимая реакция в виде
Для электрода, обратимого относительно аниона Аz-, схема записи электрода следующая Аz-/А, например Se2-/Se Электродная обратимая реакция
К электродам первого рода относятся также амальгамные электроды Mez+/Me, Hg газовые электроды и, в частности, водородный электрод H3O/H2, Pt и кислородный электрод OH-/O2, Pt на водородном электроде протекает реакция
а его стандартный потенциал условно принимаем равным нулю при любой температуре. Электродвижущая сила гальванического элемента может быть представлена как алгебраическая сумма равновесных потенциалов. Так для элемента (1): (–) Cu / CuSO4 // AgNO3 / Ag (+)
будем иметь три равновесных потенциала; два из них Э.д.с. цепи (1) будет равна
Диффузионный потенциал
где Диффузионный потенциал определяется разностью в подвижности катионов и анионов. Если (–) Cu / CuSO4 // AgNO3 / Ag (+)
Если диффузионный потенциал устранен, то э. д. с. цепи (1) будет равна
Абсолютные значения равновесных электродных потенциалов не удалось определить экспериментально и вычислить теоретически. Можно опытным путем лишь определить э.д. с. гальванического элемента. Определение электродного потенциала на практике сводится к измерению э.д.с. гальванического элемента, в котором в качестве электрода сравнения берется нормальный водородный электрод. Если электрод Меz+|Ме в рассматриваемом элементе играет роль положительного полюса, то в нем протекает реакция
Электродвижущая сила гальванического элемента
Согласно (10)
где Так как аМе для чистого металла принимается равной единице, то равновесный потенциал электрода Меz+|Ме описывается уравнением
или при 298,15 К
где Значения стандартных потенциалов, вычисленных по отношению к нормальному водородному электроду, табулированы (см. справочник Р., табл. 79). Итак, относительный потенциал электрода Меz+|Ме равен электродвижущей силе элемента, составленного из электрода Меz+|Ме и нормального водородного электрода. Этот вывод является справедливым для любого типа электродов. Воспользовавшись уравнением (15), получим для э. д. с. элемента (1)
Для электрода Аz-|А, обратимого относительно аниона Аz -, легко показать, что для относительного потенциала
или при 298,15 К
где В уравнения для электродного потенциала под знаком логарифма входит активность (активности) иона, по отношению к которому электрод является обратимым. Мы не располагаем методами, которые позволили бы экспериментальным путем определить активность отдельных ионов. Поэтому пришлось ввести понятие средней геометрической активности электролита, которая используется при соответствующих расчетах вместо активности отдельных ионов, например, в уравнениях (15) и (17). Для электролита
средняя геометрическая активность
и средний коэффициент активности
где а+ и а-, v+ и v -— активности и коэффициенты активности катиона Аz+ и аниона Вz- соответственно; v=v++v-. Средняя активность электролита связана со средним коэффициентом активности и моляльностью т электролита
Для бинарного электролита (AgNO3, CuSO4 и т. п.)
Значения коэффициентов активности для некоторых электролитов при различных значениях моляльности в растворе приводятся в справочниках (см. cправочник Р., табл. 72). В тех случаях, когда значение коэффициента активности неизвестно, можно с некоторым приближением вычислить его по уравнению
где z+ и z -—валентности катиона и аниона соответственно; I — ионная сила раствора, Электроды второго рода. Электрод второго рода представляет собой металл, покрытый труднорастворимым соединением данного металла (соль, оксид, гидроксид), находящийся в контакте с раствором, который содержит общий анион с труднорастворимым соединением металла. В том случае, когда труднорастворимым соединением данного металла является оксид или гидроксид, роль аниона в растворе играет ион гидроксида. К электродам второго рода можно отнести, например, полуэлементы: OH–|HgO, Hg; Cl–|AgCl, Ag Последний полуэлемент — хлорсеребряный электрод широко используется в лабораторной практике как электрод сравнения. Рассмотрим несколько подробнее электроды типа
Аz- | МеА, Me (23) На нем могут протекать следующие электрохимические реакции
где Во втором случае потенциал электрода (
где аМеz+ — активность ионов Меz+ в растворе. Так как раствор по отношению МеА является насыщенным, то
Подставив аМеz+ из уравнения (28) в (27), получим
Из (26) и (29) непосредственно вытекает соотношение
Хлорсеребряный электрод. Хлорсеребряный электрод Cl–|AgCl,Ag хорошо воспроизводим и прост в изготовлении. Потенциал хлорсеребряного электрода при 298,15 К согласно уравнению (26) определяется уравнением
где Зависимость стандартного потенциала хлорсеребряного электрода от температуры дается уравнением
где t — температура, °С. Для изготовления хлорсеребряного электрода на платиновую проволоку, впаянную в стеклянную трубку, электролитическим путем наносят серебро. Поверхностный слой серебра переводят электролизом в хлорид серебра. Электролиз проводят в разбавленном растворе хлороводородной кислоты. По окончании процесса электролиза тщательно промывают электрод водой и затем помещают в электродный сосуд с насыщенным раствором хлорида калия (или НСl) и хлорида серебра.
Каломельный электрод. На рис.1(каломельный электрод): 1,4 — ртуть; 2 — платиновая проволока; 3 — паста из каломели; 5 — пробка; 6 — боковая трубка; 7 — сифон; 8 — раствор хлорида калия. Из электродов второго рода в качестве электрода сравнения получил также распространение каломельный электрод: KC l / Hg2Cl2,Hg Его потенциал при 298, 15 К
где Для приготовления каломельного электрода обычно применяют 0,1; 1; 3,5 н. и насыщенный растворы КСl. Наиболее постоянные потенциалы получают при использовании двух первых растворов КСl. Но проще изготовить электрод с насыщенным раствором КСl, Рис. 1 – Каломельный поэтому его чаще всего используют в лабораторном практикуме. электрод. Зависимость потенциала с насыщенным КСl от температуры выражается уравнением
Каломельный электрод изготовляют следующим образом. На дно сосуда (см. рис.1) наливают небольшое количество химически чистой (хч) ртути, в которую погружают амальгированную платиновую проволоку 2 (контакт с ртутью), впаянную в стеклянную трубку. Поверх ртути помещают слой пасты 3 из каломели (толщина около 1 мм), а затем наливают раствор КСl, насыщенный относительно хлорида калия и каломели. Для этого некоторое количество каломели растирают с несколькими каплями ртути и с небольшим количеством раствора КСl, затем полученную пасту взбалтывают раствором КСl и образующуюся суспензию засасывают в сосуд через сифон. Окислительно-восстановительные электроды. К окислительно-восстановительным относятся электроды, в которых инертный металл (обычно Pt) погружен в раствор, содержащий окисленную и восстановленную формы вещества (например, ионы Fе3+и Fe2+). Примером окислительно-восстановительного электрода может служить электрод Mez2+,Mez1+/Pt. Электродный процесс представляет собой окислительно-восстановительную реакцию между ионами:
Как видно из уравнения, материал электрода непосредственного участия в химическом процессе не принимает. Его роль сводится к подводу или отводу электронов к веществам, реагирующим на поверхности электрода. Потенциал такого электрода выражается уравнением:
Константа равновесия Кa окислительно-восстановительной реакции может быть вычислена из уравнения
Ионоселективные электроды. Ионоселективные электроды отличаются от всех рассмотренных ранее тем, что у них обе граничащие фазы – мембрана и раствор – обладают ионной проводимостью, и поэтому на их границе не происходит собственно электрохимическая реакция с переносом электронов. Процесс сводится здесь к обмену ионами между мембраной и раствором. Межфазную границу пересекают только ионы, заряд которых при этом не изменяется, хотя он и может быть распределен по-другому между ионом и его новым окружением. При соответствующем подборе состава и структуры мембраны потенциал на межфазной границе будет зависеть от активности только одного какого-либо вида ионов. Стеклянный электрод. Стеклянный электрод обратим по отношению к ионам водорода. Он обычно представляет собой сосуд из тонкого стекла с повышенной проводимостью, наполненный раствором, в который погружен электрод первого или второго рода. Потенциал стеклянного электрода меняется в зависимости от активности ионов водорода в исследуемом растворе так же, как и потенциал водородного электрода: Ест=Е0ст – 2,303b0рН, (37) где Е0ст – стандартный потенциал стеклянного электрода, который зависит от сорта стекла и определяется калибровкой электрода по буферным растворам (с известным значением рН).
|
|||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 1401; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.46.205 (0.017 с.) |

 Cu Cu2+ + 2e– (2a)
Cu Cu2+ + 2e– (2a) 2Ag+ + 2e– 2Ag (2б)
2Ag+ + 2e– 2Ag (2б)
 2Ag+ + Cu 2Ag + Cu2+ (3)
2Ag+ + Cu 2Ag + Cu2+ (3)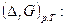
 (4)
(4)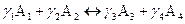 (5)
(5) (6)
(6) (7)
(7) (8)
(8) (9)
(9) (10)
(10)


 Mez++ze- Me , например, Cu2++2e- Cu
Mez++ze- Me , например, Cu2++2e- Cu

 А + ze- Az-, например, Se + 2e- Se2-
А + ze- Az-, например, Se + 2e- Se2-
 2H+ + 2e- H2
2H+ + 2e- H2



 (11)
(11) и
и  — подвижности ионов при бесконечном разбавлении.
— подвижности ионов при бесконечном разбавлении. (12)
(12)
 Mez++0,5zH2 Me + zH+
Mez++0,5zH2 Me + zH+
 (13)
(13) –стандартное давление
–стандартное давление (14)
(14) (15)
(15) — стандартный потенциал электрода (аМеz+= 1).
— стандартный потенциал электрода (аМеz+= 1).
 уравнение, связывающее его с активностью аниона аАz -в растворе, может быть записано в виде
уравнение, связывающее его с активностью аниона аАz -в растворе, может быть записано в виде (16)
(16) (17)
(17) стандартный потенциал (аАz - = 1).
стандартный потенциал (аАz - = 1). , диссоциирующего по схеме
, диссоциирующего по схеме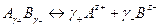
 (18)
(18) (19)
(19) (20)
(20) (21)
(21) (22)
(22) .
. В первом случае его потенциал (
В первом случае его потенциал ( ) будет обратим по отношению к аниону Аz–:
) будет обратим по отношению к аниону Аz–: (26)
(26) ) будет обратим по отношению к катиону Меz+ в растворе
) будет обратим по отношению к катиону Меz+ в растворе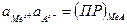 (28)
(28) (29)
(29)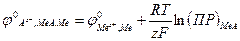 (30)
(30) (31)
(31) — стандартный потенциал; аCl- —активность ионов хлора в насыщенном растворе КС1 или в растворе НС1.
— стандартный потенциал; аCl- —активность ионов хлора в насыщенном растворе КС1 или в растворе НС1. = 0,2224 — 0,4-10-4 (t—25) — 3,2-10-6(t— 25)2 (32)
= 0,2224 — 0,4-10-4 (t—25) — 3,2-10-6(t— 25)2 (32) После проведения измерений с хлорсеребряным электродом рекомендуется хранить его в дистиллированной воде.
После проведения измерений с хлорсеребряным электродом рекомендуется хранить его в дистиллированной воде. (33)
(33) — стандартный потенциал; аCl- — активность ионов хлора в растворе.
— стандартный потенциал; аCl- — активность ионов хлора в растворе. = 0,2415–0,00076(t–25) (34)
= 0,2415–0,00076(t–25) (34)
 (35)
(35) (36)
(36)


