
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Краткое теоретическое обоснованиеСодержание книги
Поиск на нашем сайте
Сущность потенциометрического титрования. Сущность метода состоит в том, что эквивалентную точку определяют не по изменению цвета индикатора, как это делается при обыкновенном методе титрования, а по изменению потенциала электрода.
потенциометрического титрования HCI едким натром. индикаторного электрода и дает возможность определить эквивалентную точку. При потенциометрическом титровании практически удобнее (иногда и необходимо) бывает следить не за изменением потенциала Потенциометрическое титрование с успехом может быть использовано для количественного определения содержания в растворе кислот (метод нейтрализации), ионов галогенов (метод осаждения); ряда других ионов (метод комплексообразования). Титрование кислот. При титровании кислот необходимо различать два случая: 1) титрование раствора сильной кислоты раствором сильного основания; 2) титрование раствора слабой кислоты раствором сильного основания. В первом случае изменение концентрации ионов водорода происходит исключительно за счет реакции Н3О + ОН– = 2Н2О (38) При титровании сильной кислоты сильной щелочью эквивалентную точку определяют по точке перегиба кривой. Если по оси ординат откладывать отношение потенциала При титровании слабых кислот скачок потенциала в эквивалентной точке выражен менее резко, чем в первом случае, что иногда затрудняет точное определение точки перегиба, следовательно, и конечного момента титрования. На рисунке изображены кривые титрования растворов хлороводородной и уксусной кислот раствором сильного основания. Кривая титрования раствора уксусной кислоты вначале поднимается сравнительно круто (отрезок аб),отрезок бв — более пологий. Наконец, отрезок вг, отвечающий изменению потенциала в эквивалентной точке, значительно короче, чем аналогичный участок кривой титрования хлороводородной кислоты. Для очень слабых кислот отрезок вг на кривой титрования может исчезнуть совершенно, т. е. фактически в эквивалентной точке не будет наблюдаться заметного изменения потенциала. Относительно быстрое изменение потенциала водородного электрода на участке аб объясняется тем, что концентрация ионов водорода, вследствие слабой диссоциации уксусной кислоты, быстро уменьшается при добавлении небольших количеств щелочи. Замедленное же изменение потенциала на участке бв обусловливается главным образом буферным действием соли, образующейся при реакции нейтрализации. Потенциал на участке вг определяется концентрацией ионов водорода в эквивалентной точке. Концентрация ионов водорода в этом случае может быть вычислена из уравнения
где Кдисс — константа диссоциации кислоты; Кв — ионное произведение воды; С — концентрация соли в эквивалентной точке. При нейтрализации слабой кислоты сильным основанием в эквивалентной точке раствор будет уже не нейтральным, а щелочным, вследствие гидролиза образовавшейся соли.
Рис.5–Вид кривых титрования Рис.6–Вид кривой титрования смеси кислот HCI и СН3СООН едким натром. HCI и СН3СООН едким натром. нейтрализоваться первая. При потенциометрическом титровании таких кислот получают два скачка потенциала индикаторного электрода, а следовательно, и две точки перегиба на кривой титрования. На рисунке изображена кривая титрования раствора смеси хлороводородной и уксусной кислот едким натром. Точки а1 и а2 на кривой являются точками перегиба. Первая соответствует полному оттитрованию хлороводородной кислоты в смеси, а вторая — уксусной кислоты. Пунктирная линия показывает изменение потенциала в эквивалентной точке, которое наблюдалось бы при нейтрализации раствора одной хлороводородной кислоты, имеющей такую же концентрацию, как и в смеси.
Приборы и реактивы. рН-метр (иономер), БАТ-12-ЛМ, магнитная мешалка, индикаторный электрод (стеклянный), хлорсеребряный электрод, бюретка емкостью 25 мл, стакан для титрования емкостью 100 мл, растворы кислот (уксусной, соляной и смеси этих кислот), раствор едкого натрия.
Порядок выполнения работы. Для выполнения потенциометрического титрования составляют гальваническую цепь из стеклянного и хлорсеребряного электродов. 10 мл анализируемого раствора наливают в стакан для титрования, разбавляют дистиллированной водой, до такого объема чтобы электроды были погружены в раствор. Раствор реагента к титруемому раствору приливают из бюретки. При титровании кислот используют БАТ и иономер для снятия показаний э.д.с. (см. приложение). Конечную точку титрования определяют следующим образом. В начале титрования реагент приливают большими порциями (0,5 – 1 мл). После каждого приливания вычисляют отношение сравнительно быстро увеличиваться, реагент начинают приливать небольшими порциями (от 0,1 до 0,05 мл). После того как опыт покажет, что дальнейшее прибавление реагента приводит уже к уменьшению отношения
|
||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 272; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.12.88 (0.009 с.) |

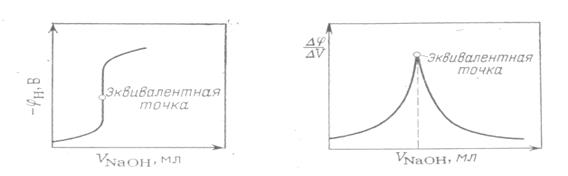 Электрод, которым пользуются при потенциометрическом титровании для определения эквивалентной точки, носит название индикаторного. Индикаторный электрод, как правило, должен быть обратимым по отношению к ионам титруемого вещества или к ионам прибавляемого реагента (в дальнейшем — просто реагента). В зависимости от того, является ли электрод обратимым по отношению к ионам титруемого вещества или по отношению к ионам реагента, потенциал его по мере титрования, согласно уравнению (15) будет соответственно уменьшаться или увеличиваться. В начале титрования потенциал индикаторного электрода изменяется медленно, но вблизи эквивалентной точки уже при добавлении незначительного количества реагента (1—2 капли) его потенциал изменяется скачком. Этот скачок потенциала Рис.3–Вид кривой титрования HCI едким натром. Рис.4–Дифференциальная кривая
Электрод, которым пользуются при потенциометрическом титровании для определения эквивалентной точки, носит название индикаторного. Индикаторный электрод, как правило, должен быть обратимым по отношению к ионам титруемого вещества или к ионам прибавляемого реагента (в дальнейшем — просто реагента). В зависимости от того, является ли электрод обратимым по отношению к ионам титруемого вещества или по отношению к ионам реагента, потенциал его по мере титрования, согласно уравнению (15) будет соответственно уменьшаться или увеличиваться. В начале титрования потенциал индикаторного электрода изменяется медленно, но вблизи эквивалентной точки уже при добавлении незначительного количества реагента (1—2 капли) его потенциал изменяется скачком. Этот скачок потенциала Рис.3–Вид кривой титрования HCI едким натром. Рис.4–Дифференциальная кривая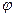 , а за отношением изменения потенциала к
, а за отношением изменения потенциала к 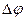 соответствующему изменению объема прибавленного реагента
соответствующему изменению объема прибавленного реагента 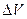 . Это объясняется тем, что отношение
. Это объясняется тем, что отношение  изменяется вблизи эквивалентной точки более резко, чем потенциал
изменяется вблизи эквивалентной точки более резко, чем потенциал 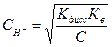 , (39)
, (39)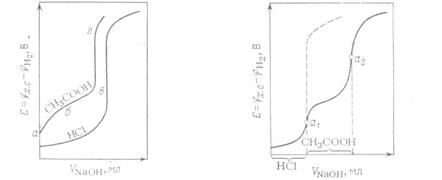 Титрование смеси кислот. При титровании смеси сильной и слабой кислот удается потенциометрически определить содержание каждой из кислот в отдельности, не производя предварительного разделения их. При титровании смеси сильной и слабой кислот сначала будет
Титрование смеси кислот. При титровании смеси сильной и слабой кислот удается потенциометрически определить содержание каждой из кислот в отдельности, не производя предварительного разделения их. При титровании смеси сильной и слабой кислот сначала будет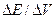 .Вблизи эквивалентной точки, когда отношение
.Вблизи эквивалентной точки, когда отношение 


