Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра «Биотехнологии и Химии»Содержание книги
Поиск на нашем сайте
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РФ ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Кафедра «Биотехнологии и Химии» Методическое указание к практикуму по физической химии Лабораторная работа №26 «Потенциометрическое титрование». Тверь, 2006 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Электродвижущие силы. Возникновение скачка потенциала на границе фаз. При контакте любых двух фаз на границе их раздела возникает двойной электрический слой, состоящий из равных по величине, но противоположных по знаку электрических зарядов. Это происходит потому, что заряженные частицы (электроны, ионы) в разных фазах находятся в различных условиях и, следовательно, химические потенциалы их неодинаковы. Согласно второму закону термодинамики, частицы самопроизвольно переходят из фазы, где их химический потенциал больше, в фазу, где химический потенциал меньше, пока свободная энергия системы не станет минимальной. Каждая фаза, следовательно, приобретает заряд, и на границе раздела фаз возникает разность электрических потенциалов (скачок потенциала). Скачки потенциала возникают на границе металл I / металл II (контактный потенциал), на границах металл/раствор и на границе двух растворов (диффузионный потенциал). Механизм образования двойного электрического слоя различен и зависит от природы граничащих фаз. Диффузионная разность потенциалов (или просто диффузионный потенциал — Ед) возникает на границе соприкасающихся растворов электролитов благодаря тому, что диффузия катионов и анионов из одного раствора в другой протекает с различной скоростью, что и приводит к образованию двойного электрического слоя в тонком слое в области контакта растворов. Для уменьшения диффузионного потенциала растворы электролитов в электрохимических системах соединяют с помощью солевого мостика, наполненного насыщенным раствором такого электролита, у которого подвижности и скорости диффузии катиона и аниона близки. Обычно используют водные растворы КС1, NH4Cl, KNO3, NH4NO3 и неводные растворы KCNS в С2Н5ОН или NaI в СНзОН. ТИПЫ ЭЛЕКТРОДОВ. Электроды первого рода. К ним в первую очередь относятся электроды, обратимые относительно катиона, и металлоидные, обратимые относительно аниона. В общем виде схема электрода, обратимого по отношению к катиону Меz+, записывается так Mez+/Me, например, Cu2+/Cu а электродная обратимая реакция в виде
Для электрода, обратимого относительно аниона Аz-, схема записи электрода следующая Аz-/А, например Se2-/Se Электродная обратимая реакция
К электродам первого рода относятся также амальгамные электроды Mez+/Me, Hg газовые электроды и, в частности, водородный электрод H3O/H2, Pt и кислородный электрод OH-/O2, Pt на водородном электроде протекает реакция
а его стандартный потенциал условно принимаем равным нулю при любой температуре. Электродвижущая сила гальванического элемента может быть представлена как алгебраическая сумма равновесных потенциалов. Так для элемента (1): (–) Cu / CuSO4 // AgNO3 / Ag (+)
будем иметь три равновесных потенциала; два из них Э.д.с. цепи (1) будет равна
Диффузионный потенциал
где Диффузионный потенциал определяется разностью в подвижности катионов и анионов. Если (–) Cu / CuSO4 // AgNO3 / Ag (+)
Если диффузионный потенциал устранен, то э. д. с. цепи (1) будет равна
Абсолютные значения равновесных электродных потенциалов не удалось определить экспериментально и вычислить теоретически. Можно опытным путем лишь определить э.д. с. гальванического элемента. Определение электродного потенциала на практике сводится к измерению э.д.с. гальванического элемента, в котором в качестве электрода сравнения берется нормальный водородный электрод. Если электрод Меz+|Ме в рассматриваемом элементе играет роль положительного полюса, то в нем протекает реакция
Электродвижущая сила гальванического элемента
Согласно (10)
где Так как аМе для чистого металла принимается равной единице, то равновесный потенциал электрода Меz+|Ме описывается уравнением
или при 298,15 К
где Значения стандартных потенциалов, вычисленных по отношению к нормальному водородному электроду, табулированы (см. справочник Р., табл. 79). Итак, относительный потенциал электрода Меz+|Ме равен электродвижущей силе элемента, составленного из электрода Меz+|Ме и нормального водородного электрода. Этот вывод является справедливым для любого типа электродов. Воспользовавшись уравнением (15), получим для э. д. с. элемента (1)
Для электрода Аz-|А, обратимого относительно аниона Аz -, легко показать, что для относительного потенциала
или при 298,15 К
где В уравнения для электродного потенциала под знаком логарифма входит активность (активности) иона, по отношению к которому электрод является обратимым. Мы не располагаем методами, которые позволили бы экспериментальным путем определить активность отдельных ионов. Поэтому пришлось ввести понятие средней геометрической активности электролита, которая используется при соответствующих расчетах вместо активности отдельных ионов, например, в уравнениях (15) и (17). Для электролита
средняя геометрическая активность
и средний коэффициент активности
где а+ и а-, v+ и v -— активности и коэффициенты активности катиона Аz+ и аниона Вz- соответственно; v=v++v-. Средняя активность электролита связана со средним коэффициентом активности и моляльностью т электролита
Для бинарного электролита (AgNO3, CuSO4 и т. п.)
Значения коэффициентов активности для некоторых электролитов при различных значениях моляльности в растворе приводятся в справочниках (см. cправочник Р., табл. 72). В тех случаях, когда значение коэффициента активности неизвестно, можно с некоторым приближением вычислить его по уравнению
где z+ и z -—валентности катиона и аниона соответственно; I — ионная сила раствора, Электроды второго рода. Электрод второго рода представляет собой металл, покрытый труднорастворимым соединением данного металла (соль, оксид, гидроксид), находящийся в контакте с раствором, который содержит общий анион с труднорастворимым соединением металла. В том случае, когда труднорастворимым соединением данного металла является оксид или гидроксид, роль аниона в растворе играет ион гидроксида. К электродам второго рода можно отнести, например, полуэлементы: OH–|HgO, Hg; Cl–|AgCl, Ag Последний полуэлемент — хлорсеребряный электрод широко используется в лабораторной практике как электрод сравнения. Рассмотрим несколько подробнее электроды типа Аz- | МеА, Me (23) На нем могут протекать следующие электрохимические реакции
где Во втором случае потенциал электрода (
где аМеz+ — активность ионов Меz+ в растворе. Так как раствор по отношению МеА является насыщенным, то
Подставив аМеz+ из уравнения (28) в (27), получим
Из (26) и (29) непосредственно вытекает соотношение
Хлорсеребряный электрод. Хлорсеребряный электрод Cl–|AgCl,Ag хорошо воспроизводим и прост в изготовлении. Потенциал хлорсеребряного электрода при 298,15 К согласно уравнению (26) определяется уравнением
где Зависимость стандартного потенциала хлорсеребряного электрода от температуры дается уравнением
где t — температура, °С. Для изготовления хлорсеребряного электрода на платиновую проволоку, впаянную в стеклянную трубку, электролитическим путем наносят серебро. Поверхностный слой серебра переводят электролизом в хлорид серебра. Электролиз проводят в разбавленном растворе хлороводородной кислоты. По окончании процесса электролиза тщательно промывают электрод водой и затем помещают в электродный сосуд с насыщенным раствором хлорида калия (или НСl) и хлорида серебра.
Каломельный электрод. На рис.1(каломельный электрод): 1,4 — ртуть; 2 — платиновая проволока; 3 — паста из каломели; 5 — пробка; 6 — боковая трубка; 7 — сифон; 8 — раствор хлорида калия. Из электродов второго рода в качестве электрода сравнения получил также распространение каломельный электрод: KC l / Hg2Cl2,Hg Его потенциал при 298, 15 К
где Для приготовления каломельного электрода обычно применяют 0,1; 1; 3,5 н. и насыщенный растворы КСl. Наиболее постоянные потенциалы получают при использовании двух первых растворов КСl. Но проще изготовить электрод с насыщенным раствором КСl, Рис. 1 – Каломельный поэтому его чаще всего используют в лабораторном практикуме. электрод. Зависимость потенциала с насыщенным КСl от температуры выражается уравнением
Каломельный электрод изготовляют следующим образом. На дно сосуда (см. рис.1) наливают небольшое количество химически чистой (хч) ртути, в которую погружают амальгированную платиновую проволоку 2 (контакт с ртутью), впаянную в стеклянную трубку. Поверх ртути помещают слой пасты 3 из каломели (толщина около 1 мм), а затем наливают раствор КСl, насыщенный относительно хлорида калия и каломели. Для этого некоторое количество каломели растирают с несколькими каплями ртути и с небольшим количеством раствора КСl, затем полученную пасту взбалтывают раствором КСl и образующуюся суспензию засасывают в сосуд через сифон. Окислительно-восстановительные электроды. К окислительно-восстановительным относятся электроды, в которых инертный металл (обычно Pt) погружен в раствор, содержащий окисленную и восстановленную формы вещества (например, ионы Fе3+и Fe2+). Примером окислительно-восстановительного электрода может служить электрод Mez2+,Mez1+/Pt. Электродный процесс представляет собой окислительно-восстановительную реакцию между ионами:
Как видно из уравнения, материал электрода непосредственного участия в химическом процессе не принимает. Его роль сводится к подводу или отводу электронов к веществам, реагирующим на поверхности электрода. Потенциал такого электрода выражается уравнением:
Константа равновесия Кa окислительно-восстановительной реакции может быть вычислена из уравнения
Ионоселективные электроды. Ионоселективные электроды отличаются от всех рассмотренных ранее тем, что у них обе граничащие фазы – мембрана и раствор – обладают ионной проводимостью, и поэтому на их границе не происходит собственно электрохимическая реакция с переносом электронов. Процесс сводится здесь к обмену ионами между мембраной и раствором. Межфазную границу пересекают только ионы, заряд которых при этом не изменяется, хотя он и может быть распределен по-другому между ионом и его новым окружением. При соответствующем подборе состава и структуры мембраны потенциал на межфазной границе будет зависеть от активности только одного какого-либо вида ионов. Стеклянный электрод. Стеклянный электрод обратим по отношению к ионам водорода. Он обычно представляет собой сосуд из тонкого стекла с повышенной проводимостью, наполненный раствором, в который погружен электрод первого или второго рода. Потенциал стеклянного электрода меняется в зависимости от активности ионов водорода в исследуемом растворе так же, как и потенциал водородного электрода: Ест=Е0ст – 2,303b0рН, (37) где Е0ст – стандартный потенциал стеклянного электрода, который зависит от сорта стекла и определяется калибровкой электрода по буферным растворам (с известным значением рН). Порядок выполнения работы. Для выполнения потенциометрического титрования составляют гальваническую цепь из стеклянного и хлорсеребряного электродов. 10 мл анализируемого раствора наливают в стакан для титрования, разбавляют дистиллированной водой, до такого объема чтобы электроды были погружены в раствор. Раствор реагента к титруемому раствору приливают из бюретки. При титровании кислот используют БАТ и иономер для снятия показаний э.д.с. (см. приложение). Конечную точку титрования определяют следующим образом. В начале титрования реагент приливают большими порциями (0,5 – 1 мл). После каждого приливания вычисляют отношение сравнительно быстро увеличиваться, реагент начинают приливать небольшими порциями (от 0,1 до 0,05 мл). После того как опыт покажет, что дальнейшее прибавление реагента приводит уже к уменьшению отношения
ПРИЛОЖЕНИЕ Принцип действия иономера.
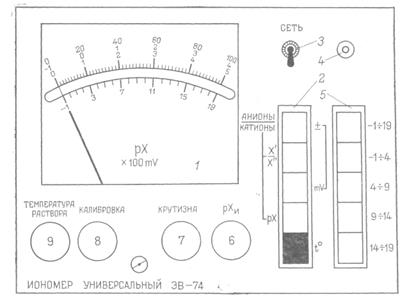
При проведении измерений со стеклянным электродом чаще всего используют иономер ЭВ-74. Внешняя панель иономера ЭВ-74 изображена на рисунке. Прибор предназначен для измерения рН (рХ других одно- и двухвалентных катионов и анионов) в водных растворах в интервале от —1 до +19. В качестве датчика э.д.с. при определении рН используется гальванический элемент, состоящий из измерительного стеклянного и вспомогательного хлорсеребряного электродов. Показывающий прибор — 1 имеет две шкалы, нижняя предназначена для измерения рН (или рХ) в широком диапазоне от —1 до +19. Верхняя шкала имеет три вида оцифровки (фактически три шкалы) (см. рис.): 0—5; -1 – 4; 0 – 100. Первые две оцифровки используются при измерении рН (или рХ), а оцифровка «0-100» при «температурной компенсации» – один из видов настройки прибора. Кнопки: «t» (нижняя кнопка выбора рода работ 2)и «-1 — 19» (в диапазоне измерения 5)должны быть нажаты во всех случаях, если измерения на приборе не производятся. Измерения на иономере ЭВ-74 производятся в следующем порядке. 1.При помощи тумблера 3 включают иономер в сеть 220В—50 Гц. При наличии напряжения питания зажигается контрольная лампочка 4. Прибор прогреть в течение 30 мин. 2.Подготовить датчик э.д.с. к работе. Для чего: а)погрузить электроды 2—3 раза в стаканчик со свежей дистиллированной водой, после чего остатки воды осторожно, не касаясь электродов руками, удалить при помощи фильтровальной бумаги; б)залить в стаканчик буферный раствор с известным рН (по указанию преподавателя), погрузить в него электроды и термометр. 3.Подключить гальванический элемент к иономеру. Стеклянный измерительный электрод подключить к гнезду «ИЗМ», а хлорсеребряный — вспомогательный — к гнезду «ВСП». Оба гнезда расположены на задней стенке прибора. 4. Нажать одну из четырех нижних кнопок выбора диапазона измерений 5 (кнопки «t» и «-1 – 19» на приборе должны быть нажаты до начала работы) и ручкой «температура раствора» 9 установить стрелку показывающего прибора 1 по верхней шкале, используя оцифровку «0-100» на отметку, соответствующую температуре исследуемого раствора (показания на термометре). 5.Произвести настройку прибора по буферному раствору. а) Нажать кнопку «рХ» (вторая снизу) выбора работы 2. б) В зависимости от значения рН необходимо нажать одну из Допустим, что значение рН буферного раствора 9,22. При настройке прибора необходимо будет нажать кнопку «9—14». Выждав 2—3 мин, ручкой «калибровка» 8 установить стрелку показывающего прибора 1 по верхней шкале с оцифровкой «0 – 5» на значение 0,22 (9,22—9 = 0,22). После проведения калибровки прибора необходимо: нажать кнопки: «t» и «-l – 19», слить буферный раствор обратно в колбу, промыть электроды, погрузив их 2—3 раза в свежую дистиллированную воду, удалить остатки воды фильтровальной бумагой. в) Произвести измерение рН неизвестного раствора. Для чего: погрузить стеклянный и хлорсеребряный электроды в стаканчик с раствором, рН которого необходимо определить. Нажать кнопку рХ и определить грубо рН неизвестного раствора на нижней шкале прибора 1, затем нажать ту кнопку выбора диапазона измерений 5, внутри которого лежит определенное грубо значение рН. Для точного определения рН необходимо будет воспользоваться верхней шкалой показывающего прибора 1. Если грубо найденное значение рН будет меньше 4, то для отсчета должна быть использована шкала с оцифровкой «-1 – 4», во всех остальных случаях отсчет производится по шкале с оцифровкой «0 – 5». Методика отсчета по верхней шкале та же самая, что и при калибровке прибора по буферному раствору. После окончания опыта нажать кнопки «t» и «-1 — 19», промыть электроды дистиллированной водой и поместить их в стаканчик с дистиллированной водой. Выключить тумблер 3 и вынуть вилку из розетки.
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РФ ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Кафедра «Биотехнологии и Химии»
|
||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 215; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.107.223 (0.009 с.) |



 Mez++ze- Me , например, Cu2++2e- Cu
Mez++ze- Me , например, Cu2++2e- Cu

 А + ze- Az-, например, Se + 2e- Se2-
А + ze- Az-, например, Se + 2e- Se2-
 2H+ + 2e- H2
2H+ + 2e- H2



 (11)
(11) и
и  — подвижности ионов при бесконечном разбавлении.
— подвижности ионов при бесконечном разбавлении. (12)
(12)
 Mez++0,5zH2 Me + zH+
Mez++0,5zH2 Me + zH+
 (13)
(13) –стандартное давление
–стандартное давление (14)
(14) (15)
(15) — стандартный потенциал электрода (аМеz+= 1).
— стандартный потенциал электрода (аМеz+= 1).
 уравнение, связывающее его с активностью аниона аАz -в растворе, может быть записано в виде
уравнение, связывающее его с активностью аниона аАz -в растворе, может быть записано в виде (16)
(16) (17)
(17) стандартный потенциал (аАz - = 1).
стандартный потенциал (аАz - = 1). , диссоциирующего по схеме
, диссоциирующего по схеме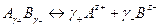
 (18)
(18) (19)
(19) (20)
(20) (21)
(21) (22)
(22) .
. Mez+ + ze– Me (25)
Mez+ + ze– Me (25) В первом случае его потенциал (
В первом случае его потенциал ( ) будет обратим по отношению к аниону Аz–:
) будет обратим по отношению к аниону Аz–: (26)
(26) ) будет обратим по отношению к катиону Меz+ в растворе
) будет обратим по отношению к катиону Меz+ в растворе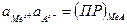 (28)
(28) (29)
(29)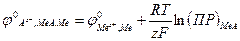 (30)
(30) (31)
(31) — стандартный потенциал; аCl- —активность ионов хлора в насыщенном растворе КС1 или в растворе НС1.
— стандартный потенциал; аCl- —активность ионов хлора в насыщенном растворе КС1 или в растворе НС1. = 0,2224 — 0,4-10-4 (t—25) — 3,2-10-6(t— 25)2 (32)
= 0,2224 — 0,4-10-4 (t—25) — 3,2-10-6(t— 25)2 (32) После проведения измерений с хлорсеребряным электродом рекомендуется хранить его в дистиллированной воде.
После проведения измерений с хлорсеребряным электродом рекомендуется хранить его в дистиллированной воде. (33)
(33) — стандартный потенциал; аCl- — активность ионов хлора в растворе.
— стандартный потенциал; аCl- — активность ионов хлора в растворе. = 0,2415–0,00076(t–25) (34)
= 0,2415–0,00076(t–25) (34)
 (35)
(35) (36)
(36)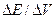 .Вблизи эквивалентной точки, когда отношение
.Вблизи эквивалентной точки, когда отношение