
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Потенциалы газовых электродовСодержание книги
Поиск на нашем сайте Газовыеэлектроды могут быть обратимыми относительно анионов (кислородный) или относительно катионов (водородный). Газовые электроды состоят из металлического проводника (Pt или металлов платиновой группы), контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов, а также является катализатором электродной реакции (ускоряет установление равновесия на электроде). Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то потенциалы этих электродов зависят от парциальных давлений газов. Равновесие на водородном электроде выражается уравнением 2Н++ 2
где Е 2Н+ / Н2 = −0,059 рН. (8.6) Подставляя числовые значения R, F, стандартной температуры, равной Т =298 К, и учитывая, что lgH+ =−pH, уравнение Нернста при р Н Кислородный электрод состоит из платиновой пластинки, контактирующей с кислородом и раствором, содержащим ионы, которые образуются при восстановлении кислорода (ионы ОН-): О2, Pt │ОН-. Если на кислородном электроде протекает реакция по уравнению 2Н2О + О2 + 4 то выражение равновесного потенциала при Т = 298 К имеет вид:
Так как активность воды в ходе реакции изменяется незначительно, то ее считают величиной постоянной и уравнение для расчета потенциала кислородного электрода при подстановке значений R, F и T = 298 К приобретает вид:
где Е о2Н Проведя ряд преобразований, получаем уравнение Нернста для расчета кислородного электрода в виде:
Зависимости значений равновесных потенциалов водородного и кислородного электродов от рН приведены в приложении (табл. 14). Химические источники тока Химические источники тока (ХИТ) – электрохимические устройства, в результате работы которых химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию постоянного тока. К ним относятся гальванические элементы, аккумуляторы, топливные элементы . Основными характеристиками ХИТ являются ЭДС, напряжение, мощность, энергия, которую они отдают во внешнюю цепь, саморазряд. Химические источники тока должны иметь: как можно большее значение ЭДС; максимально высокие удельные мощность и емкость; по возможности меньшую разность между напряжением источника тока и его ЭДС; максимально низкий саморазряд (потеря емкости ХИТ при разомкнутой цепи). Гальванические элементы – устройства, в которых энергия химической окислительно-восстановительной реакции превращается в электрическую. Он состоят из двух электродов, имеющих различный электродный потенциал, электролита, который дает возможность перемещаться ионам от одного электрода к другому, и металлического проводника для перемещения электронов, направленный поток которых приводит к возникновению электрического тока. Рассмотрим механизм возникновения электрического тока на примере медно-цинкового гальванического элемента (элемента Даниэля – Якоби). Он состоит из двух электродов – цинкового и медного, погруженных в соответствующие растворы сульфатов цинка и меди, которые разделены полупроницаемой перегородкой 1(внутренняя цепь) (рис. 8.3.). Электроды соединены друг с другом металлическим проводником (внешняя цепь) через гальванометр 2. Если цепь замкнута, то происходят процессы гидратации ионов металлов на обоих электродах и устанавливается химическое равновесие между металлом и его ионами в растворе: Zn «Zn2++ 2 Cu «Cu2++ 2 Металлы приобретают разный по величине заряд, так как Zn и Cu имеют различную активность, которая может быть оценена с помощью стандартных электродных потенциалов (
Рис. 8.3. Схема гальванического элемента Даниэля-Якоби Таким образом, концентрация свободных электронов на этих электродах различна. При замыкании внешней цепи происходит выравнивание этих концентраций и электроны по внешнему проводнику перемещаются от Zn электрода к Cu электроду. Концентрация электронов на цинковом электроде уменьшается, что приводит к смещению равновесия на границе Zn/ZnSO4 в сторону образования катионов Zn2+, т.е. происходит процесс растворения цинка (Zn Процесс окисления в электрохимии называется анодным процессом, а сам электрод –анодом. Концентрация свободных электронов на медном электроде увеличивается в результате поступивших электронов с цинка и равновесие на границе Cu/CuSO4 смещается в сторону образования металлической меди (Cu Процесс восстановления в электрохимии называется катодным процессом, а сам электрод – като дом. На Zn – аноде происходит процесс окисления, в результате которого цинк переходит в раствор в виде катионов, на Cu – катоде – процесс восстановления ионов меди: (−) А: Zn «Zn2++ 2 (+) К: Cu2++ 2 -------------------------------------------------------- Cu2+ + Zn «Zn2++ Cu. Таким образом, при работе гальванического элемента одновременно происходят процессы окисления и восстановления. Схематически работа гальванического элемента записывается следующим образом:
(−) Zn / Zn2+ ç H2SO4 ç Cu2+ / Cu (+).
В гальваническом элементе происходит движение ионов (SO42-) во внутренней цепи и электронов (2 В скобках указываются знаки электродов, причем анод записывается слева, катод – справа. Стрелки указывают направление движения электронов во внешней цепи и ионов SO42-во внутренней. Важной характеристикой гальванического элемента является его движущая сила (ЭДС), которая представляет собой разность потенциалов электродов при отсутствии тока во внешней цепи: ЭДС= Е Cu2+/ Cu – E Zn2+/ Zn. Потенциалы каждого электрода зависят от концентрации потенциалопределяющих ионов и вычисляются по уравнению Нернста (8.4). Если условия стандартные ([ZnSO4] и [CuSO4 ]=1 моль/л, температура Т = 298 К), то для медно – цинкового элемента стандартная ЭДСо равна: ЭДСо =+0,34–(–0,76)=1,1 В. Среди большого разнообразия гальванических элементов можно выделить три основных типа: 1. Два различных металла находятся в растворах своих солей. К этому типу относится рассмотренный гальванический элемент Даниэля–Якоби. 2. Два различных металла находятся в одном электролите. Примером такого элемента может служить элемент Вольта, состоящий из двух пластин (Zn и Cu), находящихся в растворе серной кислоты. При его работе происходят следующие процессы: (–) А: Zn «Zn2++ 2 (+) К: 2Н++ 2 Выделяющийся водород насыщает поверхность катода (меди), в результате чего получается электрод другого состава (не медный, а водородный). Схема гальванического элемента Вольта:
(−) Zn / Zn2+çH2SO4ç2H+ / H2 3. Два одинаковых электрода находятся в растворах своих солей с различной концентрацией ионов металла в электролите. Такой элемент называется концентрационным. Схема медного концентрационного гальванического элемента:
(−) Cu / CuSO4 ççCuSO4 / Cu (+). Роль анода выполняет электрод, находящийся в более разбавленном растворе, так как его электродный потенциал имеет более низкое значение по сравнению со вторым электродом. ЭДС такого гальванического элемента зависит только от соотношения концентраций потенциалопределяющих ионов (в данном случае от концентрации CuSO4). Как источники электрической энергии концентрационные гальванические элементы практического значения не имеют. Электродвижущая сила и напряжение гальванического элемента. ЭДС – разность потенциалов между катодом и анодом в условиях обратимой работы ГЭ. Измерение ЭДС обычно проводят компенсационным методом при отсутствии тока в цепи. Прямым измерением разности потенциалов на клеммах элемента с помощью обычного вольтметра можно получить значение напряжения U, которое не равно ЭДС элемента. Напряжение – разность между электродами работающего гальванического элемента (в необратимых условиях работы). Напряжение элемента U < ЭДС на величину перенапряжения U =ЭДС – где Поляризация – явление отклонения потенциала электрода от его равновесного значения при прохождении через систему электрического тока. В результате поляризации потенциал анода смещается в положительную сторону, потенциал катода – в отрицательную сторону и в соответствии с уравнением Нернста ЭДС элемента уменьшается. Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока и другими эффектами. Для увеличения напряжения на клеммах в гальванических элементах снижают поляризацию анода и катода и максимально уменьшают внутреннее сопротивление ХИТ. Процесс уменьшения электродной поляризации называют деполяризацией. Ее уменьшают путем изменения условий протекания электродных процессов или применением специальных веществ – деполяризаторов, способных электрохимически окисляться или восстанавливаться, изменяя тем самым природу электродных процессов. Деполяризаторами-окислителями являются, например, H2Cr2O7, MnO2, кислород воздуха, деполяризаторами-восстановите-лями – Na2SO3, Na2PO3 и др. Аккумуляторы – гальванические элементы, которые на основе обратимых электрохимических реакций могут многократно накапливать химическую энергию и отдавать ее для потребления в виде электрической энергии постоянного тока. Аккумуляторы – устройства многоразового действия, сочетающие в себе гальванический элемент и электролизер. Под воздействием внешнего постоянного тока в них аккумулируется (накапливается) химическая энергия, которая затем превращается в электрическую энергию в результате окислительно-восстановительной реакции. Процесс накопления химической энергии называют зарядом аккумулятора, процесс ее превращения в электрическую – разрядом аккумулятора. В первом случае аккумулятор работает как электролизер, во втором – как гальванический элемент. Устройство и принцип действия всех аккумуляторов одинаковы. Основное отличие состоит в материале электродов и типе электролита. На аноде как при разряде, так и при заряде протекает процесс окисления, на катоде – процесс восстановления. Наиболее распространенными являются кислотные и щелочные аккумуляторы. Кислотный аккумулятор (свинцовый аккумулятор) представляет собой пластины в виде отливок из хартблея (твердого свинца с примесью сурьмы) ячеистой структуры, собранные в батареи и помещенные в баки из эбонита или полипропилена с электролитом. В ячейки пластин предварительно запрессовывается смесь оксида свинца (PbO) с глицерином, обладающая способностью затвердевать в виде глицерата свинца. Электролитом служит раствор серной кислоты с концентрацией 35…40 %. Анодная и катодная части разделены токонепроводящим сепаратором. Cхема кислотного аккумулятора:
(−) Pb/ Pb2+│H2SO4│Pb2+/PbO2 (+). При взаимодействии оксида свинца с H2SO4 образуется PbSO4 PbO(тв) + H2SO4(р-р) ↔ PbSO4(тв) + H2O. При первичном и последующих зарядах аккумулятора, когда он работает как электрохимическая ячейка, PbSO4 на катоде превращается в свинец Pb, а на аноде – в диоксид свинца PbO2, которые и являются электродами. При работе аккумулятора – его разряде, когда он работает как химический источник тока, на электродах протекают электродные процессы в обратном направлении. (−) К: PbSO4(тв) + 2 (+) А: PbSO4(тв) + 2Н2О ↔ PbО 2(тв) + 2
2PbSO4(тв) + 2H2O ↔ Pb(тв) + PbO2(тв) + 2H2SO4(р-р). Электродные реакции в свинцовом аккумуляторе можно представить в виде: Pb(тв) + SO PbО2(тв) + 2
Pb(тв) + PbO2(тв) + 2H2SO4 (р-р) «2PbSO 4(тв) + 2H2O. По мере его разряда расходуются материалы катода (PbО2), анода (Pb) и электролит – серная кислота. Напряжение на зажимах аккумулятора падает, и его необходимо заряжать. Свинцовый аккумулятор не должен разряжаться до полного расходования активности веществ. Если это произойдет, то станет невозможной его перезарядка (аккумулятор можно разряжать до 1,8 В). Для заряда аккумулятор подключают к внешнему источнику тока, направление тока противоположно разрядному. Во время заряда аккумулятора растет напряжение на его полюсах. В конце оно достигает такого значения, что начинается электролиз воды, сопровождающийся выделением водорода на катоде и кислорода – на аноде:
(+) А: 2Н2О «О2
2Н2О «2Н2 Так называемое «кипение» электролита является признаком окончания заряда свинцового аккумулятора.
Стандартные величины потенциалов для электродов свинцового аккумулятора имеют следующие значения: Е о ЭДС аккумулятора как химического источника тока рассчитывается по уравнению:
ЭДС аккумулятора зависит от концентрации (активности) серной кислоты, которая возрастает при заряде аккумулятора и уменьшается при его разряде. О степени разряда аккумулятора судят по концентрации электролита, т.е. концентрации H2SO4. На практике с помощью ареометра обычно измеряется не концентрация кислоты, а ее плотность. При плотности ЭДС заряженного аккумулятора приблизительно равна 2 В. Если последовательно соединить 6 элементов, то получится обычный автомобильный аккумулятор с ЭДС=12 В. Заряженный аккумулятор может быть сразу использован по назначению. При хранении же из него выливают электролит и промывают водой. В таком виде он может находиться до 2−х лет, и для его использования достаточно лишь залить электролит. При хранении незаряженного аккумулятора с раствором серной кислоты происходит его «сульфатирование» – образование на пластинках большого количества PbSO4. Когда кислотный аккумулятор работает, давая ток, PbSO4 осаждается в очень мелкозернистой форме на поверхности электродов. Когда же аккумулятор выключен, мелкозернистый слой рекристаллизуется и образуются более крупные кристаллы, которые могут закупорить поры электрода, уменьшая его поверхность, или отрываться от электрода и основной причиной выхода аккумулятора из строя, поэтому нужно следить, чтобы аккумулятор не простаивал частично в разряженном состоянии. Преимущества свинцового аккумулятора – высокий КПД (около 80 %), высокая ЭДС и относительно малое ее изменение при разряде, большая электрическая емкость, устойчивость в работе. Недостатки – большая масса и, следовательно, малая удельная емкость, саморазряд аккумулятора при хранении, малый срок службы (2…5 лет), а также токсичность свинца и сильные окислительные свойства H2SO4. Совершенствование свинцовых аккумуляторов идет по пути изыскания новых сплавов свинца для решеток, препятствующих образованию и выпадению шлама, кристаллизации сульфата свинца, облегченных и прочных материалов корпусов и улучшения качества сепараторов. Щелочные аккумуляторы различаются по материалу пластин отрицательно заряженного электрода. Наиболее распространенные из них кадмий – никелевые (Cd − Ni) и железо – никелевые (Fe – Ni) аккумуляторы. Активная масса положительных пластин состоит в основном из гидратированного оксида никеля (III). Кроме того, в ней содержится графит, добавляемый для увеличения электропроводности. Электролитом служит раствор КОН (20 %), содержащий небольшое количество LiOH. ЭДС заряженного аккумулятора (Cd − Ni) приблизительно равна 1,3 В. Окислительно-восстановительные процессы, протекающие при работе щелочного аккумулятора (Сd – Ni), могут быть представлены следующими уравнениями: (−) A: Cd + 2OH-
2NiO(OH) + 2H2O + Cd Cхемы щелочных аккумуляторов: (−) Cd/ KOH, LiOH /NiO(OH), C (+); (−) Fe/ KOH, LiOH /NiO(OH), C (+). В отличие от свинцового аккумулятора срок службы щелочных аккумуляторов порядка 10 лет. Они хорошо выдерживают перегрузку и длительное время пребывания в разряженном состоянии. Однако меньшая ЭДС и более высокая стоимость не позволяют во многих случаях заменить ими свинцовые аккумуляторы. Щелочные аккумуляторы выпускаются промышленностью различной удельной емкости (0,5–120 А Топливные элементы (ТЭ) – перспективные химические источники тока (электрохимические генераторы), способные непрерывно работать за счет постоянного подвода к электродам новых порций реагентов и отвода продуктов реакции. Топливными элементами называются устройства, в которых химическая энергия окисления топлива превращается в электрическую энергию. ТЭ относятся к первичным химическим источникам тока с непрерывной подачей реагентов (окислителя и восстановителя) и непрерывным удалением продуктов сгорания. Сгорание топлива (окисление) практически во всех ТЭ происходит на поверхности инертных электродов (Сграфит, Pt, Ag, Ni и др.), содержащих катализаторы. В качестве топлива (восстановителя) используют жидкие или газообразные водород, гидразин, гидриды металлов, оксид углерода, различные углеводороды, метиловый спирт и др. спирты. Твердое топливо – уголь, кокс, торф обладает малой реакционной способностью и может быть окислено при температуре выше 1000оС. Электролитами являются водные растворы кислот или щелочей, расплавленные карбонаты или гидриды металлов. Как правило, природные виды топлива подвергаются предварительной обработке для получения электрохимически активных веществ. На практике наиболее часто применяется водородно-кислородный топливный элемент со щелочным электролитом (30−40 % раствор KOH). Устройство элемента чрезвычайно простое. В герметически закрытом сосуде установлено два пористых, металлических (чаще всего никелевых) электрода, разделенных слоем раствора гидроксида калия (натрия). В ТЭ подаются газообразный водород и кислород. Схема водородно-кислородного ТЭ имеет следующий вид:
где Ме – проводник первого рода, играющий роль катализатора электродного процесса и токоотвода (например, специально обработанные Ni, Co, металлы группы Pt). Элемент работает при 50…70 оС, при атмосферном давлении. На электродах протекают следующие реакции: на аноде – окисление водорода (−) А: H2 + 2OH- «2H2O + 2 на катоде – восстановление кислорода
Во внешней цепи происходит движение электронов от анода к катоду, а в растворе – движение ионов OH-от катода к аноду. Уравнение токообразующей реакции имеет вид: Н2 + ½ O2 Таким образом, в водородно-кислородном ТЭ протекает процесс сгорания водорода с образованием воды. В результате протекания этой реакции в цепи генерируется постоянный ток и химическая энергия превращается в электрическую энергию постоянного тока. Примеры решения типовых задач Пример 1. Укажите, с какими из указанных растворов (FeSO4, CuSO4 и Na2SO4) будет взаимодействовать никель при стандартных условиях? Приведите уравнения возможных реакций. Решение. Возможность взаимодействия металла с раствором соли и вытеснения из данного раствора металла, входящего в эту соль, можно определить на основании значений стандартных электродных потенциалов металлов (ряд напряжений). Каждый металл этого ряда вытесняет (восстанавливает) из растворов солей только те металлы, ионы которых расположены за ним, т.е. имеют более высокие значения электродных потенциалов. Из табличных данных (Прил., табл. 12) находим значения E o Меn+ / Me для никеля и металлов, ионы которых входят в состав солей: E oNi2+ / Ni=−0,25 B; E o Fe2+ / Fe=−0,44 B; E oCu2+/ Cu=+0,34 В; E oNa+/ Na=−2,71 B. Следовательно, из предлагаемых растворов солей никель способен вытеснить только медь, так как E oCu2+/ Cu> E oNi2+ / Ni. Уравнение реакции имеет вид: Ni + CuSO4 ↔ NiSO4 + Cu, восстановитель ½Ni окислитель ½Cu2+ + 2 Пример 2. Рассчитайте электродный потенциал меди, находящейся в растворе сульфата меди с концентрацией ионов [Cu2+ ]=0,001 моль/л. Решение. Электродный потенциал металла вычисляется по уравнению Нернста. В табл. 12 приложения находим значение стандартного электродного потенциала E oCu2+/Cu =+0,34 В. E Cu2+/ Cu =+0,34 + Пример 3. Вычислите электродный потенциал для водородного электрода при температуре 25 оС и парциальном давлении Н2 1 атм, рН которого равен 3. Решение. Уравнение Нернста для расчета потенциала водородного электрода в разных средах: Пример 4. Вычислите потенциал кислородного электрода в растворе с концентрацией ионов [Н+]=10-1 моль/л при температуре 25 оС и парциальном давлении О2 1 атм. Решение. Уравнение Нернста для расчета потенциала кислородного электрода в разных средах: Е O2+2H2O / 4OH- = Е оO2+2H2O / 4OH-+0,059рОН. Учитывая, что рН+рОН=14 и рН=− lg[H+], рассчитываем потенциал кислородного электрода: Е O2+2H2O / 4OH- =0,4+0,059х13=1,167 В. Пример 5. Рассчитайте ЭДС гальванического элемента Fe/ Fe(NO3)2 IIAgNO3/Ag при концентрации раствора Fe(NO3)2, равной 0,1 моль/л и концентрации раствора [AgNO3]=0,001 моль/л. Решение. E Fe2+ / Fe = −0,44+ E Ag+ / Ag = +0,8+0,059 lg10-2 =+0,682 B. Следовательно, железный (Fe) электрод является анодом, серебряный (Ag) – катодом. ЭДС= Е к– Е а=+0,682–(–0,4695)=1,1515 В. ЭЛЕКТРОЛИЗ Основные понятия электролиза Электролизом называется окислительно-восстановитель-ный процесс, протекающий при прохождении электрического тока, подаваемого от внешнего источника, через раствор или расплав электролита. При этом энергия постоянного электрического тока превращается в химическую энергию. Электролиз проводится в электролизерах, представляющих собой электрохимическую ячейку, состоящую из двух соединенных с внешним источником тока электродов, помещенных в электролит. В электролите перенос электричества осуществляется направленным перемещением ионов: положительно заряженные ионы − катионы движутся к катоду − электроду, подключенному к отрицательному полюсу внешнего источника тока, а отрицательно заряженные ионы – анионы – к аноду, подключенному к положительному полюсу внешнего источника тока. На катоде происходит восстановление катионов, на аноде – окисление анионов. Для исключения взаимодействия продуктов электролиза, образующихся на катоде и аноде, применяют электролизеры с диафрагмами или мембранами. Наиболее эффективны ионнообменные мембраны, проницаемые только для ионов одного знака. Катоды обычно изготавливают из графита, стали, Pt Ni, аноды − из Pt, Ni, нержавеющей стали, графита, а также Тi, покрытого оксидами металлов. Как правило, используют перфорированные электроды, что позволяет увеличить их поверхность. Количественные соотношения при электролизе подчиняются законам Фарадея. При прохождении тока электроды и вся система в целом переходят в неравновесное состояние, которое сопровождается изменением электродных потенциалов по сравнению с равновесными значениями. Электроды, потенциал которых отличается от равновесного потенциала, называются поляризованными, а само явление – электродной поляризацией. Различают катодную В результате поляризации потенциал анода смещается в положительную сторону, потенциал катода – в отрицательную сторону. В ряде случаев поляризация при электролизе играет положительную роль. Например, вследствие поляризации выделения Н2 удается осадить при электролизе водных растворов солей многие металлы, для которых равновесные потенциалы более отрицательны, чем потенциал водорода. Это Fe, Pb, Sn, Co, Ni, Zn, Cd, Cr. Разрядка в водных растворах ионов Сl-, а не ОН- в растворах с высокой концентрацией электролита объясняется высокой поляризацией кислорода.
|
||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 1509; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.01 с.) |

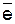
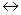 Н2. Уравнение Нернста для расчета потенциала водородного электрода имеет следующий вид:
Н2. Уравнение Нернста для расчета потенциала водородного электрода имеет следующий вид: (8.5)
(8.5) −активность ионов Н+ в электролите; р Н
−активность ионов Н+ в электролите; р Н  −парциальное давление водорода.
−парциальное давление водорода.
 (8.7)
(8.7) (8.8)
(8.8) О+О
О+О  ОН- =1 моль/л).
ОН- =1 моль/л). =1,229−0,059рН. (8.9)
=1,229−0,059рН. (8.9) =−0,76 В,
=−0,76 В,  =+0,34 В).
=+0,34 В).
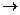 Zn2++ 2
Zn2++ 2  Cu2++ 2
Cu2++ 2  2
2  SO42-
SO42-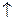 (на Cu).
(на Cu). 2
2  2
2 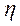 и величину омического падения напряжения во внешней и внутренней цепях I (r1 + r2):
и величину омического падения напряжения во внешней и внутренней цепях I (r1 + r2): (р-р);
(р-р);
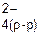 «PbSO4(тв) + 2
«PbSO4(тв) + 2 


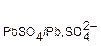 =−0,356 В, Е о
=−0,356 В, Е о  =+1,685 В.
=+1,685 В.

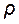 =1,19 г/см3 аккумулятор разряжен на 50%, при
=1,19 г/см3 аккумулятор разряжен на 50%, при 
 ч). В последние годы проводятся исследования по совершенствованию существующих и созданию новых аккумуляторов, что обусловлено необходимостью создания экологически чистых автомобилей.
ч). В последние годы проводятся исследования по совершенствованию существующих и созданию новых аккумуляторов, что обусловлено необходимостью создания экологически чистых автомобилей. 
 =0,25 В.
=0,25 В. =−0,059рН. Вычисляем потенциал водородного электрода при рН=3.
=−0,059рН. Вычисляем потенциал водородного электрода при рН=3.  3=−0,017 В.
3=−0,017 В.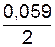 lg10-1=0,44+(−0,0295)=–0,4695 B;
lg10-1=0,44+(−0,0295)=–0,4695 B; и анодную
и анодную  поляризацию.
поляризацию.


