
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тепловой эффект химической реакцииСодержание книги
Поиск на нашем сайте Тепловой эффект химической реакции – изменение энергии системы в результате протекания химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения. Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (∆Н <0), то реакция называется экзотермической. Реакция, протекающая с поглощением теплоты, т.е. с повышением энтальпии (∆Н >0), называется эндотермической. Тепловой эффект химической реакции при постоянном давлении называют энтальпией химической реакции. Тепловой эффект, приведенный к стандартным термодинамическим условиям, называется стандартным изменением энтальпии реакции (∆ Н о298, реакции). Термохимические расчеты Закон Гесса. Тепловой эффект химической реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий. + О2(г)
СО(г)
Например, процесс окисления углерода С(тв) до СО2(г) можно осуществить как через стадию непосредственного сгорания углерода до углекислого газа с тепловым эффектом ∆Н (путь I), так и через стадию образования промежуточного продукта − окиси углерода − СО(г) с тепловым эффектом ∆Н 1, с последующим окислением СО(г) до СО2(г) с тепловым эффектом ∆Н 2 (путь II) в соответствии с уравнениями реакций: С(тв) + О2(г)
С(тв) + ½О2(г) СО(г) + ½О2(г) -------------------------------------------------- С(тв) + О2(г) Из сопоставления тепловых эффектов реакций следует, что ∆Н = ∆Н 1+ ∆Н 2, т.е. каким бы путем не осуществлялась реакция, ее тепловой эффект будет одинаков, если не меняется конечное и исходное состояния системы. Закон Гесса позволяет рассчитать энтальпию химических реакций. Энтальпия химической реакции ∆Н о298,реакции равна разнице суммы стандартных энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов: ∆Н о298,реакции=∑ ∆Н о298,продукты реакции –∑ ∆Н о298,исходные вещества. В общем случае, для реакции в стандартных условиях аА(г) + bВ(г) → сС(г) + dD(г), ∆Н о298,реакции =[c ∆Н оC(г)+d ∆Н оD(г)]−[a∆НоA(г)+b ∆Н оB(г)], кДж, где ∆Н о298,реакции – энтальпия химической реакции, кДж; ∆Н оА(г), ∆Н оВ(г), ∆Н оС(г), ∆Н оD(г)) – стандартные значения энтальпий образования веществ, участвующих в реакции, кДж/моль; а, b, c, d – стехиометрические коэффициенты в уравнении реакции. Можно также рассчитать значение стандартной энтальпии образования одного из исходных веществ или продуктов, если известны энтальпии образования остальных реагентов и энтальпия химической реакции. Например, для реакции аА(г) + bВ(г) → сС(г) + dD(г), ∆Н о298,реакции>0. ∆Н оA(г) =c ∆Н оC(г)+d ∆Н оD(г)−b ∆Н оB(г)− ∆Н о298,реакции, кДж/моль А(г). Зная теплоты образования веществ, можно определить и их теплоты разложения по закону Лавуазье-Лапласа: При разложении сложного вещества на простые поглощается (или выделяется) столько же теплоты, сколько выделяется (или поглощается) при его образовании из простых веществ в тех же условиях. Так, если Н2О(г) → Н2(г) + ½О2(г), ∆Н о298,реакции=241,8 кДж, то Н2(г) + ½О2(г) → Н2О(г), ∆Н о298,реакции=−241,8 кДж. 3.7. Понятие об энтропии и второй закон термодинамики Первый закон термодинамики позволяет определить тепловые эффекты химических реакций (но не направление реакций в данных условиях). Датский химик Ю. Томсен, а затем французский химик М. Бертло высказали предположение о том, что химические процессы самопроизвольно идут только с выделением теплоты, т.е. с уменьшением энтальпии системы (с экзотермическим эффектом, ∆Н < 0). Однако известно много примеров, когда химические реакции самопроизвольно протекают с поглощением теплоты, и, более того, одни и те же реакции в зависимости от условий могут идти как в прямом, так и в обратном направлениях. Решить вопрос о направлении химической реакции в данных условиях можно на основании закономерностей, вытекающих из второго закона термодинамики (и, в первую очередь, представления о термодинамической функции состояния, называемой энтропией).
|
|||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 407; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.009 с.) |



 C(тв) СО2(г), ∆Н (путь I)
+ ½ О2(г), + ½ О2(г),
Н 1 ∆Н 2, (путь II)
C(тв) СО2(г), ∆Н (путь I)
+ ½ О2(г), + ½ О2(г),
Н 1 ∆Н 2, (путь II)
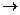 СО2(г), ∆Н (I)
СО2(г), ∆Н (I)


