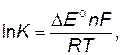Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Направление окислительно-восстановительных реакцийСодержание книги
Поиск на нашем сайте Самопроизвольное протекание окислительно-восстановительной реакции, как и любой другой реакции, сопровождается уменьшением энергии Гиббса. Разность стандартных электродных потенциалов окислителя и восстановителя (∆Eо) связана со стандартной энергией Гиббса (∆G о) соотношением: ∆G о =nF∆E о, (7.3) где n – число принятых (или отданных) в ходе реакции электронов; F – число Фарадея (96500 Кл); ∆E о – изменение стандартного окислительно-восстановительного потенциала в ходе процесса, ∆E о =Е оокис.– Е овосст. . Из уравнения (7.3) следует, что возможность самопроизвольного протекания окислительно-восстановительной реакции определяется значением ∆E о. Если изменение стандартного окислительно-восстановительного потенциала имеет положительное значение (∆Е о= Е оокис.– Е овосст.>0 ), то ∆G < 0 и реакция может протекать в прямом направлении. Если ∆E <0, то ∆G >0 и прямая реакция в данных условиях невозможна, а возможна лишь обратная реакция. В качестве примера рассмотрим реакцию: SnCl2 + 2FeCl3 Состоянию олова и железа в этой реакции соответствуют окислительно-восстановительные пары Sn4+/Sn2+ и Fe3+/Fe2+, значения E одля которых равны +0,15 В и +0,77 В соответственно (см. прил., табл. 11). В молекуле FeCl3 атом железа находится в высшей степени окисления и, следовательно, способен быть только окислителем. Атом олова в молекуле SnCl2 имеет промежуточную степень окисления и в присутствии сильного окислителя (FeCl3) является восстановителем. Разность ∆Е о= Е оокис.– Е 0восcт. = 0,77–0,15=0,62 В величина положительная, следовательно, в стандартных условиях данная реакция будет осуществляться в прямом направлении. Соотношение в величинах Е оокис. и Е овосcт. определяет и глубину протекания процесса: чем больше разность этих величин, тем полнее превращение. Часто реакции окисления-восстановления не доходят до конца, и в системе устанавливается равновесие, характеризуемое константой равновесия, которая может быть вычислена по уравнению
где К – константа равновесия; ∆E о= Е оокис.– Е овосст. – изменение стандартного окислительно-восстановительного потенциала; n – число отданных (принятых) электронов в ходе реакции; F – число Фарадея, равное 96500 Кл; R – газовая постоянная, равная 8,31Дж/моль·К; T – абсолютная температура, К. Составление уравнений окислительно- Восстановительных реакций Составление уравнения окислительно-восстановительной реакции – задача более сложная, чем в случае реакций обмена, так как в реакции могут участвовать более двух реагентов (окислитель, восстановитель и среда) и образоваться несколько продуктов. Продукты реакции можно определить теоретически, используя значения стандартных окислительно-восстановительных потенциалов, или экспериментально, анализируя состав реакционной системы. При составлении уравнения окислительно-восстановительной реакции необходимо: 1. Выбрать окислитель и восстановитель. 2. Определить, учитывая характер среды, какие вещества, кроме окислителя и восстановителя, будут участвовать в реакции, и какие продукты могут быть получены. 3. Подобрать коэффициенты в уравнении реакции. Существует несколько способов составления окислительно- восстановительных реакций. Наибольшее применение нашли метод электронно-ионного баланса и метод электронного баланса. Метод электронно-ионного баланса основан на использовании значений стандартных окислительно-восстановительных потенциалов при выборе окислителя и восстановителя, составлении электронно-ионных уравнений и последующем суммировании двух уравнений, записанных для процессов окисления и восстановления, в ионно-молекулярное уравнение. Метод электронного баланса используется в основном для подбора стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водных растворах. Этот метод имеет то преимущество, что при его применении необязательно знать степени окисления атомов, участвующих в реакции ионов. Метод электронного баланса применим для составления уравнений окислительно-восстановительных процессов, протекающих как в растворах и расплавах, так и в твердых и газообразных системах. Данный метод основан на уравнивании числа отданных и принятых электронов исходя из изменения степеней окисления атомов в исходных и конечных веществах и последующем составлении схемы электронного баланса. Вопрос о продуктах реакции может быть решен или экспериментально, или теоретически, используя значения стандартных окислительно-восстановительных потенциалов (Е о). В данном учебном пособии для студентов-заочников при составлении ОВР используется метод электронного баланса, причем продукты окислительно-восстановительных реакций определены. Задача состоит в подборе и расстановке коэффициентов. Коэффициенты подбирают методом электронного баланса с помощью электронных уравнений, учитывая правила сохранения числа атомов каждого элемента в реакции и сохранения заряда.
|
||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 401; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.006 с.) |

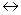 SnCl4 + 2FeCl2.
SnCl4 + 2FeCl2.