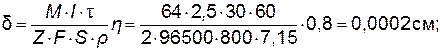Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение (9.2) может быть записано какСодержание книги
Поиск на нашем сайте
Выход по току всегда меньше 100%, что связано с утечкой тока (часто из-за плохих контактов), а также из-за вторичных процессов, имеющих место при электролизе. Вторичные процессы, обычно искажающие ожидаемые результаты, возникают в силу следующих причин: изменение среды при электролизе, изменение электродов при разрядке ионов, взаимодействие продуктов электролиза между собой. Применение электролиза Электролиз широко используется в различных областях промышленности. Электролиз в металлургии. Получение свободных металлов с помощью электролиза называют электрометаллургией. Электролиз водных растворов называют гидроэлектрометаллургией, расплавов солей или оксидов при высокой температуре – пироэлектрометаллургией. Электролизом растворов солей получают медь, цинк, кадмий, никель и другие металлы. На катоде происходит разряд ионов металла из растворов, которые получают в результате физической и химической обработки руд: (−) К: Men+ + n В этих процессах используют нерастворимые аноды, на которых обычно выделяется галоген или кислород и регенерируется соответствующая кислота, например H2SO4, при электролизе из сернокислых электролитов. Электролиз с нерастворимым анодом осуществляется как в электролизерах без диафрагм (получение цинка), так и с диафрагмами – получение Mn, Cr и других металлов. Электролиз с растворимым анодом используют для рафинирования (очистки) черновых металлов: меди, серебра, золота, свинца, олова и др. от вредных примесей. Этот способ также используется и для извлечения ценных компонентов из очищаемого металла. Процесс электрорафинирования, как правило, осуществляют в электролизерах без диафрагм. Анодом служит подвергаемый очистке металл. После включения тока катионы основного металла и примесей, имеющих наиболее отрицательный потенциал, чем потенциал основного металла, переходят в раствор электролита: (+) А: Ме основной металл ↔ Меn+р-р + n (+) А: Ме примеси ↔ Меn+р−р + n Примеси, имеющие большее значение электродного потенциала по сравнению с основным металлом, не растворяются и оседают из анода в виде шлама. На катоде в первую очередь осаждается металл, имеющий наиболее положительный потенциал. Так как потенциалы меди, серебра, свинца и олова положительнее, чем потенциалы других металлов (примесей), то каждый из этих металлов в первую очередь выделяется на катоде, а примеси остаются в растворе. При малой концентрации примесей их потенциалы в соответствии с уравнением Нернста сдвигаются в сторону отрицательных значений, что способствует преимущественному выделению на катоде основного металла в чистом виде: (−) К: Меn+р-р + n Рассмотрим, например, рафинирование меди. Черновую медь, содержащую 98,0…99,5 % Cu, получают пирометаллургическим методом. Главный потребитель меди – электротехническая промышленность, где используется медь высокого качества (99,92…99,96 % Cu). Черновая медь содержит наряду с другими примесями (Zn, Ni, Fe, Sb, As и др.) серебро и золото (до 7 кг Ag и 0,3 кг Au на 1т меди). Литые аноды из черновой меди помещают в электролит. Между ними помещают катоды из тонких листов электролитической меди. Электролитом служит раствор, содержащий CuSO4 и серную кислоту, добавляемую для повышения электропроводности электролита. При электролизе медь из анодов растворяется (+) А: Cu Вместе с ней переходят в раствор и электроотрицательные примеси: Zn, Ni, Fe, Sb, As. Например, (+) А: Zn Электроположительные примеси (Au, Ag) в раствор не переходят, а выпадают в осадок (шлам) в виде частиц металла. На катоде осаждается только чистая медь: (−) К: Cu2+р-р + 2
а электроотрицательные примеси, постепенно накапливаясь, загрязняют электролит: Электролизом расплавов соединений получают алюминий, магний, натрий, бериллий, а также сплавы некоторых металлов. Электролиз в технике используют в таких процессах, как гальванопластика, гальваностегия, электрохимическая обработка металлов, электромеханическая заточка и шлифование, а также специальная обработка поверхности – очистка от жировых и оксидных пленок, необходимая для дальнейших операций. При этом используются как катодные, так и анодные процессы электролиза. Катодные процессы используются в основном: а) при электрохимическом обезжиривании поверхности (очистки от жировых пленок) в щелочных и слабокислых растворах (ионы водорода, проникая через пленку жира, разряжаются на поверхности металла с образованием пузырьков газа, уносящих с собой пленку жира); б) при электрохимическом травлении (очистки от оксидных пленок) поверхности (принцип аналогичен предыдущему). При этом следует иметь в виду, что водород частично диффундирует в поверхностный слой металла, делая его хрупким. Использование ингибиторов предотвращают диффузию водорода в металл. Анодные процессы используют: 1) при анодном оксидировании – создании на поверхности металла оксидных слоев в целях защиты от коррозии или для декоративных целей (на стали, магнии, алюминии, меди и медных сплавов); 2) при травлении металла до нужной толщины; 3) при электрополировании – доводки металлических поверхностей. Оставшиеся после механической обработки выступы, шероховатости на поверхности сложной конфигурации подвергают растворению, подобрав соответствующий электролит и плотность тока. Гальванопластика − процесс получения точных металлических копий с рельефных предметов электроосаждением метал ла. Предмет, с которого хотят получить копию, покрывают воском и получают матрицу. Затем на матрицу наносится тонкий слой графита. Графитовый катод помещают в электролитическую ванну с раствором соли осаждаемого металла (например, CuSO4) и осуществляют электролиз с растворимым анодом (Cu). На аноде происходит процесс окисления меди (Cu), на катоде – восстановление ионов меди из раствора CuSO4: (+) A: Cu ↔ Cu2+ + 2 (−) K: Cu2+ + 2 Получается изделие из меди с толщиной стенок, исчисляемой микрометрами. Такие тонкостенные изделия используются, например, для изготовления клише для печати и матриц грампластинок. Получение гальванических покрытий. Гальваническими называются металлические покрытия, наносимые на поверхность какого-либо изделия методом электролиза. Гальваническим способом можно получить покрытия всеми металлами и сплавами, которые могут выделяться на катоде. Толщина покрытий в зависимости от их назначения составляет 1–100 мкм. Гальванические покрытия широко применяются во многих областях техники и имеют различные назначения: а) защита от коррозии: цинкование, кадмирование, лужение и др.; б) защита от коррозии и придание красивого внешнего вида (защитно-декоративные): никелирование, хромирование, серебрение и золочение; в) повышение твердости и износостойкости: хромирование и др. Нанесение гальванических покрытий проводится в электролизере, называемом гальванической ванной. Электролиз проводят с растворимым анодом. Анодом обычно является такой же металл, что и металл покрытия. Металлическое изделие (катод) помещают в электролитическую ванну, электролитом служит раствор соли осаждаемого металла. На аноде протекает процесс окисления металла покрытия, на катоде − восстановление находящихся в растворе электролита ионов металла (электроосаждение металла): (+) А: Me (−) К: Men+ + n При нанесении покрытий на металл электролизом, изделия получаются ровными по толщине, прочными. Форма изделий может быть любая. Иногда, чтобы не расходовать дорогие металлы, производят многослойные покрытия. Например, внешние детали автомобилей покрывают сначала медью (тонкий слой), затем никелем и в конце хромом, получается очень стойкое и прочное покрытие. Зная плотность металла покрытия (
Электрохимическая анодная обработка металлов и сплавов. Для изменения размеров и формы, а также состояния поверхности металлических изделий используют электрохимические способы обработки: анодирование, электрохимическая размерная обработка, анодирование и др. Анодная обработка изделий для придания им требуемой формы получила название электрохимической обработки металлов. Этот способ обработки металлов во многих случаях имеет важные достоинства, так как позволяет обрабатывать детали сложной конфигурации; металлы, которые механически или вообще не могут быть обработаны, или обрабатываются с большим трудом (например, очень твердые металлы и сплавы). Кроме того, инструмент (катод) при этом не изнашивается, а обработка не влечет изменения структуры металла. Как и при обычном электролизе с растворимым анодом, при электрохимической обработке происходит анодное растворение металла: Me 2Н+ + 2 Анодное оксидирование (анодирование) широко применяют для обработки металлов, прежде всего алюминия. Алюминиевое изделие играет роль анода электролизера. Электролитом служит раствор серной, ортофосфорной, борной или щавелевой кислот, катодом может быть металл, не взаимодействующий с раствором электролита, например, нержавеющая сталь или свинец. На катоде выделяется водород, на аноде происходит образование оксида алюминия Al2O3:
(+) A: 2Al + 3H2O ↔ Al2O3 + 6H++ 6 (−) K: 2H+ + 2 Механизм реакции имеет сложный характер. Электродная реакция протекает в несколько стадий. Наряду с образованием оксида происходит его частичное растворение в кислоте: Al2O3 + 6H+ В результате пленка становится пористой, через поры пленки проникают ионы Al3+ и процесс роста продолжается. Полученная пленка Al2O3 имеет ценные свойства. Так как размеры пор оксидной пленки очень малы, то она может быть пропитана различными составами, повышающими коррозионную стойкость поверхности. Оксидная пленка на алюминии имеет высокую твердость, поэтому после анодирования и пропитки оксидного слоя смазкой значительно повышается износостойкость деталей. В растворах борной и щавелевой кислот получаются тонкие плотные пленки с высоким электросопротивлением, например для алюминия высокой чистоты − пленки с электросопротивлением 1014 Ом·см. Электролиз нашел применение в различных отраслях техники, причем области его использования непрерывно расширяются. Примеры решения типовых задач Пример 1. Рассчитайте количество меди, выделенное на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А. Решение. Катодный процесс: Cu2+ + 2
Пример 2. Рассчитайте силу тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях. Решение. Катодный процесс: 2Н2О + 2 Величину тока рассчитываем из уравнения (9.2) по формуле:
Пример 3. Вычислите, сколько граммов КОН образовалась у катода при электролизе водного раствора K2SO4, если на аноде выделилось 1,2 л кислорода, измеренного при нормальных условиях. Решение: Электролиз раствора K2SO4 протекает по следующей схеме: К2SO4 + Н2О ↑↓ (−) K (Pt) (−) К: 2Н2О + 2
2Н2О ↔ 2Н2 Объем моля эквивалентов кислорода (н.у.) равен 22,4/4=5,6 л. Следовательно, 11,2 л кислорода составляет 2 моль эквивалентов. Столько же, т.е. 2 моль эквивалентов КОН, образовалось у катода или 56,11 Пример 4. Рассчитайте, сколько граммов чистой соли необходимо для получения 71 г хлора электролизом водного раствора NaCl (выход по току 100 %). Решение. Электролиз раствора NaCl протекает по следующей схеме: 2NaCl + 2Н2О ↑↓ (−) K (Pt) (−) К: 2Н2О + 2
2NaCl + 2Н2О Масса 1 моля эквивалентов хлора равна 71:2=35,5 г. Следовательно, 71 г хлора составляет 2 моль эквивалентов. Столько же, т.е. 2 моля эквивалентов NaCl необходимо взять для электролиза или 58,5 Пример 5. Вычислите массу разложившейся воды и объемы водорода и кислорода при н.у., выделившихся на электродах при электролизе водного раствора Н2SО4 током силой 10 А в течение 1 ч. Решение. Используя объединенное выражение законов Фарадея (9.2), рассчитаем объемы водорода и кислорода:
Электролиз водного раствора Н2SО4 протекает по следующей схеме: (−) К: 4Н+ + 4 (+) А: 2Н2О ↔ О2
2Н2О ↔ 2Н2 Рассчитываем эквивалентный объем кислорода при н.у.: VЭ = 22,4/4=5,6 л/моль экв и определяем число эквивалентов кислорода: n э = V/Vэ =2,09/5,6=0,373 моль экв. Согласно закону эквивалентов такое же количество эквивалентов, т.е. 0,373 моль экв., разложилось воды. Зная молярную массу эквивалентов Н2О, рассчитаем ее массу: m (H2O)=Mэ Пример 6. Рассчитайте толщину слоя цинка, выделившегося в течение 30 мин на железном катоде площадью 800 см2 при электролизе раствора ZnCl2 силой тока, равной 2,5 А. Коэффициент выхода по току равен 0,8. Плотность цинка Решение. В соответствии с уравнением (9.8)
КОРРОЗИЯ МЕТАЛЛОВ
|
||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 413; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.011 с.) |


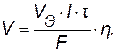 (9.7)
(9.7)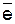
 Me.
Me. , г/см3), молярную массу его эквивалента (МЭ, г/моль экв), коэффициент выхода по току (
, г/см3), молярную массу его эквивалента (МЭ, г/моль экв), коэффициент выхода по току (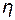 ), катодную плотность тока (i =
), катодную плотность тока (i = 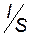 , А/см2) и время процесса (
, А/см2) и время процесса (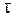 ,с), можно определить толщину слоя покрытия (
,с), можно определить толщину слоя покрытия (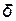 , см):
, см):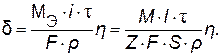 (9.8)
(9.8) .
. Cu. Количество меди рассчитываем по уравнению закона Фарадея (9.1):
Cu. Количество меди рассчитываем по уравнению закона Фарадея (9.1):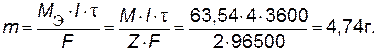
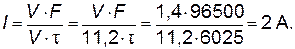
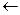 2K+ + SO42
2K+ + SO42 
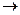 (+) A (Pt);
(+) A (Pt);
 2=112,22 г (56,11 г – масса 1–го моля эквивалентов КОН).
2=112,22 г (56,11 г – масса 1–го моля эквивалентов КОН).
 2=117 г (58,5 г – масса 1-го моля эквивалентов NaCl) при
2=117 г (58,5 г – масса 1-го моля эквивалентов NaCl) при 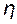 =100%.
=100%.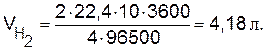
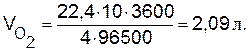

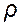 = 7,15 г/см3.
= 7,15 г/см3.