
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Элементах и при коррозии металловСодержание книги
Поиск на нашем сайте
В процессе работы гальванического элемента и при электрохимической коррозии металлов могут происходить изменения величин электродных потенциалов. Например, в элементе Вольта медный электрод насыщается водородом и образует «водородный электрод», потенциал которого ниже ( Явление уменьшения разности потенциалов между электродами гальванического или микрогальванического элемента при его работе называется поляризацией. Если это уменьшение происходит за счет затруднений в протекании катодной реакции (потенциал катода уменьшается), то поляризация называется катодной. Такой вид поляризации наблюдается в элементе Вольта. Если в поляризации повинен анодный процесс (потенциал анода увеличивается, т.е. анод становится менее активным, например, за счет образования на нем оксидных и других защитных пленок), то говоря об анодной поляризации. Такой вид поляризации часто наблюдается при коррозии металлов. Например, на многих металлах под действием окружающей среды образуются оксидные и др. пленки, которые в дальнейшем препятствуют окислению металла. Поляризация – вредное явление для гальванических элементов. Поэтому ее стараются устранить или уменьшить. Процесс уменьшения поляризации называют деполяризацией, а вещества, которые уменьшают поляризацию – деполяризаторами. Например, для устранения катодной поляризации применяются сильные окислители, потенциал которых значительно выше, чем у водорода, такие как MnO2, KMnO4, K2Cr2O7 и др. Для металлов явление поляризации полезно, так как уменьшает разность потенциалов между катодными и анодными участками, что приводит к уменьшению потерь металла. Многие способы защиты металлов от коррозии основаны на том, чтобы увеличить анодную или катодную поляризацию путем создания защитных пленок на поверхностях металлов. 10.4.Защита металлов от коррозии Для защиты металлов от коррозии применяются различные способы, которые условно можно разделить на три основные группы. Механические способы. Эти способы заключаются в механическом нанесении на поверхность металла защитного слоя (окраска, покрытие эмалью, лаком, нанесение полимерного покрытия и т.д.). При этом сам металл никаких химических изменений не претерпевает. Нанесение защитных покрытий – самый распространенный метод борьбы с коррозией. Защитные покрытия не только защищают изделия от коррозии, но и придают поверхностям ряд ценных физико-химических свойств (износостойкость, электрическую проводимость и др.). Общими требованиями для всех видов защитных покрытий являются высокая адгезионная способность, целостность слоя покрытия и стойкость в агрессивной среде. Химические способы очень разнообразны. К ним относится, например, обработка поверхности металла веществами, вступающими с ним в химическую реакцию и образующими на его поверхности пленку устойчивого химического соединения, в формировании которой принимает участие сам защищаемый металл. К числу таких способов относится оксидирование, фосфатирование, сульфидирование и др. Сущность различных методов оксидирования заключается в создании на поверхности металла пленки оксидов, которая обладает значительно большей коррозионной стойкостью, чем металл. Для железа и его сплавов наиболее часто используется щелочное оксидирование в растворе, содержащем NaOH, NaNO3, NaNO2 при температуре 135…140oС. Оксидирование черных металлов называется воронением. На анодных участках происходит процесс окисления: Fe На катодных участках происходит процесс восстановления: 2Н2О + О2 + 4 На поверхности металла в результате работы микрогальванических элементов образуется Fe(OH)2, который затем окисляется в Fe3O4. Оксидная пленка на малоуглеродистой стали имеет глубокий черный цвет, а на высокоуглеродистой стали – черный с сероватым оттенком. Fe2+ + 2OH- 12Fe(OH)2 + NaNO3 Противокоррозионные свойства поверхностной пленки оксидов невысоки, поэтому область применения этого метода ограничена. Основное назначение – декоративная отделка. Воронение используется в том случае, когда необходимо сохранить исходные размеры, так как оксидная пленка составляет всего 1,0 …1,5 микрона. Фосфатирование – метод получения фосфатных пленок на изделиях из цветных и черных металлов. Для фосфатирования металлическое изделие погружают в растворы фосфорной кислоты и ее кислых солей (H3PO4+Mn(H2PO4)2) при температуре 96…98 оС. На поверхности металла в результате работы микрогальванических элементов образуется фосфатная пленка, которая имеют сложный химический состав и содержит малорастворимые гидраты двух − и трехзамещенных фосфатов марганца и железа: MnHPO4, Mn3(PO4)2, FeHPO4,Fe3(PO4)2 × n H2O. На анодных участках происходит процесс окисления: Fe На катодных участках происходит процесс восстановления водорода: 2Н+ + 2 При взаимодействии ионов Fe2+ с анионами ортофосфорной кислоты и ее кислых солей образуются фосфатные пленки: Fe2+ + H2PO-4 3Fe2+ + 2PO43- Образующаяся фосфатная пленка химически связана с металлом и состоит из сросшихся между собой кристаллов, разделенных порами ультрамикроскопических размеров. Фосфатные пленки обладают хорошей адгезией, имеют развитую шероховатую поверхность. Они являются хорошим грунтом для нанесения лакокрасочных покрытий и пропитывающих смазок. Фосфатные покрытия применяются в основном для защиты металлов от коррозии в закрытых помещениях, а также как метод подготовки поверхности к последующей окраске или покрытию лаком. Недостатком фосфатных пленок являются низкая прочность и эластичность, высокая хрупкость. Анодирование – это процесс образования оксидных пленок на поверхности металла и прежде всего алюминия. В обычных условиях на поверхности алюминия присутствует тонкая оксидная пленка оксидов Al2O3 или Al2O3 ∙ n H2O, которая не может защитить его от коррозии. Под воздействием окружающей среды алюминий покрывается слоем продуктов коррозии. Процесс искусственного образования оксидных пленок осуществляется химическими и электрохимическими способами. При электрохимическом оксидировании алюминия алюминиевое изделие играет роль анода электролизера. Электролитом служит раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот, катодом может быть металл, не взаимодействующий с раствором электролита, например нержавеющая сталь. На катоде выделяется водород, на аноде происходит образование оксида алюминия. Суммарный процесс на аноде можно представить следующим уравнением: 2Al + 3H2O Механизм реакции имеет сложный характер. Электродная реакция протекает в несколько стадий. Наряду с образованием оксида происходит его частичное растворение в кислоте: Al2O3 + 6H+ В результате пленка становится пористой, через поры пленки проникают ионы и процесс роста пленки продолжается. Полученная пленка Al2O3 весьма пориста, причем размеры пор очень малы. Вследствие этого пленка может быть пропитана различными составами, повышающими коррозионную стойкость поверхности. Оксидная пленка на алюминии имеет высокую твердость, поэтому после анодирования и пропитки оксидного слоя смазкой значительно повышается износостойкость деталей. К химической защите можно отнести также применение веществ, введение которых в коррозионно-агрессивную среду значительно снижает коррозию металлов. Такие вещества называют ингибиторами коррозии. Применение ингибиторов основано на кинетических принципах (уменьшается скорость коррозии металла). По механизму своего действия на процесс электрохимической коррозии различают адсорбционные и пассивационные ингибиторы. Механизм действия значительного числа ингибиторов заключается в адсорбции ингибитора на поверхности металла и последующем торможении катодных и анодных процессов. Адсорбционные ингибиторы уменьшают скорость коррозии за счет снижения интенсивности процесса или сокращения площади участков, лимитирующих процесс. К таким ингибиторам относятся органические вещества, содержащие в своем составе серу, азот, фосфор (диэтиламин, формальдегид, пиридин). Их широко используют при травлении металлов кислотами, а также для защиты от атмосферной коррозии. Для защиты металлических изделий в воздушной атмосфере, при перевозке, хранении используют летучие (атмосферные) ингибиторы, имеющие достаточно высокое давление паров. Ими пропитывают упаковочные материалы. Вследствие достаточно высокого давления паров летучие ингибиторы достигают границы раздела металл/воздух и растворяются в пленке влаги, покрывающей металл. Далее они адсорбируются на поверхности металла и образуют на нем защитную пленку. В качестве летучих ингибиторов используются обычно амины с небольшой молекулярной массой. Пассивационные ингибиторы способствуют образованию на поверхности металла защитных пленок, в их присутствии поверхность металла становится пассивной и не подвергается воздействию окружающей среды. Они применяются, как правило, в нейтральных и щелочных средах, когда протекает коррозия с восстановлением кислорода. К ним относятся в основном неорганические вещества: хроматы, нитриты, а также некоторые органические вещества, например, соли бензойной и других органических кислот. Электрохимические способы основаны на торможении анодных или катодных процессов. Метод эффективен в коррозионных средах с хорошей ионной электрической проводимостью.Сущность метода состоит в уменьшении скорости электрохимической коррозии металла при поляризации электрода от источника постоянного тока или при контакте с добавочным электродом, являющимся анодом по отношению к защищаемой конструкции металла. В зависимости от вида поляризации различают катодную и анодную защиты. Катодная защита внешним током. В этом случае защищаемый металл присоединяется к отрицательному полюсу источника постоянного тока и становится катодом, дополнительный электрод – к положительному. Источник постоянного тока перекачивает электроны от дополнительного электрода на защищаемый металл, который все время поддерживается в восстановленном состоянии. В качестве дополнительного электрода чаще всего используется металлический лом. Вспомогательный электрод (анод) растворяется: (−) А: Me где Ме – дополнительный электрод. На защищаемом металле (катоде) в зависимости от характера среды выделяется водород или разряжается кислород. Катодная защита внешним током применяется главным образом для защиты металлических конструкций (трубопроводов, газопроводов, кабельных установок) от коррозии в условиях несильно агрессивных сред. Метод протектора. Его преимущество состоит в том, что нет необходимости во внешнем источнике постоянного тока, специальное сооружение которого бывает иногда экономически нецелесообразно. При протекторной защите к изделию подсоединяют металл или сплав-протектор, потенциал которого значительно отрицательнее потенциала металла изделия. В образующемся гальваническом элементе протектор служит отрицательным электродом (анодом) и постепенно разрушается, а на защищаемый металл поступают электроны с протектора; таким образом, он является положительным электродом (катодом) и тем самым защищен от коррозии. В качестве материалов протекторов чаще всего используют магний и его сплавы, реже алюминий и цинк. Это обусловлено тем, что Alи Zn в воде и грунтах склонны к пассивации – образованию на поверхности металла плотных оксидных пленок, нарушающих токоотдачу. Для предотвращения пассивации в засыпку вводят хлориды или другие вещества, растворяющие их, а также компоненты, увеличивающие сопротивление грунта, что способствует уменьшению скорости растворения протектора. Эффективность этого вида защиты определяется радиусом действия протектора, т.е. максимально возможным его удалением от защищаемого изделия. Чем выше электрическая проводимость среды, тем выше радиус защитного действия протектора. Протекторную защиту используют для борьбы с коррозией трубопроводов и металлоконструкций в воде, грунте и других нейтральных средах. Высокая скорость саморастворения протектора в кислотных средах ограничивает его применение в них. (−) А: Me (+) К: 2H2O + 2 Анодная защита. В основе данного способа лежит анодная поляризация: потенциал металла смещают в положительную сторону путем присоединения защищаемой конструкции к положительному полюсу внешнего источника постоянного тока, а вспомогательного электрода (катода) – к отрицательному. Анодная защита применяется только для тех металлов и сплавов, которые легко переходят в пассивное состояние при анодной поляризации, т.е. покрываются пассивной пленкой оксида (большинство переходных металлов и сплавов на их основе, включая нержавеющие и углеродистые стали), например: 2Cr + 3H2O Широко распространенные способы металлических покрытий занимают особое положение, так как их действие имеет двойственный характер. До тех пор, пока целостность слоя покрытия не нарушена, его защитное действие сводится к изоляции поверхности защищаемого металла от окружающей среды. Это не отличается от действия любого механического защитного слоя (окраска, оксидная пленка и т.д.). С другой стороны − при повреждении металлического покрытия проявляются его электрохимические свойства. В качестве металлических защитных покрытий могут быть использованы как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют наиболее положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Cu, Ni, Ag. При повреждении покрытия (или наличии пор) образуется коррозионный элемент, в котором основной металл служит анодом и растворяется: (−) А: Me а материал покрытия – катодом, на котором выделяется водород или поглощается кислород: (+) К: 2Н++ 2 (+) К: O2 + 2H2O + 4 Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия. Анодные покрытия имеют наиболее отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на поверхности железа. В этом случае основной металл (Fe) будет катодом коррозионного элемента. Местное повреждение защитного цинкового слоя ведет к дальнейшему его разрушению, при этом поверхность железа защищена от коррозии. На анодных участках происходит процесс окисления цинка: (−) А: Zn На катодных участках – восстановление водорода или кислорода в зависимости от характера среды: (+) К: 2Н+ + 2 (+) К: O2 + 2H2O + 4 Электродные потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, например покрытие железа оловом в растворе серной кислоты – катодное, а в растворе органических кислот – анодное. Эффективным методом повышения коррозионной стойкости металлов является легирование. Легирование применяется тогда, когда материал конструкции не позвляет использовать другие способы защиты. При легировании в состав сплава или металла вводят легирующие элементы (хром, никель, молибден и др.), вызывающие пассивность металла (процесс перехода металла или сплава в состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса). Легирующие компоненты, обладая высокой диффузионной способностью, вместе с основным металлом окисляются кислородом воздуха, образуя устойчивые оксидные пленки, препятствующие проникновению коррозионной среды. Широкое применение нашло легирование для защиты от газовой коррозии. Легированию подвергаются железо, алюминий, медь, магний, цинк, а также сплавы на их основе. Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К сплавам с повышенной коррозионной устойчивостью, например, относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы. Примеры решения типовых задач Пример 1. Олово спаяно с серебром. Укажите, какой из металлов будет окисляться при коррозии, если сплав находится в чистой влажной атмосфере (Н2О +О2)? Приведите схему образующегося гальванического элемента и вычислите его ЭДС для стандартных условий. Решение. Находим значения стандартных электродных потенциалов: Eо O2+2H2O / 4OH-=+0,4 B; Eо Sn2+ / Sn =−0,14 B; Eо Ag+/Ag =+0,8 B. Олово является более активным металлом и в образующейся гальванической паре будет анодом. Олово окисляется, а на катоде восстанавливается кислород. Следовательно, на электродах данного гальванического элемента происходят следующие процессы: (−) А: Sn (+) К (Sn, Cu): O2 + 2H2O + 4 Схема образующегося гальванического элемента:
(−) 2Sn/2Sn2+½H2O, O2½4OH-/2H2O+O2 (Ag) (+), ЭДС= Eо 2H2O+O2 / 4OH-− Eо Sn2+ / Sn =0,4−(−0,14)=+0,54 B. Пример 2. Приведите уравнения анодного и катодного процессов, происходящих при коррозии стали в кислой среде и влажной атмосфере (Н2О+О2). Решение. Сталь содержит карбид железа (Fe3C), являющийся основной примесью. Карбид железа менее активен, чем железо, поэтому анодом является железо, катодом – карбид железа. В кислой среде на аноде происходит процесс окисления железа, на катоде – восстановление ионов водорода: (−) А (Fe): Feо (+) К (Fe3C): 2H+ + 2 При атмосферной коррозии стали протекают следующие процессы: (−) А (Fe): Feо (+) К (Fe3C): O2 + 2H2O + 4 Пример 3. Предложите протектор для защиты изделия из алюминиевой бронзы от коррозии во влажной атмосфере. Приведите уравнения протекающих процессов. Решение. Алюминиевая бронза – это сплав меди с алюминием. Протектор, согласно принципу его действия, должен иметь наиболее отрицательное значение электродного потенциала, чем потенциал меди (Eо Cu2+ / Cu=+0,34 B) и алюминия (Eо Al3+ / Al=−1,662 B), например магний (Eо Mg2+ / Mg =−2,36 B). В образующемся гальваническом элементе Mg будет играть роль анода и разрушаться: (−) А: Mg На катоде (изделии) будет протекать процесс разрядки кислорода: (+) К: O2 + 2H2O + 4 Продуктом коррозии является Mg(OH)2.
|
||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 348; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.225.188 (0.011 с.) |

 =0,00 В), чем потенциал меди (
=0,00 В), чем потенциал меди ( =+0,34 В). Кроме того, водород, скопившийся на поверхности медного электрода, затрудняет дальнейшее протекание катодного процесса (2Н+ + 2
=+0,34 В). Кроме того, водород, скопившийся на поверхности медного электрода, затрудняет дальнейшее протекание катодного процесса (2Н+ + 2 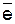
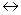 2Н2
2Н2 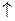 ). В результате этого при работе такого гальванического элемента разность потенциалов уменьшается по сравнению с первоначальной. Аналогичный процесс может происходить и при электрохимической коррозии металлов.
). В результате этого при работе такого гальванического элемента разность потенциалов уменьшается по сравнению с первоначальной. Аналогичный процесс может происходить и при электрохимической коррозии металлов.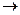 Fe(OH)2;
Fe(OH)2;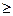 7).
7). 4
4 


