
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Концентрации твердых веществ не входят в выражение константы равновесия гетерогенной реакции. Например, выражение для константы равновесия следующей реакции СО2 (г) + С(тв) «2СО(г) записывается так:
Константа равновесия, выраженная через молярные концентрации реагирующих веществ
где Dn - изменение числа газообразных молей в реакции. Стандартное изменение энергии Гиббса равно
а также
После приравнивания правых частей уравнений
или
Уравнение (4.21) не только устанавливает вид зависимости константы от температуры, но и показывает, что константа определяется природой реагирующих веществ. Константа равновесия не зависит от концентраций реагентов (как и константа скорости реакции), механизма реакции, энергии активации, от присутствия катализаторов. Смена механизма, например, при введении катализатора, не влияет на численное значение константы равновесия, но может изменить скорость достижения равновесного состояния. 4.14.3. Смещение химического равновесия. Принцип Ле Шателье. Истинное химическое равновесие является динамическим и подвижным: изменение внешних условий (температуры, давления, концентраций реагирующих веществ) ведет к смещению равновесия в сторону прямой или обратной реакции. Характер влияния внешних факторов на равновесные системы выражает принцип Ле Шателье. Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону той реакции (прямой или обратной), которая ослабляет эффект внешнего воздействия. Изменение концентраций. Равновесное состояние в системе H2(г) + I2(г) ®2 HI(г) характеризуется (для одной и той же температуры) константой равновесия
Если, например, в систему добавить водород, т.е. увеличить его концентрацию, то скорость прямой реакции увеличится (в соответствии с законом действующих масс)
равновесие сместится вправо. Концентрация йодоводорода будет увеличиваться, а концентрация водорода и йода будет уменьшаться. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новые равновесные концентрации всех компонентов будут другими, но соотношение между ними, определяемое константой равновесия, останется постоянным. Если в систему ввести дополнительное количество йодоводорода, то скорость обратной реакции увеличится:
равновесие сместится влево. Удаление из системы продуктов (или продукта) реакции ведет к смещению равновесия в сторону прямой реакции, а уменьшение концентрации исходных (или исходного) веществ приводит к сдвигу равновесия в направлении обратной реакции. Изменение давления. Повышение давления (уменьшение общего объема) вызывает смещение равновесия в направлении уменьшения общего количества молей газообразных веществ, т.е. в направлении, приводящем к понижению давления. При уменьшении давления (увеличении общего объема) равновесие смещается в сторону увеличения количества молей газообразных веществ, т.е. в направлении, приводящем к возрастанию давления. Рассмотрим, в каком направлении сместится равновесие в системе CO(г) + Cl2(г) «COCl2(г), если при неизменной температуре увеличить давление путем уменьшения объема газовой смеси? В реакцию вступают 2 моля, а образуется 1 моль газообразных веществ. Прямая реакция при постоянном объеме сопровождается уменьшением давления. Если увеличить общее давление в системе, то согласно принципу Ле Шателье, равновесие сместится в сторону прямой реакции. Для реакций, протекающих без изменения числа молей газообразных веществ, изменение давления (или общего объема) не влияет на химическое равновесие и равновесный состав продуктов. Для реакции H2(г) + I2(г) «2 HI(г) количество молей газообразных веществ слева и справа от знака равновесия равно. При изменении давления скорости прямой и обратной реакций изменяются одинаково, а их отношение будет оставаться неизменным. Влияние температуры. Зависимость константы равновесия от температуры выражается уравнением
Для экзотермических процессов D Н о<0 при увеличении температуры значения Kp уменьшаются, что соответствует смещению равновесия в сторону обратной (эндотермической) реакции. Например, для реакции синтеза аммиака из азота и водорода N2(г) + 3H2(г) которая является экзотермической (D Н о<0), первое слагаемое в уравнении (4.22) будет положительным. С повышением температуры его абсолютная величина будет уменьшаться. Это приведет к уменьшению Kp независимо от знака ∆S о. Равновесие смещается в сторону обратного эндотермического процесса разложения аммиака. Для эндотермических процессов (D Н о>0) при увеличении температуры значения Kp увеличиваются, что соответствует смещению равновесия в сторону прямой (экзотермической) реакции. Например, в реакции N2O4 (г) «2 NO2 (г), D Н° =57,4 кДж (D Н о>0), т.е. прямая реакция – эндотермическая. Следовательно, первое слагаемое в уравнении (4.22) отрицательно. При увеличении температуры его абсолютная величина уменьшается и независимо от знака ∆Sо константа увеличивается. Равновесие смещается в сторону прямой реакции. Зная знак D Н о, можно сказать, в каком направлении будет изменяться константа равновесия при изменении температуры. Повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты и охлаждением системы, т.е. в сторону эндотермической реакции. При понижении температуры равновесие смещается в сторону экзотермической реакции. Примеры решения типовых задач Пример 1. Как изменится начальная скорость простой реакции образования NOСl2 2NO(г)+ Cl2(г) = 2NOCl2(г), если уменьшить объем газовой смеси в 2 раза? Решение. Скорость данной реакции равна Если обозначить концентрации NO и Cl2 до изменения объема, соответственно, через a и b, тогда В результате уменьшения объема в 2 раза концентрации NO и Cl2 увеличиваются в 2 раза, и скорость реакции станет равна
Тогда Пример 2. Скорость разложениявещества А описывается кинетическим уравнением первого порядка. Определите концентрацию вещества А через 100 с после начала реакции, если известно, что начальная концентрация его составляла 0,01 моль/л, а константа скорости равна 0,023 с-1. Решение. Используя интегральное кинетическое уравнение реакции первого порядка, имеем ln[ A ]t = ln[ A ]0 – kt; ln[ A ]t = ln0,01 – 0,023 × 100; ln[ A ]t = – 6,9; [ A ]t =0,001 моль/л. Пример 3. Определите энергию активации Е а реакции, для которой при повышении температуры от 22 до 32°C константа скорости возрастает в 2 раза. Решение. Запишем уравнение Аррениуса для двух температур в виде
В результате вычитания первого уравнения из второго, получим
Следовательно:
Отношение k 2 / k 1=2 по условию. Переводим температуру в Кельвины и подставляем значения в уравнение
Пример 4. Энергия активации некоторой реакции при отсутствии катализатора равна 75 кДж/моль, а с катализатором 50 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 25°C? Решение. Обозначим энергию активации реакции без катализатора через
В результате вычитания первого уравнения из второго
Подставляя в последнее уравнение данные задачи, выражая энергию активации в Джоулях и учитывая, что Т =298К, получим
Таким образом, в присутствии катализатора скорость реакции возрастет в 24 тысячи раз. Пример 5. Константа равновесия реакции А+В«C+D равна единице. Исходные концентрации: [ А ]0 = 0,01моль / л, [ В ]0 = 0,03 моль / л. Определите равновесные концентрации всех четырех веществ. Решение. 1. Из уравнения реакции видно, что из каждого моля А и В образуется по одному молю С и D. Принимаем, что в ходе реакции к моменту достижения равновесия прореагировало x моль/л вещества А. Если прореагирует х молей А, то должно прореагировать также х молей В, в то же время должно образоваться по х молей С и D. 2. Определяем равновесные концентрации веществ. При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций исходных веществ и увеличение концентраций продуктов реакции. Поэтому концентрации веществ при равновесии будут: [ A ]=0,01 – x, [ B ]=0,03 – x, [ C ]=[ D ]=x. 3. Запишем выражение закона действующих масс. Подставляем в него найденные значения равновесных концентраций.
4. Решаем уравнение. При этом учитываем, что отрицательный корень не имеет физического смысла и убыль концентрации исходного вещества не может быть больше величины самой концентрации: х =0,0075 моль / л. 5. Находим равновесные концентрации. [ А ]=[ А ]0– x =0,01–0,0075=0,0025 моль / л; [ B ]=[ B ]0– x =0,03–0,0075=0,0225 моль / л; [ C ]= x =0,0075 моль / л; [ D ]= x =0,0075 моль / л. Пример 6. В системе А(г)+В(г)«2С(г) равновесные концентрации равны: [ А ] = 0,018 моль / л, [ В ] = 0,011 моль / л, [ С ] = 0,016 моль / л. Определите константу равновесия реакции и исходные концентрации веществ А и В. Решение. Константа равновесия данной реакции выражается уравнением:
Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, из 1 моля А и 1 моля В образуется 2 моля С. Поскольку по условию задачи в каждом литре системы образовывалось 0,016 моля вещества С, то при этом было израсходовано 0,008 моля вещества А и 0,008 моля вещества В. Таким образом, исходные концентрации равны: [ А ]0 = 0,018+0,008 = 0,026 моль / л; [ В ]0 = 0,011+0,008 = 0,019 моль / л. Пример 7. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению PCl5 (г) «PCl3 (г) + Cl2 (г); D Н =+92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрации реагирующих веществ, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5? Решение. В соответствии с принципом Ле Шателье, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону той реакции (прямой или обратной), которая ослабляет эффект внешнего воздействия. 1. Смещение равновесия при изменении температуры связано с тепловым эффектом реакции. Так как рассматриваемая реакция эндотермическая (D Н о>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру. 2. Так как в данной реакции разложение PCl5 ведет к увеличению объёма (из одного моля газа образуются два), то для смещения равновесия в сторону прямой реакции надо уменьшить давление. 3. Чтобы сместить равновесие в сторону прямой реакции, необходимо увеличить концентрацию PCl5. 5. РАСТВОРЫ Растворами называются гомогенные (однородные) системы, состоящие из двух или более компонентов, относительные количества которых могут изменяться. Наиболее распространенный вид растворов – жидкие растворы. Любой раствор состоит из растворенного вещества и растворителя, т.е. среды, в которой это вещество равномерно распределено в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворитель – вода, а растворенное вещество – соль. Если оба компонента до растворения находились в одинаковом агрегатном состоянии, то растворителем считается компонент, находящийся в большем количестве (пример – смесь воды и спирта). Растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Непостоянство состава раствора приближает их к механическим смесям, однако от последних они отличаются своей однородностью. Отличие растворов от чистых веществ состоит в том, что индивидуальные вещества имеют определенные физические константы, например, температуры плавления и кипения, определенный химический состав, в то время как физические константы и состав растворов зависят от соотношения их компонентов. Например, плотность раствора соли в воде растет, а температура замерзания понижается с увеличением содержания соли. Чистые вещества при изменении их агрегатного состояния не изменяют своего химического состава, а при возвращении в исходное агрегатное состояние приобретают исходные характеристики. Согласно гидратной теории Д.И. Менделеева, при образовании раствора частицы растворенного вещества вступают во взаимодействие с молекулами растворителя, образуя малоустойчивые соединения, называемые сольватами (или гидратами в случае водных растворов). В зависимости от природы растворенного вещества гидраты образуются за счет ион-дипольного взаимодействия (растворы веществ с ионной структурой, например, солей и полярных молекул; например, HCl) и диполь-дипольного взаимодействия (растворы веществ с молекулярной структурой, например, спиртов). Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. Соответственно образование этих растворов не сопровождается тепловым эффектом (ΔН=0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества. Тепловой эффект растворения Процесс образования раствора – растворение – заключается в разрушении взаимодействия между молекулами индивидуальных веществ и образовании новых межмолекулярных связей между компонентами раствора. Количество теплоты, поглощающейся или выделяющейся при растворении одного моля вещества в избытке растворителя, называется теплотой растворения этого вещества. Образование раствора – процесс самопроизвольный, сопровождающийся уменьшением свободной энергии Гиббса (D G ораст):
Знак изменения энтропии растворения (D S ораст) зависит от степени изменения порядка в системе до и после растворения. При растворении газов в жидкости энтропия системы уменьшается, а энтальпия увеличивается, поэтому растворение газов понижается при повышении температуры. Знак изменения энтальпии системы при растворении (D Н ораст) определяется суммой тепловых эффектов всех процессов, сопровождающих растворение. При растворении твердого вещества разрушается его кристаллическая решетка и частицы вещества равномерно распределяются по всему объему раствора. Этот процесс требует затраты энергии, следовательно, D Н окр > 0. Одновременно протекает процесс взаимодействия частиц растворенного вещества с водой с образованием гидратов, сопровождающийся выделением теплоты (D Н огидр< 0). Общий тепловой эффект растворения твердого вещества (D Н ораст) определяется соотношением тепловых эффектов этих процессов и может быть как положительным, так и отрицательным, либо равным нулю, как при растворении сахара в воде. Растворение жидкостей и газов в большинстве случаев сопровождается выделением небольшого количества теплоты и, согласно принципу Ле Шателье, с понижением температуры их растворимость уменьшается. Растворимость При приготовлении раствора какого-либо вещества молекулы растворяемого вещества непрерывно переходят в раствор и благодаря диффузии равномерно распределяются по всему объему растворителя. Перешедшие в раствор молекулы растворенного вещества, ударяясь о поверхность еще не растворившегося вещества, снова входят в его состав. По мере возрастания концентрации раствора увеличивается скорость образования твердого вещества. При равенстве скоростей этих процессов в системе устанавливается равновесие (D G ораст=0): вещество нерастворенное «вещество в растворе, при этом число молекул растворенного вещества, поступающих в раствор и уходящих из него в единицу времени становится равным. Раствор максимальной концентрации, который при данной температуре может неопределенно долго находиться в равновесии с избытком растворяемого вещества,называется насыщенным. Концентрация насыщенного раствора называется растворимостью. Растворимость выражается количеством граммов растворенного вещества, содержащихся в 100 граммах растворителя, либо количеством молей растворенного вещества, содержащихся в 1 литре раствора. Раствор, концентрация которого при данной температуре меньше насыщенного, называется ненасыщенным. Растворимость твердых веществ (например, солей), как правило, с понижением температурыуменьшается. Если медленно охлаждать насыщенный раствор, то можно получить пересыщенный раствор, т.е. раствор, концентрация которого больше растворимости вещества при данной температуре. Пересыщенные растворы неустойчивы (D G ораст>0) и самопроизвольно или при внешнем воздействии (встряхивание, внесение кристаллов) переходят в состояние равновесия (D G ораст=0). При этом избыток растворенного вещества выпадает в осадок. Концентрация растворов Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном количестве или в определенном объеме раствора или растворителя. В химии наиболее употребимы следующие способы выражения концентрации. Процентная концентрация. Показывает число граммов растворенного вещества, содержащихся в 100 г раствора. Например, 15%-ный водный раствор соли – это такой раствор, в 100 г которого содержится 15 г соли и 85 г воды. Молярная концентрация (молярность). Показывает число молей растворенного вещества, содержащихся в 1 л раствора, обозначается моль/л или формулой вещества, заключенной в квадратные скобки. Например, [NaOH]=2 моль/л – это раствор, содержащий 2 моля (или 80 г) гидроксида натрия в одном литре раствора. Молярная концентрация эквивалентов. Показывает число молей эквивалентов растворенного вещества, содержащихся в 1 л раствора, обозначается С эк. Например, С эк H2SO4=0,1моль экв/л – это раствор Н2SO4 , содержащий 0,1 моля эквивалентов серной кислоты (или 4,9 г) в 1 л раствора. Эквивалентом (обозначается буквой Э) называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалент кислоты равен молярной массе кислоты, деленной на ее основность, т.е. на число атомов водорода в молекуле кислоты, способных замещаться на металл. Эквивалент основания равен молярной массе основания, деленной на валентность металла. Эквивалент оксида равен молярной массе оксида, деленной на произведение числа атомов элемента, входящих в состав молекулы, и валентности этого элемента. Эквивалент соли равен молярной массе соли, деленной на произведение валентности металла и числа атомов металла в ее молекуле. Например: моль экв. Н2SO4 (М=98 г/моль) равен моль экв. Са(ОН)2 (М=74 г/моль) равен моль экв. Al2O3 (М=102 г/моль) равен моль экв. Al2(SO4)3 (М=342 г/моль) равен Растворы с молярной концентрацией эквивалентов широко применяются при проведении реакций между растворенными веществами. Пользуясь этой концентрацией, легко заранее рассчитать, в каких объемных соотношениях должны быть смешаны растворенные вещества, для того чтобы они прореагировали без остатка. Согласно закону эквивалентов количества веществ, вступающих в реакцию, пропорциональны их эквивалентам:
Следовательно, для реакции всегда нужно брать такие объемы растворов, которые содержали бы одинаковое число молей эквивалентов растворенных веществ. При одинаковой молярной концентрации растворов объемы реагирующих веществ пропорциональны их С эк. Если объемы затрачиваемых на реакцию растворов обозначить через V 1 и V 2 , а их молярные концентрации эквивалентов через С эк.1 и С эк.2, то зависимость между этими величинами выразится отношением:
т.е. объемы реагирующих веществ обратно пропорциональны молярным концентрациям их эквивалентов. На основании этих зависимостей можно не только вычислить необходимые для проведения реакций объемы растворов, но и по объемам затраченных на реакцию растворов находить их концентрации. Титр. Показывает количество граммов растворенного вещества, содержащееся в 1 мл раствора. Обозначается буквой Т. Зная титр раствора, легко вычислить его молярную концентрацию эквивалента, и наоборот:
Моляльная концентрация (моляльность). Показывает число молей растворенного вещества, содержащееся в 1000 г растворителя, обозначается С m:
где m – количество растворенного вещества, Законы Рауля Каждой жидкости при данной температуре соответствует определенное давление насыщенного пара р0. С повышением температуры р0 увеличивается. При растворении в жидкости какого-либо нелетучего вещества давление насыщенного пара растворителя над раствором становится ниже, чем над чистым растворителем при той же температуре. Причем понижение давления пропорционально концентрации раствора. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества (закон Рауля):
где p 0– давление насыщенного пара над чистым растворителем; p – давление насыщенного пара растворителя над раствором; N – мольная доля растворенного вещества; n1 – число молей растворенного вещества; n2 – число молей растворителя. Мольная доля (Ni) равна отношению числа молей данного вещества (ni) к сумме числа молей всех веществ (включая растворитель) в растворе:
Понижение давления насыщенного пара растворителя над раствором нелетучего вещества приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем. Согласно закону Рауля, давление водяного пара над водным раствором ниже, чем над водой. Температура кипения жидкости Т кип – это температура, при которой давление насыщенного пара ее достигает атмосферного давления; для воды это 100°С (при давлении 101,3 кПа или 1,013∙105 Н/м2). Так как над раствором давление насыщенного пара растворителя ниже, то для того чтобы раствор закипел, его надо нагреть до более высокой температуры, чем чистый растворитель. Следствия закона Рауля 1. Понижение температуры замерзания DТзам и повышение температуры кипения DТкип раствора неэлектролита прямо пропорциональны количеству вещества, растворенному в данном количестве растворителя. 2. Эквимолярные (т.е. содержащие одно и то же число молей эквивалентов вещества) количества растворенных веществ, будучи растворены в одном и том же количестве данного растворителя, одинаково понижают температуру его замерзания и одинаково повышают температуру его кипения. Понижение температуры замерзания, вызываемое растворением одного моля вещества в 1000 г растворителя, есть величина постоянная для данного растворителя. Она называется криоскопической константой K к растворителя. Точно так же и повышение температуры кипения, вызываемое растворением одного моля вещества в 1000 г растворителя, называется эбулиоскопической константой K э растворителя. Криоскопическая и эбулиоскопическая константы зависят только от природы растворителя. Понижение температуры замерзания и повышение температуры кипения разбавленных растворов неэлектролитов пропорционально их моляльной концентрации:
Приведенные формулы позволяют рассчитывать составы антифризов – растворов, не замерзающих до определенной температуры. Исходя из приведенных соотношений очевидно, что при растворении в 1000 г данного растворителя 1 грамм-моля какого-либо неэлектролита D Т зам и D Т кип раствора будут одинаковыми независимо от природы растворенного вещества и равны:
Приведенные формулы (5.5, 5.6) дают возможность не только определять температуры кипения и замерзания растворов неэлектролитов по их концентрациям, а также рассчитывать молекулярную массу растворенного вещества по температуре кипения или замерзания его растворов:
Примеры решения типовых задач Пример 1. Рассчитайте титр (г/мл), молярную (моль/л) и молярную концентрацию эквивалентов (моль экв/л) 17,5%-ного раствора серной кислоты, плотность которого r=1,12 г/см3. Решение. 1. Определяем весовое количество серной кислоты, содержащееся в 1 л 17,5 %-ного раствора а) находим массу 1 литра (1000 мл) раствора:
б) рассчитываем весовое количество серной кислоты, содержащееся в 1120 г раствора: в 100 г раствора содержится 17,5 г H2SO4; в 1120 г раствора – х г H2SO4,
2. Определяем титр раствора; для этого необходимо весовое количество кислоты, содержащееся в известном объеме раствора, разделить на объем раствора, выраженный в миллилитрах:
3. Рассчитываем молярную концентрацию раствора; для этого необходимо весовое количество кислоты, содержащееся в 1 л раствора, разделить на молярную массу (M H2SO4), 98 г/моль:
4. Находим молярную концентрацию эквивалентов раствора H2SO4; для этого необходимо весовое количество кислоты, содержащееся в 1 л раствора (196 г), разделить на эквивалентную массу (Э H2SO4). Эквивалентная масса H2SO4 равна ее молярной массе, деленной на количество атомов водорода:
Следовательно: Молярную концентрацию эквивалентов также можно рассчитать, используя титр (Т) и эквивалентную массу (Э):
Ответ: Т =0,196 г/мл; [H2SO4]=2 моль/л; C эк=4 моль экв/л. Пример 2. Рассчитайте, сколько миллилитров 96%-ного раствора H2SO4 (r=1,84 г/см3) потребуется для приготовления 1л ее раствора с молярной концентрацией, равной 0,5 моль/л. Решение. 1. Рассчитываем весовое количество H2SO4, необходимое для приготовления 1 л раствора с молярной концентрацией, равной 0,5 моль/л (молярная масса серной кислоты равна 98 г/моль): в 1000 мл 0,5 молярного раствора содержится 98∙0,5=49 г Н2SO4. 2. Определяем весовое количество исходного (96%) раствора, содержащего 49 г Н2SO4: в 100 г раствора содержится 96 г H2SO4, в х г раствора – 49 г Н2SO4.
3. Находим необходимый объем исходного раствора, разделив весовое количество раствора на его плотность (r):
Ответ: для приготовления 1 л раствора серной кислоты с молярной концентрацией 0,5 моль/л необходимо 27,74 мл 96%-го раствора Н2SO4. Пример 3. Рассчитайте, сколько граммов этилового спирта (С2Н5ОН) и воды необходимо взять для приготовления 1000 граммов раствора, незамерзающего до –30оС? Криоскопическая константа воды K к равна 1,86кг Решение. 1. Используя следствие из закона Рауля
находим отношение
Молярная масса С2Н5ОН равна 46 г/моль. Учитывая, что
определяем количество этилового спирта, исходя из соотношения Количество воды, необходимое для приготовления раствора равно: g =1000–425,3=574,7 г. Ответ: m =425,5 г, g =574,5 г.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 1390; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.011 с.) |


 .
. , и константа равновесия, выраженная через равновесные парциальные давления
, и константа равновесия, выраженная через равновесные парциальные давления  (см. «Основы химической термодинамики»), связаны между собой соотношениями
(см. «Основы химической термодинамики»), связаны между собой соотношениями


 ,
, .
.
 .
.
 .
. =
= 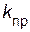 [H2] [I2],
[H2] [I2], 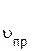 >
>  ,
, [HI] 2,
[HI] 2,  ,
,
 2NH3(г),
2NH3(г), = k [NO]2[Cl2 ].
= k [NO]2[Cl2 ]. */
*/  ,
, .
. .
. .
. .
. , а с катализатором – через
, а с катализатором – через  ; соответствующие константы скорости реакции обозначим через
; соответствующие константы скорости реакции обозначим через  и
и  . Предположим, что величина А для данной реакции постоянна и не зависит от присутствия катализатора. Используя уравнение Аррениуса, находим
. Предположим, что величина А для данной реакции постоянна и не зависит от присутствия катализатора. Используя уравнение Аррениуса, находим ,
, .
.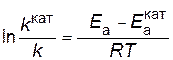 .
.
 .
. .
.


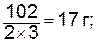

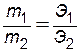 .
.
 ,
,


 ,
,
 – количество растворителя, г; M – мольная масса растворенного вещества, г/моль.
– количество растворителя, г; M – мольная масса растворенного вещества, г/моль.
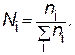


















 К
К 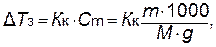


 m =425,3 г.
m =425,3 г.


