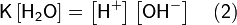Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности кинетики гетерогенных химических реакцийСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Химические реакции, протекающие на границе раздела двух фаз, называют гетерогенными. Гетерогенные процессы широко распространены в природе и часто используются в практике. Примерами могут служить процессы растворения, кристаллизации, испарения, конденсации, химические реакции на границе раздела двух фаз, гетерогенный катализ и др. 32. Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами). КАТАЛИЗАТОРЫ, в-ва, изменяющие скорость хим. р-ции или вызывающие ее, но не входящие в состав продуктов,длительное время не изменяющиеся АКТИВАТОРЫ-вещества,ускоряющие процесс и разходующиеся вместе с исходными веществами. Ингибиторы-вещества,замедляющие процесс и неизменяющиеся длительное время. 33. 3-й закон — третье начало термодинамики: Теорема Нернста: Энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю.
Теорема Нернста утверждает, что всякий термодинамический процесс, протекающий при фиксированной температуре Существует несколько формулировок теоремы, которые эквивалентны между собой: [1] · Энтропия · При приближении к абсолютному нулю, · При приближении к абсолютному нулю, · Все процессы при абсолютном нуле,
34. Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. "Гомогенный" - значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов.[1]. Раствор — однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.(истинные,коллоидные,молекулярные) Первый закон Рауля Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом: · Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку: · Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
Второй закон Рауля · Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
· Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
35. Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.осмос-миграция растворителя через полупроницаемую прегородку. «Любое равновесие между двумя различными состояниями вещества (системами) смещается при понижения температуры в сторону той из систем, при образовании которой происходит выделение тепла» (Принцип подвижного равновесия)». 36. Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Закон масс: Растворимость малорастворимой соли в кислоте тем больше, чем меньше константа электролитической диссоциации кислоты, анионы которой входят в состав данной соли. Другими словами, чем больше растворимость данного электролита в воде и чем слабее кислота, образующая его, тем больше этот электролит растворяется в кислоте. Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная. При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
Константа этого равновесия рассчитывается по уравнению:
37. Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Введение, правило Бертолле Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена. В соответствии с правилом Бертолле: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), малодиссоциирующее соединение (очень слабыйэлектролит, в том числе и вода) или комплексное соединение. В таких случаях реакции будут практически не обратимы. Изображение реакций ионного обмена Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами. Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O 2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O CO32- + 2H+ → CO2↑ + H2O
38) Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m: w(B)= m(B) / m
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора. C(B) = n(B) / V = m(B) / (M(B) · V), где М(B) - молярная масса растворенного вещества г/моль.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд
39) Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Степень гидролиза тем выше, чем слабее кислота или основание, её образовавшие. Является количественной характеристикой гидролиза.
Константа гидролиза – это константа равновесия гидролитической реакции. Для соли, образованной слабой кислотой и сильным основанием:
Для соли, образованной сильной кислотой и слабым основанием:
Для соли, образованной слабой кислотой и слабым основанием:
При степени диссоциации существенно меньше 1:
Ступенчатому гидролизу подвергаются соли, образованные: многоосновной слабой кислотой, многоосновным слабым гидроксидом, тем и другим одновременно.
Если соль содержит однозарядный катион (анион) и многозарядный анион (катион), то возможен ступенчатый гидролиз. Образующиеся в результате гидролиза по первой ступени по аниону кислые соли могут подвергаться дальнейшему взаимодействию с водой. Однако вторая и последующая ступени гидролиза выражены менее сильно. Это обусловлено изменением величин констант диссоциации соответствующих электролитов. Например, поскольку ион диссоциирует слабее, чем Н2СО3, то он образуется, в первую очередь, при гидролизе карбоната натрия (Na2CO3): I ступень: Na2CO3 + Н2О? NaНСО3 + NaOH, II ступень: NaНСО3+ Н2О? NaOH + H2CO3. Гидролиз солей слабых многоосновных кислот по второй и третьей ступеням протекает мало и содержание в растворе продуктов гидролиза по этим ступеням незначительно и их можно не учитывать в расчетах.
40) РАСТВОРЫ ЭЛЕКТРОЛИТОВ, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов. Сильные и слабые электролиты. В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами. К сильным электролитам относятся почти все соли, некоторые кислоты (НСl, HBr, HI, НNО3, НсlO4, Н2SO4(разб.)) и некоторые основания (LiОН, NaOH, КОН, Са(ОН)2, Sr(OH)2, Ва(ОН)2). К слабым электролитам относится большинство кислот (особенно органических) и оснований. Степенью диссоциации а называется отношение числа молекул, распавшихся на ионы (n'), к общему числу растворенных молекул (п): Константа диссоциации. Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
A K «A- + K+.
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакции применим закон действующих масс, и можно определить константу равновесия как
где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита. Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
41) Еще одно свойство воды, играющее важную роль в гидрохимии аквариума, — электролитическая диссоциация, т. е. распад молекул на заряженные частицы называемые ионами. При распаде одной молекулы воды образуется два иона; катион (положительно заряженный ион) водорода и анион (отрицательно заряженный ион) гидроксид: H2O = H+ + OH− Данный процесс является обратимым, т. е. протекает как в прямом, так и в обратном направлениях. В результате этого обратимого процесса устанавливается равновесное состояние. При равновесии число молекул, распадающихся на ионы, равно числу молекул, образующихся из ионов. Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
где: [H+] — концентрация ионов гидроксония (протонов); [OH−] — концентрация гидроксид-ионов; [H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр:
42)) Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. 1. Гидролиз солей, образованных катионами слабых гидроксидов и анионами сильных кислот. Гидролиз такого типа солей называют г и д р о л и з о м п о к а т и о н у, так как только катионы соли взаимодействуют с OH- - ионами воды. Рассмотрим гидролиз нитрата аммония NН4NО3, образованного катионом слабого гидроксида NН4ОН и анионом сильной кислоты НNО3. Гидролиз идет по катиону, так как NH4+ (катионы слабого гидроксида) будут связывать OH- -ионы воды с образованием слабого электролита гидроксида аммония NH40H: в сокращенной ионной форме: NH4+ + НОН ↔ NН4ОН + Н+ 2. Гидролиз солей, образованных катионами сильных гидроксидов и анионами слабых кислот. Гидролиз этого типа солей называют гидролизом по аниону, так как только анионы соли взаимодействуют с катионами Н+ воды.
Гидролиз, например, ацетата натрия СНзСООNа, образованного катионом сильного гидр оксида NаОН и анионом слабой уксусной кислоты СНзСООН, идет по аниону, так как СНзСОО- ион будет Связывать катион Н+ воды с образованием' слабой' уксусной кислоты СНзСООН:. СНзСОО-+ НОН ↔ СНзСООН + ОН- СНзСОО- + Na+ + НОН ↔ СНзСООН + Na+ + ОН- CH3COONa + Н2О ↔ СНзСООН + NaOH В результате гидролиза в растворе накапливаются ОН- - ионы, поэтому раствор соли СНзСООNа имеет кислую среду. 3. Гидролиз солей, образованных катионами слабых гидроксидов и анионами слабых кислот. Для солей такого типа характерен гидролиз одновременно по катиону и аниону (комбинированный гидролиз). Водные растворы такого типа солей в зависимости от степени диссоциации продуктов гидролиза имеют нейтральную, слабокислую или слабощелочную среду. Если преобладает содержание ОН-ионов, то среда слабощелочная, если катионов Н+ - слабокислая и при равном их содержании - нейтральная. Рассмотрим гидролиз ацетата аммония СНзСООNН4, образованного катионом слабого гидроксида NH3· Н2О и анионом слабой кислоты СНзСООН: СНзСОО- + NH4+ + НОН ↔ СНзСООН + NНз· Н2О СНзСООNН4 + Н2О ↔ СНзСООН + NH3· Н2О В результате гидролиза ацетата аммония образуется уксусная кислота и гидрат аммиака, степени диссоциации которых почти одинаковы. Среда раствора соли СНзСООNН4 нейтральная
43) Рассмотрим наиболее типичные случаи гидролиза солей. 1. Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону). NH4Cl+HOH<—>NH4OH+HCl NH4+ +Cl-+HOH<—>NH4OH+H++ Cl- NH4+ +HOH<—>NH4OH+H+ В растворе накапливаются ионы H+, в результате чего реакция смещается в кислую сторону, рН в растворах солей подобного типа меньше7. 2. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону). CH3COONa+HOH<—>CH3COOH+NaOH CH3COO-+Na++HOH<—>CH3COOH+Na++OH- CH3COO-+HOH<—>CH3COOH+OH- В данном случае гидролиз ведет к увеличению концентраций ионов в растворе, среда щелочная, рН>7.
Соль образованна слабым многокислотным основанием и слабой многоосновной кислотой) Если продукты гидролиза выводятся из сферы реакции (в виде осадка или газа), то процесс может протекать до конца: Al2S3 + 6 H2O = 2 Al(OH)3 + 3 H2S ионно-молекулярное уравнение: 2 Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3 H2S В этом случае гидролиз протекает необратимо. Полностью гидролизуются соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)). Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основной карбонат меди (CuOH)2CO3. Бинарные соединения: нитриды, фосфиды, карбиды, ацетилениды, бориды:
Na3P + H2O = NaOH + PH3 Na4C + H2O = NaOH + CH4 CaC2 + H2O = Ca(OH)2 + C2H2
44) Зависимость степени гидролиза от концентрации выражается в том, что с разбавлением степень гидролиза увеличивается. Бели разбавить раствор, то концентрации соли и продуктов гидролиза изменяются, нарушается равновесие. Для восстановления нарушенного равновесия некоторое количество соли должно дополнительно гидролизоваться. Влияние температуры на степень гидролиза также объясняется принципом Ле-Шателье. Гидролиз протекает с поглощением тепла и, как для каждой экзотермической реакции, с повышением температуры равновесие реакции гидролиза сдвигается вправо, т. е. с повышением температуры степень гидролиза возрастает. Соль образованна слабым многокислотным основанием и слабой многоосновной кислотой) Если продукты гидролиза выводятся из сферы реакции (в виде осадка или газа), то процесс может протекать до конца: Al2S3 + 6 H2O = 2 Al(OH)3 + 3 H2S ионно-молекулярное уравнение: 2 Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3 H2S В этом случае гидролиз протекает необратимо. Полностью гидролизуются соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)). Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основной карбонат меди (CuOH)2CO3. Бинарные соединения: нитриды, фосфиды, карбиды, ацетилениды, бориды:
45) В составе комплексных соединений выделяют внутреннюю сферу, включающую атом или ион комплексообразователя, вокруг которого находятся связанные с ним лиганды.
Внешнюю сферу комплексных соединений образуют ионы, непосредственно связанные с комплексообразователем. Эти ионы удерживаются около внутренней сферы за счет сил электростатического взаимодействия.
Типичными комплексообразователями являются: атомы или ионы d-элементов, имеющие свободные орбитали (Cu+, Cu2+, Zn2+, Ni2+, Co3+, Fe2+, Fe3+, Mn2+, Pt2+ и др.).
Лиганды – атомы, ионы, молекулы, имеющие избыток электронов или неподелённые электронные пары. Ими могут быть кислотные остатки (SO42-, Cl-, NO3-), гидроксогруппы (OH-) и нейтральные молекулы (H2O:,:NH3, CO). Лиганды – доноры электронов. В номенклатуре комплексных соединений учитывается знак заряда комплексного иона. По этому признаку различают:
Катионные комплексы [Cu2+(H2O)4]2+ - тетрааквамедь (II) Анионные комплексы [Fe3+(CN)6]3- - гексацианоферрат (III) Нейтральные комплексы [Zn2+(OH)2(H2O)(NH3)] – аминоаквадигидроксоцинк
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион. 2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил. 3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д. 4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя. 5) После обозначения состава внутренней сферы называют внешнюю сферу. 6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Координационное число показывает число мест во внутренней сфере комплексного соединения или число мест вокруг комплексообразователя, на которых могут разместиться лиганды. Координационные числа разных комплексообразователей имеют значения от 2 до 12. Чаще других встречаются комплексные соединения с координационным числом, равным 4 или 6, затем 8 или 2.
Координационная емкость лиганда — число мест, занимаемых каждым лигандом во внутренней сфере комплекса. Лиганды, которые занимают одно координационное место у центрального атома, называют монодентатными. Однако лиганды могут занимать два и более (до восьми) координационных мест за счет образования с комплексообразователем соответствующего числа химических связей. Такие лиганды называются полидентатными. Одним из наиболее важных полидентатных лигандов (гексаден-татным) является анион этилендиаминтетрауксусной кислоты:
46) В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная. В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму (как следствие – с изменением формальных зарядов). В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью. Основные положения ТКП:
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 628; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |


 в сколь угодно близкой к нулю,
в сколь угодно близкой к нулю,  , не должен сопровождаться изменением энтропии
, не должен сопровождаться изменением энтропии  , то есть изотерма
, то есть изотерма 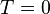 совпадает с предельной адиабатой
совпадает с предельной адиабатой  .
. , энтропия S стремится к определенному конечному пределу
, энтропия S стремится к определенному конечному пределу  не зависит от конкретных значений термодинамических параметров состояния системы и стремится к вполне определенному конечному пределу.
не зависит от конкретных значений термодинамических параметров состояния системы и стремится к вполне определенному конечному пределу.
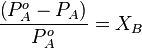




 , а – константа диссоциации слабой кислоты, образующейся при гидролизе.
, а – константа диссоциации слабой кислоты, образующейся при гидролизе. , b – константа диссоциации слабого основания, образующегося при гидролизе
, b – константа диссоциации слабого основания, образующегося при гидролизе
 , где С – концентрация соли, моль/л
, где С – концентрация соли, моль/л