
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скоростью химической реакции называется изменение концентрации реагента или продукта в единицу времени.Содержание книги
Поиск на нашем сайте
Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
Чем выше концентрация, тем больше скорость реакции, Эта зависимость выражается законом действующих масс. Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. По числу молекул, принимающих участие в элементарном акте химического превращения, различают реакции моно (одно), би (2) тримолекулярные реакции. Вероятность соударения одновременно большего числа частиц очень мала; поэтому тримолекулярные реакции очень редки, а 4х неизвестны.
Сумма показателей степеней в кинетических уравнениях называется порядком реакции. Порядок реакции определяет характер зависимости V от С. 29.
Влияние давления Скорость реакции зависит от числа столкновений молекул реагирующих веществ, а число столкновений зависит в свою очередь от числа молекул в единице объема, то есть от концентрации. С увеличением давления объем вещества уменьшается, и молекулы теснее располагаются в единице объема, то есть увеличение давление равнозначно увеличению концентрации. Особенно значителен этот эффект у газов. Жидкости и тем более твердые вещества малосжимаемы и эффект давления проявляется только в области сверхдавлений (1000 атм и выше). В случае газофазных реакций концентрации реагентов в законе действующих масс можно заменить их парциальными давлениями. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C).Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
Уравнение, которое описывает это правило, следующее:
где Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Уравнение Аррениуса Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
где k — константа скорости реакции,
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea. 30. Сложные реакции Сложными называют химические реакции, протекающие более чем в одну стадию. Рассмотрим в качестве примера одну из сложных реакций, кинетика и механизм которой хорошо изучены: 2НI + Н2О2 ––> I2 + 2Н2О Данная реакция является реакцией второго порядка; её кинетическое уравнение имеет следующий вид:
Изучение механизма реакции показало, что она является двухстадийной (протекает в две стадии): 1) НI + Н2О2 ––> НIО + Н2О 2) НIО + НI ––> I2 + Н2О Скорость первой стадии V1 много больше скорости второй стадии V2 и общая скорость реакции определяется скоростью более медленной стадии, называемой поэтому скоростьопределяющей или лимитирующей. Сделать вывод о том, является реакция элементарной или сложной, можно на основании результатов изучения её кинетики. Реакция является сложной, если экспериментально определенные частные порядки реакции не совпадают с коэффициентами при исходных веществах в стехиометрическом уравнении реакции; частные порядки сложной реакции могут быть дробными либо отрицательными, в кинетическое уравнение сложной реакции могут входить концентрации не только исходных веществ, но и продуктов реакции.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 364; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.01 с.) |










 Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
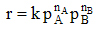

 — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре 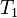 ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов). ,
, — фактор частоты для реакции,
— фактор частоты для реакции,  — универсальная газовая постоянная,
— универсальная газовая постоянная,  — температура в кельвинах.
— температура в кельвинах. (II.28)
(II.28)


