Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие о скорости и механизме химических реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химические реакции можно подразделять на два вида: гомогенные и гетерогенные. Гомогенные реакции протекают в одной фазе, например N2 + 3 H2 Гетерогенныереакции протекают на границе раздела двух фаз, например С (т) + O2 (г) → CO2 (г). Средняя скорость гомогенной реакции (υ) равна изменению концентрации вещества в единицу времени:
где [A]0 и [A] — исходная и конечная концентрация вещества, моль/л, τ — время реакции, с. или мин., знак (+) свидетельствует, что вещество образуется, знак (–) свидетельствует, что вещество расходуется. На рисунке 20 представлены кинетические кривые химической реакции, показывающие, что следить за ходом процесса можно как по изменению концентрации реагента (кривая а), так и по изменению концентрации продукта (кривая б).
Рисунок 20. — Кинетические кривые химических реакций
Скорость гетерогенной реакции равна изменению количества вещества в единицу времени на единице площади поверхности раздела фаз:
гдеν0 и ν — количество вещества в начальный и конечный момент времени, моль; S – площадь поверхности раздела фаз, м2. Большинство биохимических реакций являются гомогенными. Они протекают в организме человека с различной скоростью. Например, химические реакции, лежащие в основе передачи нервного импульса, протекают практически мгновенно. Полное обновление костной ткани осуществляется за 4-7 лет. Время обновления белков на половину составляет около 70 дней. На скорость химических реакций влияет: а) природа реагирующих веществ, б) их агрегатное состояние, в) природа растворителя (если реакция протекает в растворе), г) площадь поверхности реагирующих веществ (для гетерогенных реакций), д) концентрация реагирующих веществ, е) давление (для газофазных реакций), ж) температура, з) катализатор. Чтобы произошла химическая реакция, необходимо взаимодействие между молекулами веществ, вступающих в реакцию. Это взаимодействие происходит в форме столкновения молекул. Во всем многообразии столкновений выделяют элементарные стадии процесса. Элементарная стадия — это столкновение молекул реагирующих веществ, приводящее к образованию молекул продуктов. Механизм химической реакции – это число и последовательность элементарных стадий процесса. Характеристикой механизма является молекулярность элементарных стадий. Молекулярность – это число частиц, участвующих в элементарном превращении. Различают: а) мономолекулярные превращения: I2 → 2I б) бимолекулярные превращения: Н2 + I2 → 2 HI в) тримолекулярные превращения: 2NO + O2 → 2 NO2 Молекулярность не может быть больше трех, т.к. вероятность столкновения четырех и более частиц ничтожно мала. Химическая реакция является простой по механизму, если представляет собой многократное чередование одной элементарной стадии. Например, H2 + I2 → 2 HI. Если химическая реакция протекает в несколько стадий, то она является сложной по механизму. К наиболее сложным относятся радикальные (цепные) реакции, протекающие с участием радикалов. Радикал – это атом или группа атомов, имеющий неспаренный электрон. Радикалы образуются в результате термолиза, фотолиза и ОВР. Рассмотрим механизм радикальной реакции взаимодействия водорода с бромом: H2 + Br2 → 2 HBr. Первая стадия процесса называется стадией инициирования. Молекула брома поглощает энергию, распадаясь при этом на два атома. Атомы брома являются одновременно радикалами, так как содержат неспаренные электроны. Молекулярность стадии равна единице:
Вторая стадия процесса называется ростом цепи. Она включает два элементарных превращения, молекулярность которых равна двум: Br● + H2 → HBr + H● H● + Br2 → HBr + Br● Заключительная стадия процесса называется обрывом цепи. На этой стадии радикалы соединяются в молекулы, в результате чего содержание радикалов в реакционной смеси резко уменьшается и процесс постепенно затухает: 2 Br● → Br2 2 H● → H2 Br● + H● → HBr Радикальные реакции протекают in vivo под действием ОН●, НОО●, ROO●, О2● и других радикалов. Ученые считают, что накопление радикалов во внутриклеточных жидкостях — одна из причин старения. Реакция пероксидного окисления липидов, скорость которой резко возрастает даже под воздействием малых доз радиации, приводит к разрушению клеточных мембран, нарушению обмена веществ в клетке, снижению клеточного иммунитета. Для снижения скорости пероксидного окисления используется антиоксиданты, к которым относятся витамины А, Е, С и соединения селена.
|
||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 918; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.245.158 (0.007 с.) |

 2 NH3.
2 NH3.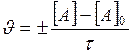 ,
,