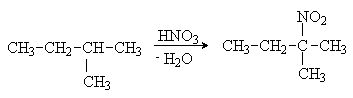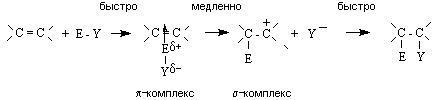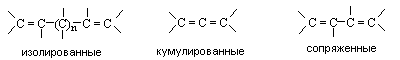Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В параллельных (конкурирующих) реакциях из одних и тех же реагентов образуются разные продукты.
Энергетическая диаграмма такого процесса приведена на рисунке.
Состав продуктов конкурирующих реакций может зависеть от относительных скоростей их образования (кинетический контроль) или от их относительной термодинамической стабильности (термодинамический контроль). Если обе конкурирующие реакции необратимы, то состав продуктов определяется относительной скоростью их образования (кинетический контроль). Тогда в рассмотренной выше реакции будет преобладать продукт С, так как его образованию предшествует переходное состояние с меньшей энергией. Если хотя бы одна из конкурирующих реакций обратима, то соотношение продуктов может быть иным. Если остановить реакцию задолго до достижения равновесия, то реакция будет подчиняться кинетическому контролю и основным ее продуктом будет вещество С. Если же довести процесс до состояния равновесия, то в реакционной смеси будет преобладать термодинамически более устойчивый продукт В. В этом случае реакция подчиняется термодинамическому контролю. На рисунке приведен случай несовпадения кинетического и термодинамического контроля продуктов реакции. Возможен случай, когда термодинамически устойчивый продукт образуется с большей скоростью, т. е. является и кинетически, и термодинамически контролируемым. УГЛЕВОДОРОДЫ Лекция 6 АЛКАНЫ Алканы – это ациклические углеводороды, содержащие только простые связи С-С. Общая формула – СnH2n+2. Методы получения
cat: Ni, Pt, Pd
2RCOONa + 2H2O →R-R + 2CO2 + 2NaOH + H2 Химические свойства Алканы содержат σ -связи С-Н и С-С, для которых характерны высокая прочность (ЕС-С=347 кДж/моль; ЕС-Н=415 кДж/моль), малая полярность (µС-С = 0D; µС-Н = 0,4D), низкая поляризуемость. Алканы обладают низкой реакционной способностью. Их превращения осуществляются в жестких условиях. При этом почти всегда происходит гомолитический разрыв связей, который требует существенно меньших затрат энергии. Основной тип реакций алканов – реакции радикального замещения:
1. Галогенирование Галогенирования алканов протекает при УФ-облучении или высокой температуре по схеме: RH + Hal2 →RHal + HHal Hal=Cl, Br. Реакционная способность галогенов по отношению к алканам уменьшается в ряду: F2 >Cl2 >Br2 >I2 Фторирование в обычных условиях приводит к полному разрушению органической молекулы. Иод с алканами не взаимодействует. Реакции галогенирования протекают по цепному радикальному механизму, который включает следующие стадии: инициирование цепи, рост цепи,обрыв цепи. Стадией, определяющей скорость реакции, является стадия отщепления водорода атомом галогена. При хлорировании углеводородов, как правило, образуется смесь монохлорпроизводных, т.е. реакции протекают неселективно. Зная относительную реакционную способность С-Н связей (перв -С-Н < втор -C-Н < трет- С-Н) и количество С-Н связей определенного сорта, можно рассчитать состав смеси. Указанный ряд соответствует ряду относительной стабильности алкильных радикалов:
Бромирование алканов, в отличие от хлорирования, протекают региоселективно, в первую очередь образуются третичные бромпроизводные. 2. Сульфохлорирование Под действием смеси оксида серы (IV) и хлора при УФ-облучении из алканов образуются алкилсульфохлориды: RH + SO2 + Cl2 → RSO2Cl + HCl Реакция протекает по свободнорадикальному механизму. При обработке алкилсульфохлоридов щелочами образуются акилсульфонаты, которые используются как поверхностно-активные вещества (ПАВ): RSO2Cl + 2NaOH → RSO3-Na+ + NaCl + H2O Алкилсульфонат натрия 3. Нитрование При нагревании алканов с разбавленной азотной кислотой в жидкой фазе (М.И.Коновалов) происходит образование нитросоединений:
Замещение происходит преимущественно у наиболее реакционноспособного третичного атома углерода. Например:
В промышленности нитрование алканов проводят в газовой фазе при 150-4500С парами азотной кислоты. Газофазное нитрование протекает неселективно с образованием наряду с продуктами замещения водорода продуктов продуктов расщепления С-С связей:
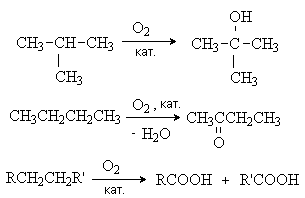
4. Окисление При комнатной температуре даже такие сильные окислители, как KMnO4 и K2Cr2O7, не действуют на алканы. При высоких температурах в присутствии избытка кислорода алканы сгорают с образованием углекислого газа и воды:
2CnH2n+2 + (3n + 1) O2 → 2n CO2 + (2n + 2) H2O В более мягких условиях (температура не выше 2000С) в присутствие катализаторов (соединений марганца) происходит неполное окисление алканов кислородом с образованием спиртов, кетонов, карбоновых кислот. В реакции принимают участие наиболее реакционноспособные третичные или вторичные С-Н связи:
Реакции используются в промышленности для синтеза ценных кислородсодержащих соединений и их смесей. Лекция 7 НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ А л к е н ы Алкены – это углеводороды состава СnH2n, содержащие в молекуле одну связь С=С. Методы получения
Химические свойства Химические свойства алкенов определяются наличием связи С=С. π -Связь обладает меньшей энергией, чем σ -связи. Энергия двойной связи (611 кДж/моль) меньше удвоенной энергии простой связи (703 кДж/моль). Связь С=С неполярна, но обладает большей поляризуемостью, чем σ -связи. Поэтому она легко разрывается под действием электрофильных (AE реакции) и радикальных (AR реакции) реагентов. Кроме того, π -связь оказывает влияние на реакционную способность связи С-Н в аллильном положении, что делает возможным протекание реакций радикального замещения атома водорода. Таким образом, молекулы алкенов содержат два основных реакционных центра – связь С=С и связь С-Н в аллильном положении:
Основные типы реакций алкенов:
1. Реакции электрофильного присоединения AE реакции – основной тип превращений алкенов. По электрофильному механизму к алкенам могут присоединяться галогены, галогеноводороды, серная кислота, вода и другие электрофильные реагенты. Общий механизм реакции включает ряд последовательных стадий:
На первой стадии электрофил образует π -комплекс с алкеном, в котором двойная связь выступает как донор, а электрофил как акцептор электронов. Далее π -комплекс медленно перегруппировывается в карбокатион (σ -комплекс). На последней стадии происходит быстрое взаимодействие карбокатиона с нуклеофилом (Y -) с образованием продукта присоединения. Скорость-определяющей стадией процесса является стадия образования π -комплекса. Ее скорость, а, следовательно, и скорость процесса в целом, зависит от стабильности интермедиата – карбокатиона, который близок по энергии к переходному состоянию лимитирующей стадии. Стабильность карбокатионов возрастает в ряду:
Электронодонорные заместители (алкильные группы) увеличивают реакционную способность алкенов, так как повышают электронную плотность двойной связи и стабилизируют карбокатион. Электроноакцепторные заместители действуют в противоположном направлении:
Присоединение протонных кислот Галогеноводороды и концентрированная серная кислота взаимодействуют с алкенами с образованием соответственно алкилгалогенидов и алкилсульфатов:
Реакционная способность кислот зависит от их силы и возрастает в ряду: HF < HCl < HBr < HI При присоединении кислот к несимметрично замещенным алкенам реакция протекает региоселективно. Согласно правилу Марковникова, водород присоединяется к наиболее гидрированному атому углерода:
R-CH=CH2 + HCl → R-CHCl-CH3 Направление присоединения определяется поляризацией двойной связи и относительной стабильностью образующихся карбокатионов:
Правило Марковникова не является универсальным. Оно может нарушаться в случае изменения механизма реакции, а также при присоединении кислот к алкенам, содержащим электроноакцепторные заместители, обладающие –I-эффектом (CF3, +N(CH3)3) или –I- и –М-эффектами (CHO, COOH, CN), например: CF3CH=CH2 + HCl → CF3CH2CH2Cl В этом случае реакция также протекает в направлении образования наименее дестабилизированного интермедиата, которым является первичный карбокатион, так как в нем электроноакцепторный заместитель не расположен в непосредственной близости от положительно заряженного атома углерода:
С учетом приведенных фактов можно сформулировать следующее правило: Электрофильное присоединение несимметричных реагентов к несимметричным алкенам протекает в направлении образования наиболее стабильного карбокатиона. Это правило позволяет предсказать строение продуктов присоединения к алкенам не только соединений типа HX, но и других несимметричных реагентов (ICl, HOCl). 2. Гидратация алкенов Алкены присоединяют воду в присутствии протонных кислот в качестве катализаторов. При этом образуются спирты. Присоединение происходит в соответствии с правилом Марковникова.
Реакция используется для получения вторичных и третичных спиртов. 3. Присоединение галогенов Галогены легко присоединяются к алкенам с образованием вицинальных дигалогенидов, например: RCH=CH2 + Br2 → RCHBrCH2Br Реакционная способность галогенов возрастает в ряду: I2 < Br2 < Cl2 < F2. Присоединения брома используют как качественную реакцию на двойную связь. 4. Реакции радикального присоединения Реакции присоединения по радикальному механизму протекают против правила Марковникова.
Образуется продукт, которому предшествует более стабильный свободный радикал. Реакция характерна только для HBr. В случае НСl и HI радикальный процесс энергетически не выгоден. 5. Реакции окисления связи С = С Алкены легко окисляются. Состав продуктов окисления зависит от окислителя и условий проведения реакции. Эпоксидирование Алкены взаимодействуют с надкислотами, кислородом в присутствии катализатора с образованием эпоксидов:
Эпоксиды обладают высокой реакционной способностью и являются ценными продуктами в промышленном органическом синтезе. Предполагают, что эпоксиды являются первичными продуктами ферментативного окисления кислородом связей С=С, в том числе и в конденсированных ароматических углеводородах. Окисление перманганатом калия Алкены окисляются перманганатом калия в нейтральной среде при комнатной температуре с образованием двухатомных спиртов:
Реакция используется как тест на присутствие в соединении С=С связи (реакция Вагнера). Окисление KMnO4 в более жестких условиях (кислая среда, нагревание) протекает с расщеплением углеродного скелета и образованием кетонов и (или) кислот. Озонолиз Алкены взаимодействуют с озоном с образованием озонидов, при гидролизе которых образуются карбонильные соединения и пероксид водорода:
Состав продуктов озонолиза позволяет установить положение двойной связи в исходном алкене. Гидролиз озонида обычно проводят в присутствии восстановителей (Zn), чтобы избежать окисления альдегидов пероксидом водорода. 6. Реакции по аллильному положению Галогенирование Хлорирование пропена хлором при высоких температурах дает продукт замещения, а не присоединения:
Реакция протекает по радикальному механизму.
А л к а д и е н ы Алкадиены – это углеводороды состава СnH2n-2, содержащие две связи С=С. В зависимости от взаимного расположения двойных связей алкадиены делят на три типа:
Диены с изолированными связями по своим свойствам мало отличаются от алкенов. Кумулированные и сопряженные диены обладают рядом специфических свойств. Наибольший интерес представляют сопряженные диены.
|
||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 499; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.6.77 (0.04 с.) |