Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные механизмы биосинтеза атфСодержание книги Поиск на нашем сайте
Регуляция метаболизма. Нейрогуморальная регуляция у животных и человека. МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНЫМ РАБОТАМ Работа 1. Распределительная хроматография аминокислот на бумаге
В настоящее время метод хроматографии является одним из наиболее простых, быстрых и точных методов анализа сложных смесей веществ. Он основан на различиях в скорости переноса растворенных веществ в системе двух фаз, одна из которых подвижна. При хроматографии на бумаге неподвижной фазой является сорбированная на поверхности бумаги вода, а подвижной – смесь различных органических растворителей, насыщенных водой. Разделение веществ методом хроматографии на бумаге происходит в том случае, если эти вещества существенно отличаются по своей растворимости в обеих жидких фазах. Метод распределительной хроматографии аминокислот на бумаге заключается в том, что каплю смеси аминокислот наносят на стартовую линию хроматографической бумаги, конец которой опускают в смесь органических растворителей. Чем меньше растворимость аминокислот в воде и чем больше их растворимость в органическом растворителе, тем быстрее они движутся за фронтом органического растворителя. Положение аминокислот на бумаге можно обнаружить при помощи цветной реакции с нингидрином. Подвижность веществ при хроматографии на бумаге характеризуют с помощью коэффициента скорости движения (Rf), представляющего собой отношение расстояния (мм), пройденного веществом от линии старта, к расстоянию, пройденному фронтом растворителя.
расстояние, пройденное веществом Rf = --------------------------------------------------------- расстояние, пройденное растворителем
Расстояние, пройденное аминокислотой, измеряют от места ее нанесения до середины пятна. Rf является характерной величиной для каждой аминокислоты и постоянен при данных условиях. Оборудование, реактивы: сушильный шкаф, электрическая плитка, капиллярные пипетки, кювета, бутанол, уксусная кислота, вода в соотношении 40:10:50, 0.5%-ный раствор нингидрина в ацетоне, смесь аминокислот.
Ход работы Для проведения анализа берут полоску хроматографической бумаги шириной 1.5 и длиной 12-14 см. Смесь аминокислот (глицина и лейцина) наносят в виде точки на стартовую линию, проведенную простым карандашом на расстоянии 1 см от короткого края бумаги. Растворы аминокислот наносят специальными капиллярными пипетками, не допуская расплывания нанесенного раствора до пятна размером более 0.2 мм. В пробирку, служащую хроматографической камерой, наливают 1 мл верхнего слоя растворителя и закрывают пробирку пробкой. Полоску хроматографической бумаги с нанесенными аминокислотами осторожно помещают в пробирку с растворителем, следя за тем, чтобы растворитель был ниже линии старта. Укрепляют хроматограмму в пробирке, которую ставят в штатив под тягой. Процесс хроматографирования длится 1-1.2 часа. По окончании указанного срока отмечают на хроматограмме фронт растворителя и высушивают ее над плиткой. Затем хроматограмму проявляют 0.5%-ным раствором нингидрина в ацетоне. После испарения ацетона при комнатной температуре хроматограммы прогревают в термостате при 60оС или над плиткой до появления пятен аминокислот. Отмечают расположение аминокислот, вычисляют их Rf-индексы. Работа 2.Определение
Вследствие наличия способных к ионизации групп (концевых групп СООН и NH2, а также боковых групп дикарбоновых и диаминокислот) молекулы белков обладают электрическим зарядом: положительным и отрицательным. В кислой среде белки имеют суммарный положительный заряд:
R-NH2 + H+ Û R-NH3+,
в щелочной среде - отрицательный:
R-COOH + OH- Û R-COO- + H2O.
При определенном значении pH среды величина положительных и отрицательных зарядов становится одинаковой и суммарный заряд белка оказывается равным нулю. Значение рН, при котором белок не имеет суммарного электрического заряда, называют изоэлектрической точкой (ИЭТ). В этом состоянии белки наименее устойчивы и легко выпадают в осадок, имеют наименьшее значение вязкости, растворимости, степени гидратации и электропроводности, не способны передвигаться к электрическим полюсам. Каждый белок имеет свое значение ИЭТ: казеин - 4,6 - 4,7; сывороточный глобулин - 5,4; протамины – 10 – 12; и т.д. Существует целый ряд способов определения ИЭТ белков.
Оборудование, реактивы: пробирки, пипетки на 1, 5 и 10 мл, карандаш по стеклу; 0,1 и 0,01 н. растворы уксусной кислоты.
Материалы: 0,5%-ный раствор желатина (растворяют 0,5 г желатина при подогревании в 10 мл 1 н. раствора уксуснокислого натрия и добавляют воды до 100 мл). Ход работы В каждую из 8 пронумерованных пробирок по нижеприведенной таблице 1 вносят соответствующие растворы после перемешивания + 1 мл танина. В той пробирке, где обнаружится максимальное помутнение среды (визуально или нефелометрически), рН раствора будет соответствовать ИЭТ белка. Таблица 1
По результатам опыта сделайте вывод об изоэлектрической точке белка.
Работа 3. Качественные реакции на белки Методы качественного обнаружения белков основаны на трех типах реакций: а) по пептидным связям белковой молекулы; б) по a-аминогруппе; в) по аминокислотным радикалам. Примером реакции первого типа служит биуретовая реакция, второго типа - нингидриновая реакция, а к третьему типу относятся многочисленные цветные реакции на радикалы аминокислот. По характеру цветных реакций третьего типа можно судить о качественном составе белков. Оборудование, реактивы: баня водяная, пробирки химические, стаканы химические на 100 мл; пипетки, градуированные на 1, 2, 5 и 10 мл; лакмусовая бумага, хлорид натрия (10%-ный), сульфат аммония (насыщенный), гидроксид натрия (10 и 30%-ном), сульфат меди (1%‑ный), нингидрин (1%-ный в ацетоне 95%-ном), a-нафтол (0,2%‑ный спиртовой раствор), гипобромид натрия, ледяная уксусная кислота, серная, соляная и азотная кислоты (конц.), нитрит натрия (0,5%-ный), сульфаниловая кислота (5%-ная), карбонат натрия (10%‑ный), раствор плюмбита натрия. Материалы. Неразбавленный белок куриного яйца. Отделяют белок трех куриных яиц от желтков. Считая, что масса белка в одном яйце в среднем равна 33 г, получают около 100 мл неразбавленного раствора белков куриного яйца. Этот раствор содержит 88% воды, 1% углеводов и 0,5% минеральных веществ; остальное приходится на белок. Таким образом, полученный неразбавленный белок куриного яйца представляет собой примерно 10%-ный раствор белка. Разбавленный раствор яичного альбумина. Белок одного куриного яйца после отделения от желтка хорошо взбалтывают и затем смешивают в колбе с десятикратным объемом дистиллированной воды. Раствор фильтруют через двойной слой смоченной водой марли или кусок стираного полотна, помещенные в воронку. Отфильтровывают раствор яичного альбумина; в осадке остается яичный глобулин. Учитывая, что концентрация альбумина в белке куриного яйца составляет около 6%, полученный разбавленный раствор яичного альбумина является примерно 0,5%-ным. Ход работы 1. Обнаружение в молекулах белков пептидных связей (биуретовая реакция). К 1-2 мл разбавленного раствора белка прибавляют двойной объем 30%-ного раствора гидроксида натрия, хорошо перемешивают и добавляют 2-3 капли 1%-ного раствора сульфата меди. Снова тщательно перемешивают. Развивается сине-фиолетовое окрашивание. При малом содержании белка чувствительность реакции можно повысить, наслаивая на раствор белка в щелочи 1 мл 1%-ного раствора сульфата меди. При стоянии на границе двух слоев появляется фиолетовое кольцо. Реакция названа биуретовой потому, что аналогичную цветную реакцию дает биурет, легко получаемый из мочевины при ее нагревании при температуре 150 - 1600С.
Биурет в щелочной среде претерпевает енолизацию по схеме:
Две молекулы биурета в енольной форме взаимодействуют с гидроксидом меди (II) с образованием комплексного соединения меди:
Аналогично построено комплексное соединение меди с енолизированными пептидными группами любого белка:
2. Нингидриновая реакция К 2 - 3 мл разбавленного белка приливают 3 - 4 капли 1%-ного раствора нингидрина в 95%-ном ацетоне. Раствор перемешивают и ставят в водяную баню при 700С на несколько минут. Появляется сине-фиолетовое окрашивание. Сначала в результате взаимодействия a-аминогруппы аминокислоты (или белка) с нингидрином возникает Шиффово основание. Затем оно претерпевает перегруппировку, декарбоксилируется и расщепляется на альдегид и аминодикетогидринден.
Аминодикетогидринден конденсируется еще с одной молекулой нингидрина, и образовавшееся соединение, енолизируясь, переходит в окрашенную форму, получившую название "сине-фиолетовый Руэмана" - по имени исследователя, впервые в 1910 г. изучившего эту реакцию.
В присутствии органических растворителей (ацетона, этанола, пиридина и др.), на которых обычно готовят раствор нингидрина, протекает реакция:
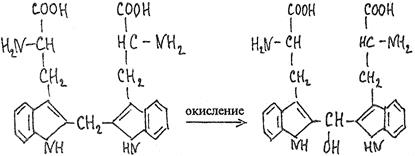
Продукт этой реакции содержит в своем составе радикал (R) исходной аминокислоты, который обусловливает различную окраску (голубую, красную и т.п.) соединений, возникших при реакции аминокислот с нингидрином. В настоящее время нингидриновая реакция широко используется как для открытия отдельных аминокислот, так и для определения их количеств. 3. Ксантопротеиновая реакция. К 1 мл разбавленного белка добавляют 5-6 капель концентрированной азотной кислоты до появления белого осадка или мути от свернувшегося белка. При нагревании раствор и осадок окрашиваются в ярко-желтый цвет. При этом осадок почти полностью растворяется. Охлаждают смесь и осторожно добавляют к раствору, имеющему кислую реакцию, не взбалтывая, по каплям избыток щелочи до щелочной реакции. Выпадающий вначале осадок кислотного альбумината растворяется, и жидкость окрашивается в ярко-оранжевый цвет. Ксантопротеиновая реакция происходит только при наличии в белках остатков ароматических аминокислот (фенилаланина, тирозина и триптофана). Желатин, не содержащий ароматических аминокислот, не дает ксантопротеиновой пробы. В результате реакции нитрования по радикалам ароматических аминокислот образуются желтоокрашенные нитросоединения. Изменение желтой окраски на оранжевую в щелочной среде обусловлено появлением хромофорной группы. Рассмотрим в качестве примера механизм ксантопротеиновой реакции по радикалу тирозина:
4. Реакция Сакагучи. Берут в пробирку 2 мл разбавленного раствора белка, добавляют 1 мл 10%-ного раствора гидроксида натрия и вслед за этим несколько капель 0,2%-ного спиртового раствора 1-нафтола. Перемешивают, доливают 0,5 мл раствора гипобромида натрия и вновь перемешивают. Развивается оранжево-красное окрашивание. Появление окраски объясняется взаимодействием 1-нафтола в присутствии окислителя с гуанидиновыми группировками радикалов аргинина. Хотя механизм реакции еще полностью не выяснен, ряд наблюдений свидетельствует в пользу следующей схемы. Сначала 1-нафтол в присутствии окислителя соединяется с гуанидиновой группировкой аргинина:
Затем при дальнейшем окислении нафтиларгинина образуется соединения типа хинонимина:
Так как производные хинониминов (в данном случае нафтохинонимина), у которых водород иминогруппы замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления NH-групп гуанидинового остатка и бензольного ядра 1-нафтола. 5. Реакция Адамкевича. Наливают в пробирку несколько капель неразбавленного белка и прибавляют 2 мл уксусной кислоты, к которой добавляют немного глиоксиловой кислоты. Смесь слегка нагревают до растворения образующегося осадка. Охлаждают пробирку со смесью, а затем, сильно наклонив ее, осторожно, по стенке приливают 1 мл концентрированной серной кислоты так, чтобы обе жидкости не смешивались. При стоянии на границе двух жидкостей получается красно-фиолетовое кольцо. Окраска возникает за счет реакции триптофана с глиоксиловой кислотой, всегда присутствующей в уксусной кислоте в виде примеси. Триптофан в этой реакции конденсируется с формальдегидом, выделяющимся из глиоксиловой кислоты под воздействием концентрированной серной кислоты:
Продукт конденсации окисляется до бис-2-триптофанилкар-бинола:
Последний в присутствии минеральных кислот образует окрашенные в сине-фиолетовый цвет соли (явление галохромии).
Работа 4. Выделение рибонуклеопротеинов Нуклеопротеины – сложные белки, простетической группой которых являются нуклеиновые кислоты – ДНК или РНК. В дезоксирибонуклеопротеинах (ДРНП) и рибонуклеопротеинах (РНП) нуклеиновые кислоты и белки связаны друг с другом в основном солевыми связями, которые могут легко диссоциировать, что и происходит достаточно часто в процессе выделения ДРНП и РНП, особенно в момент воздействия крепких растворов солей. Выделение нуклеопротеинов можно осуществить различными методами: 1) извлечением дистиллированной водой с последующим осаждением нуклеопротеина уксусной кислотой; 2) экстракцией слабым раствором (0,2 - 0,4%) щелочи с последующим действием уксусной кислоты; 3) экстракцией растворами хлорида натрия средних концентраций, из которых нуклеопротеины выпадают при разбавлении раствора; 4) последовательным извлечением различных нуклеопротеинов сначала 0,15 М раствором хлорида натрия, затем 1 М его раствором и, наконец, 0,27%-ным раствором гидроксида натрия; 5) ультрацентрифугированием в градиенте плотности сахарозы или хлорида цезия; 6) фильтрованием через гель сефадекса.
Оборудование, реактивы: центрифуга, колба круглодонная на 100 мл с обратным прямым воздушным холодильником, ступка (диаметр 110 мм), стакан стеклянный на 200 мл, цилиндр мерный на 50 мл, воронка стеклянная, пробирки химические, песок промытый и прокаленный, гидроксид натрия (0,4%-ный), уксусная кислота (10%-ная), соляная кислота (конц.), сульфат меди (1%-ный), орциновый реактив, аммиак (конц.), аммиачный раствор оксида серебра, молибдат аммония, диэтиловый эфир, серная кислота (10%-ная). Материал: дрожжи пекарские (высушенные). Ход работы 10 г дрожжей смешивают в ступке со смесью (1 мл эфира и 1 мл воды), добавляют 5 г песка и тщательно растирают, приливая к растертой массе небольшими порциями (20 мл) 0,4%-ный раствор гидроксида натрия. Растирание продолжают в течение 15 ‑ 20 мин. После этого осадок отделяют путем центрифугирования (3 мин при 3 000 обмин). Центрифугат сливают в стакан и к нему добавляют небольшими порциями (по 0,5 мл) 10%-ную уксусную кислоту до слабокислой реакции по лакмусу (5 ‑ 6 мл). Полученный осадок нуклеопротеинов отделяют центрифугированием. Гидролиз нуклеопротеинов. В колбу для гидролиза (с обратным воздушным холодильником) помещают осадок нуклеопротеинов и 10 мл 10%-ного раствора серной кислоты. Колбу закрывают пробкой с проходящим через нее воздушным холодильником (трубка длиной 70 см и диаметром 0,7 - 0,8 см) и смесь кипятят на сетке в течение 1 часа, поддерживая слабое кипение. Гидролизат отфильтровывают и в прозрачном растворе определяют наличие белков, пентозы, пуриновых оснований и фосфорной кислоты. Белки обнаруживают по биуретовой реакции. Пентозу – по реакции с орцином. К 1 мл орцинового реактива добавляют половинный объем гидролизата, 1 мл соляной кислоты и нагревают до кипения. Появляется зеленое окрашивание. При нагревании с 20%-ной соляной кислотой рибоза дегидратируется и превращается в фурфурол. Последний конденсируется с орцином с образованием окрашенных соединений. Дезоксирибоза не дает этой реакции. Пуриновые основания обнаруживают по их реакции с аммиачным раствором оксида серебра. К 2 мл гидролизата приливают по каплям крепкий раствор аммиака до щелочной реакции по лакмусу и добавляют равный объем аммиачного раствора оксида серебра. Постепенно образуется осадок серебрянных солей пуриновых оснований. Фосфорную кислоту обнаруживают с помощью молибдата аммония. К 2 мл раствора молибдата аммония в азотной кислоте прибавляют 1 мл испытуемого раствора. Смесь слегка нагревают. Образуется желто-зеленый осадок молибдата аммония: 12 (NH4)2MoO4 + H3PO4 + 21HNO3 ® (NH4)3PO4´12MoO3 +
Работа 5. Качественные реакции Оборудование и реактивы: ступка с пестиком, пробирки химические, баня водяная, пипетки на 1, 2 и 5 мл, воронка Бюхнера, терка, пероксид водорода (0,5%-ный и 2%-ный), пирогаллол (1%-ный), марля, пластинка стеклянная, колба коническая на 100 мл, цилиндр мерный на 50 мл, 1%-ный раствор мочевины и тиомочевины, 0,02%-ный раствор спиртовой фенолфталеина, клейстер крахмальный (1%-ный), йод (1%-ный) в йодиде калия (3%-ном), фелингова жидкость. Материалы: картофель сырой, арбузные семечки, разбавленная слюна (рот ополаскивают 2-3 раза водой для удаления остатков пищи, отмеряют цилиндром 50 мл дистиллированной воды и ополаскивают ею рот в течение 3 - 5 мин. в несколько приемов. Собранную жидкость - примерно 50 - 60 мл - фильтруют через вату и фильтрат используют для работы). Ход работы 1. Открытие уреазы в арбузных семечках. 2 арбузных семечка очищают от кожуры и растирают в ступке с 5 мл воды. В опыте затем используют полученную суспензию уреазы. В две пробирки наливают по 2 мл суспензии уреазы. Затем в одну пробирку приливают 2 мл раствора мочевины, а в другую - 2 мл раствора тиомочевины. В обе пробирки добавляют по 3 - 4 капли раствора фенолфталеина. Содержимое пробирок перемешивают и оставляют стоять при комнатной температуре на 10 - 15 минут. Наблюдайте, что происходит в пробирках. Запишите уравнение реакции, сделайте вывод.
2. Открытие амилазы в слюне. В две пробирки наливают по 3 мл картофельного клейстера и в одну из них - 3 мл воды, а в другую - 3 мл раствора слюны. Обе пробирки одновременно помещают в водяную баню при 400С. Через 1 минуту от каждой смеси отбирают с помощью стеклянной палочки по капле жидкости и смешивают их по отдельности с каплей йода, заранее нанесенной на пластинку. Повторяют взятие проб через 2, 4, 6 и 8 минут. Окраска с йодом проб из пробирки, содержащей слюну, меняется от синей к сине-фиолетовой, буро-красной, красной и, наконец, желтой. К содержимому пробирки со слюной добавляют 1 - 2 мл фелинговой жидкости и смесь нагревают до начала кипения. Образуется красный осадок оксида меди (I) за счет восстановления гидроксида меди (II) образовавшимися мальтозой и низкомолекулярными декстринами. Контрольная проба в тех же условиях не восстанавливает гидроксид меди (II) в оксид меди (I). 3. Открытие пероксидазы (донор: Н2О2 - оксидоредуктаза; КФ 1.11.1.7) в картофеле. Картофель натирают на терке. Небольшое его количество, не отжимая, переносят в пробирку, добавляют 1 - 2 мл 1%-ного раствора пирогаллола и 2-3 капли 2%-ного раствора пероксида водорода. При стоянии выпадает желто-бурый осадок пурпурогаллина. Образование пурпурогаллина выражает следующая схема:
Многократное дегидрирование (окисление) пирогаллола и ряда промежуточных продуктов на пути к пурпурогаллину осуществляется с участием пероксидазы, каждый раз передающей снятые атомы водорода на пероксид водорода. Сделайте вывод о классе, подклассе обнаруженных ферментов, субстратах и продуктах реакций. Сравните ферменты, относящиеся к классу гидролаз, по субстратной специфичности.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 526; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.30.14 (0.009 с.) |