
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Формулы аминокислот, входящих в состав белков.Содержание книги
Поиск на нашем сайте Химические основы жизни
Методические указания
Рекомендовано Научно-методическим советом университета для студентов направлений «Химия» и «Прикладная информатика в химии»
Ярославль 2011 УДК 577 ББК Е 072я73
Рекомендовано редакционно-издательским советом университета в качестве учебного издания. План 2011года.
Рецензент кафедра органической и биологической химии Ярославского государственного университета им. П.Г.Демидова
Составители: Г.А. Урванцева, Е.Л. Грачева. Химические основы жизни: Метод. указания /Сост. Г.А.Урванцева, Е.Л.Грачева; Яросл. гос. ун-т.- Ярославль: ЯрГУ, 2011.- с.
Методические указания предназначены для студентов, обучающихся по направлениям «Химия» и «Прикладная информатика в химии».
УДК 577 ББК Е 072я73
© Ярославский государственный университет, 2011. © Г.А.Урванцева, Е.Л.Грачева. 2011.
ВВЕДЕНИЕ
Химические основы жизни – одна из ведущих, быстро развивающихся химических дисциплин. Это наука изучает химический состав, строение, функции веществ, входящих в состав живых организмов, обмен веществ (метаболизм) и его регуляцию, энергообеспечение процессов жизнедеятельности. Список рекомендуемой литературы: 1. Румянцев Е.В. и др. Химические основы жизни/ Е.В.Румянцев, Е.В. Антина, Ю.В.Чистяков.- М.: Химия, Колос С, 2007.- 560 с. 2. Комов В.П., Шведова В.Н. Биохимия. – М.: Дрофа, 2004. – 639 с. 3. Кнорре Д.С., Мызина С.Д. Биологическая химия. – М.: Высш. шк., 2000. – 479 с. 4. Ленинджер А. Основа биохимии: В 3-х т. – М.: Мир, 1985. – 367 с.(переиздан в 2009 г.).
СЛОВАРЬ ТЕРМИНОВ АДЕНОЗИНТРИФОСФАТ (АТФ)- нуклеотид, образованный аденозином и тремя остатками фосфорной кислоты; выполняет роль универсального аккумулятора биохимической энергии. АКТИВАЦИЯ ФЕРМЕНТОВ – увеличение активности ферментов под действием активаторов (ионы металлов, коферменты, субстраты и др). АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ- изменение конформации активного центра фермента в результате взаимодействия с активатором или ингибитором, усиливающим или затрудняющим превращение субстрата. АЛЬБУМИНЫ -это белки, хорошо растворимые в воде и растворах солей. Они выпадают в осадок в насыщенном растворе сульфата аммония. АНАЭРОБНЫЕ ОРГАНИЗМЫ – организмы, не использующие кислород в качестве акцептора электронов для окисления органических веществ. АНАЭРОБНЫЕ ПРЕВРАЩЕНИЯ – процессы, идущие при недостатке или отсутствии кислорода. АЭРОБНЫЕ ОРГАНИЗМЫ – организмы, использующие в качестве акцептора электронов для окисления органических веществ молекулярный кислород. БЕЛКИ – природные высокомолекулярные органические соединения, состоящие из ά-аминокислот, соединенных пептидными связями. БИОСИНТЕЗ БЕЛКОВ включает транскрипцию, активирование аминокислот и трансляцию, протекает на рибосоме. БИОХИМИЯ – наука о молекулярной логике живого. Изучает качественный состав, количественное содержание компонентов живого, обмен веществ (метаболизм), энергообеспечение процессов жизнедеятельности, регуляцию процессов метаболизма. БИОЭНЕРГЕТИКА – это наука, изучающая механизмы энергообеспечения живых организмов (субстратное, окислительное, фотосинтетическое фосфорилирования). БРОЖЕНИЕ – анаэробное образование энергии из углеводов. ВИТАМИНЫ – низкомолекулярные органические вещества, которые в очень низкой концентрации оказывают огромное и разнообразное биологическое действие. Главная функция витаминов состоит в том, что они входят в состав коферментов многих ферментов. ВТОРИЧНАЯ СТРУКТУРА БЕЛКОВ – конформация отдельных (соседних) участков полипептидной цепи. Удерживается за счет водородных связей пептидных групп. ВТОРИЧНАЯ СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ – это конформация полинуклеотидных цепей (ДНК) или цепи (РНК). Удерживается за счет водородных и гидрофобных взаимодействий между комплементарными азотистыми основаниями. ГЕМОГЛОБИН – сложный тетрамерный белок крови, простетической группой которого является гем; переносит кислород от органов дыхания к тканям и диоксид углерода от тканей к дыхательным органам. ГЕН – участок молекулы ДНК, кодирующий структуру РНК и белков. ГЕНЕТИЧЕСКИЙ КОД (КОДОН) – триплет нуклеотидов, кодирующий одну аминокислоту в молекуле белка. ГЕНОМ – совокупность всех генов на всех хромосомах. ГЕТЕРОТРОФЫ – организмы, использующие в качестве источника питания уже готовые органические соединения. ГИСТОНЫ – небольшие по размеру белки, они образуют сердцевину, на которую спирально наматывается ДНК в хроматине. ГЛОБУЛИНЫ - это белки, не растворимые в воде, но растворимые в растворах солей. Их можно осадить 50%-ным раствором сульфата аммония, в котором альбумины растворимы. ДЕНАТУРАЦИЯ – потеря белком (или ДНК) своих нативных свойств из-за нарушения упорядоченной пространственной структуры цепи. ДНК – дезоксирибонуклеиновая кислота, в состав которой входят аденин, гуанин, цитозин, тимин, дезоксирибоза и фосфорная кислота. ДНК – главный носитель генетической информации. ДОМЕН – это обособленная область белковой молекулы, обладающая структурной и функциональной автономией. ДЫХАНИЕ – поглощение кислорода живыми клетками. Исходным веществом обычно является глюкоза. Продуктами дыхания являются углекислый газ и эндогенная вода. ДЫХАТЕЛЬНАЯ ЦЕПЬ ФЕРМЕНТОВ – направленный, упорядоченный поток протонов и электронов от восстановленного субстрата к кислороду. Локализована во внутренней мембране митохондрий. Конечным продуктом является эндогенная вода. ЖИРЫ – это сложные эфиры глицерина и высших жирных кислот. Они бывают простыми, если в их состав входят одинаковые высшие жирные кислоты и смешанными, если они разные. ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА БЕЛКА – значение рН, при котором белок не имеет суммарного электрического заряда. и-РНК (информационная РНК) – переносит генетическую информацию от ДНК на рибосому, к месту синтеза белка. КЛАССИФИКАЦИЯ ά - аминокислот: 1. По характеру радикалов 20 аминокислот делятся на 9 групп. 2. По взаимодействию радикалов аминокислот с водой при pH=7 они делятся на гидрофобные (8 аминокислот: ала, вал, лей, иле, мет, про, три, фен) и гидрофильные - 12 аминокислот, которые подразделяются на положительно заряженые (арг, лиз, гис), отрицательно заряженые (асп, глу), полярные не заряженые (гли, сер, тре, асн, глн, цис, тир). 3. По способности синтезироваться в организме их делят на заменимые и незаменимые (у большинства животныхНК незаменимыми являются вал, лей, иле, фен, три, мет, лиз, тре, гис). КОДОН (ТРИПЛЕТ) – три нуклеотида ДНК или и-РНК, которые кодируют определенную аминокислоту в белке. КОМПЛЕМЕНТАРНЫЕ азотистые основания дополняют друг друга по структуре. А и Т (У) образуют друг с другом 2 водородные связи, а Г и Ц – 3 водородные связи. Принцип комплементарности обеспечивает хранение генетической информации, ее воспроизведение (репликацию) и реализацию (транскрипция и трансляция). ЛИПИДЫ – это сложные эфиры жирных кислот и какого-либо спирта.Основными представителями липидов являются жиры. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ состоит в снижении энергии активации реакции, которую они ускоряют. НУКЛЕИНОВЫЕ КИСЛОТЫ – это природныевысокомолекулярные органические соединения, состоящие из нуклеотидов. При полном гидролизе они распадаются на пуриновые и пиримидиновые азотистые основания, пентозу (рибозу или дезоксирибозу) и фосфорную кислоту. ОРНИТИНОВЫЙ ЦИКЛ – основной путь превращения аммиака в мочевину. Открыт Г. Кребсом и К. Хенселайтом в 1932 году. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ – порядок чередования аминокислотных остатков в молекуле белка. Удерживается за счет прочных ковалентных пептидных связей. ПЕРВИЧНАЯ СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ – это порядок чередования нуклеотидов в полинуклеотидных цепях. Удерживается за счет прочных ковалентных сложноэфирных связей. ПРАЙМЕР - небольшая цепь из рибонуклеотидов. Служит затравкой при инициации репликации ДНК. ПРОМОТОР - участок ДНК, который обычно предшествует гену и регулирует его активную работу. ПРОТЕОЛИЗ – гидролиз белков. Может быть частичным (до пептидов) или полным (до аминокислот). Частичный гидролиз ускоряется пепсином, трипсином, химотрипсином, а полный – карбоксипептидазой, лейцинаминопептидазой. РЕПЛИКАЦИЯ ДНК – удвоение ДНК или синтез дочерних цепей на исходной матрице ДНК. Обеспечивает передачу генетической информации материнской клетки дочерним. РЕНАТУРАЦИЯ – возвращение белку или ДНК их природных свойств. РЕПРЕССИЯ ГЕНА – подавление его активности, чаще всего на стадии транскрипции с помощью белка- репрессора. РЕСТРИКТАЗЫ – ферменты класса гидролаз, обладающие высокой специфичностью. В генетической инженерии используются как «молекулярные ножницы», позволяющие вырезать определенный фрагмент ДНК. РЕТРОВИРУСЫ – РНК-содержащие вирусы. Имеют в своем составе фермент ревертазу для обратного синтеза ДНК на матрице РНК. РИБОСОМА – молекулярная машина для синтеза белка. РНК – рибонуклеиновая кислота. Состоит из аденина, гуанина, цитозина, урацила, рибозы, фосфорной кислоты. В клетках живых организмов существует три вида РНК: транспортные (т-РНК), информационные (и-РНК) и рибосомальные (р-РНК). р – РНК – рибосомальные РНК, основа структуры рибосом. САЙТ – небольшой участок ДНК (например, промотор). СВОЙСТВА ФЕРМЕНТОВ: специфичность, наличие температурного оптимума и оптимума рН, а также влияние на ферменты активаторов и ингибиторов. СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ. Различают специфичность ферментов по отношению к субстрату и специфичность действия. СУБСТРАТ – это химическое соединение, на которое действует фермент. ТКАНЕВОЕ ДЫХАНИЕ – окисление органических веществ кислородом. Основная функция – запасание энергии. Аэробные клетки получают большую часть энергии за счет дыхания. Включает 4 этапа: аэробный гликолиз, окислительное декарбоксилирование пирувата, цикл Кребса и дыхательную цепь ферментов. ТРАНСКРИПЦИЯ – синтез РНК на матрице ДНК. Т-РНК – транспортная РНК. Переносит аминокислоту к месту белкового синтеза и, имея антикодон, участвует в трансляции. ТРАНСЛЯЦИЯ – сборка полипептидной цепи на рибосоме. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКОВ - это конформация полипептидной цепа в трехмерном пространстве. Она обусловлена взаимодействием радикалов аминокислот с водой и друг с другом. Удерживается в основном за счет водородных, ионных связей и гидрофобных взаимодействий между радикалами аминокислот. ТРЕТИЧНАЯ СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ – это конформация в трехмерном пространстве цепей ДНК или цепи РНК. ЭНЕРГЕТИЧЕСКИЙ ЭФФЕКТ: анаэробного гликолиза - 2 АТФ; гликогенолиза – 3 АТФ; спиртового брожения – 2 АТФ; дыхания – 38 АТФ; цикла Кребса - 12 АТФ; окисления глицерина - 22 АТФ; одного акта β - окисления – 5 АТФ. ФАГ – вирус бактерий. Как правило, содержит только одну нуклеиновую кислоту (ДНК или РНК), упакованную в белковую оболочку. ФЕРМЕНТЫ – это биокатализаторы, имеют белковую природу, характеризуются исключительной специфичностью, обладают высокой каталитической активностью, универсальностью для биохимических реакций. Ферменты, как и неорганические катализаторы, не создают реакции, а ускоряют существующие, возможные по термодинамическим законам. Ферменты одинаково ускоряют обратимые реакции в обоих направлениях, но не смещают равновесие. Добавление фермента ускоряет достижение равновесия ФОТОСИНТЕЗ – процесс, идущий с использованием световой энергии. Конечными продуктами фотосинтеза у высших растений являются крахмал, целлюлоза и сахароза. При фотосинтезе у растений выделяется кислород в космических масштабах, поглощается энергия солнца, на световой стадии образуется АТФ, а потом в темновой стадии она преобразуется в энергию химических связей углеводов. ФОСФОРИЛИРОВАНИЕ -синтез АТФ из АДФ и Ф. Бывает: субстратное фосфорилирование (в основном в анаэробных условиях); окислительное фосфорилирование (в процессе дыхания); фотосинтетическое фосфорилирование (в процессе фотосинтеза). ФУНКЦИИ БЕЛКОВ: каталитическая (белки-ферменты), транспортная (гемоглобин), регуляторная (гормон инсулин), защитная (иммуноглобулины), двигательная (актин и миозин обеспечивают работу мышц), структурная (кератины волос, ногтей), рецепторная (родопсин) и др. ФУНКЦИИ ЛИПИДОВ: структурная (компоненты биологических мембран), энергетическая («клеточное топливо»), запасающая (жировая ткань), защитная (жир – термоизоляция, механическая защита, воск на листьях, плодах – защита от инфекций, потери влаги). ФУНКЦИОНАЛЬНЫЕ ЦЕНТРЫ ФЕРМЕНТОВ. Различают активный и аллостерический центры ферментов. Активный центр, в свою очередь, состоит из каталитического (например, кофермента) и субстратного центров. Субстратный центр является местом связывания субстрата. Аллостерический центр – это участок фермента, к которому присодиняются вещества, изменяющие его конформацию. ХИМИЧЕСКАЯ ПРИРОДА ФЕРМЕНТОВ. Подавляющее число ферментов – белки. Это обычные глобулярные белки, молекулярная масса которых колеблется от 10-12 тысяч до 1 млн. дальтон. Многие ферменты имеют четвертичную структуру, то есть состоят из нескольких субъединиц. По строению ферменты могут быть простыми белками (состоят только из аминокислот) и сложными белками, когда с белковой частью связаны низкомолекулярные соединения (добавочная группа или кофактор). При этом кофактор, прочно связанный с белком и не способный к самостоятельному называется простетической группой. Пример простетической группы – гем у цитохромов. Когда с белковой частью связана добавочная группа, способная к самостоятельному существованию, то ее называют коферментом. Коферментами могут быть витамины и их производные, металлы и металлсодержащие компоненты, липоевая кислота, глутатион и некоторые другие вещества. ЦИКЛ КРЕБСА – 8 ферментативных реакций, замкнутых в цикл. Локализован в матриксе митохондрий. Главная функция состоит в образовании двух молекул углекислого газа и четырех пар атомов водорода в виде 3 НАДН·Н+ и 1 ФАД·Н 2. ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКОВ – это способ соединения и пространственной укладки относительно друг друга отдельных полипептидных цепей. Удерживается за счет слабых взаимодействий между радикалами аминокислот в контактных участках полипептидных цепей. ЭКСПРЕССИЯ ГЕНА - активная работа гена, то есть реализация генетической информации. Состоит из двух процессов: транскрипции и трансляции.
Справочные материалы. АМИНОКИСЛОТЫ 1.3.
НУКЛЕИНОВЫЕ КИСЛОТЫ
2.1. Компоненты: 1. азотистые основания (5), 2. углевод (рибоза или дезоксирибоза), 3. фосфорная кислота
Азотистые основания
Пиримидиновые азотистые основания:
Урацил (У) Тимин (Т) Цитозин (Ц)
Пуриновые азотистые основания:
Аденин (А) Гуанин (Г)
Для каждого из азотистых оснований (за исключением аденина) характерна лактим-лактамная таутомерия. В состав нуклеозидов, нуклеотидов, нуклеионовых кислот они входят в лактамной форме.
Углеводы (пентозы)
b-рибоза b-дезоксирибоза
Нуклеозид = азотистое основание + пентоза
Цитидин
Приставка «дезокси» обозначает, что вместо рибозы в нуклеозиде (нуклеотиде) содержится дезоксирибоза (если в составе нуклеозида - тимин, приставка «дезокси» не требуется, поскольку с тимином всегда соединена дезоксирибоза)
Нуклеотид = азотистое основание + пентоза + фосфат
Аденозинмонофосфат (АМФ)
Состав нуклеиновых кислот
Нуклеиновые кислоты состоят из нуклеозидмонофосфатов, соединенных 3’-5’-фосфодиэфирными связями. Ниже представлена формула фрагмента РНК -У-Г-Ц-.
Ферменты. Определение ферментов. ФЕРМЕНТЫ – это биокатализаторы, имеют белковую природу, характеризуются исключительной специфичностью, обладают высокой каталитической активностью, универсальностью для биохимических реакций. Табл.1. Номенклатура и классификация ферментов
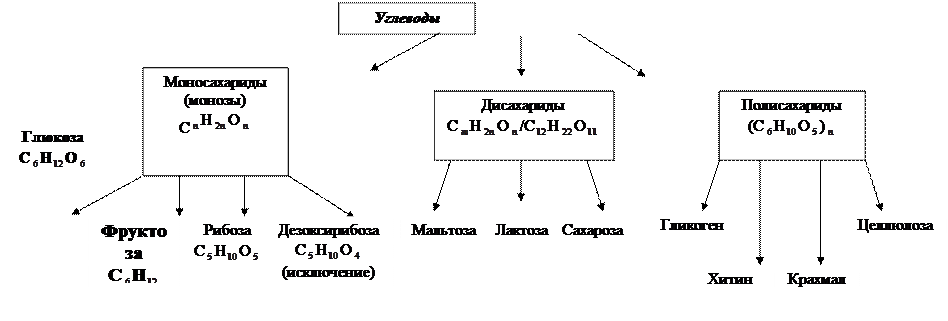
Углеводы Классификация углеводов
4.2. Структура моносахаридов. Формулы Фишера. Гексозы:
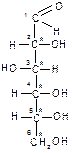 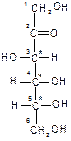 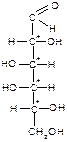
Пентозы:
 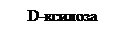  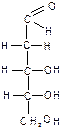 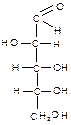 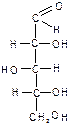
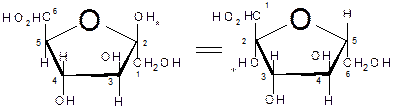
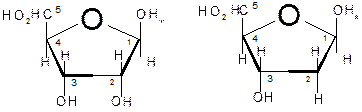
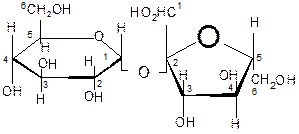
Дисахариды. 1. Мальтоза
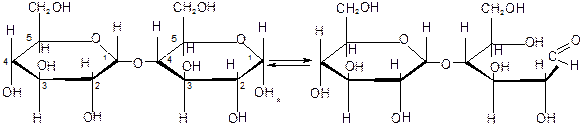
Обладает восстанавливающими свойствами. 2. Лактоза
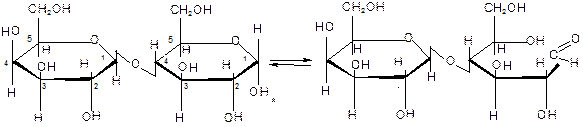
Обладает восстанавливающими свойствами.

Не обладает восстанавливающими свойствами. Полисахариды 1. Крахмал. Построен из α-глюкозы. Состоит из полисахаридов двух типов: амилозы (имеет линейное строение), на ее долю приходится 10-20 %; амилопектина (имеет разветвленное строение), 80-90 %. Амилоза
Молекулы глюкозы соединены α-1,4-гликозидной связью. Растворима в теплой воде и не образует крахмального клейстера. С раствором йода дает синее окрашивание. Амилопектин
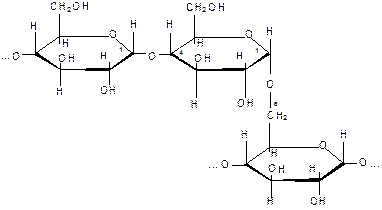
Наряду с α-1,4-гликозидными связями в местах разветвления α-1,6-гликозидная связь. Между точками разветвления 20-25 глюкозных остатков. Йодом окрашивается в фиолетовый цвет. 2. Целлюлоза (клетчатка) Построена из β-глюкозы.
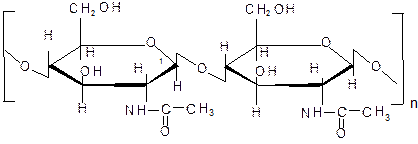
Имеет линейное, нитевидное строение, с йодом не взаимодействует. 3. Гликоген Является структурным и функциональным аналогом амилопектина крахмала, но в отличие от амилопектина имеет более разветвленные цепи. Между точками разветвления 8-10 остатков D-глюкозы. С раствором йода дает красно-фиолетовую окраску. 4. Хитин – структурный полисахарид растений (грибов) и беспозвоночных. Состоит из остатков N-ацетил-D-глюкозамина, связанных между собой β-1,4-гликозидными связями в неразветвленную полисахаридную цепь:
Липиды Липиды – это сложные эфиры жирных кислот и какого-либо спирта (Н. Грин).
Классификация липидов Четкой и однозначной классификации не существует. Их несколько. Приведем одну из них.
Простые омыляемые липиды Это нейтральные жиры и воски. Жиры – наиболее распространенные в природе липиды. По химическому строению – это триацилглицерины (-олы) – сложные эфиры трехатомного спирта глицерина и высших монокарбоновых (жирных) кислот:

Во всех природных жирах один и тот же спирт – глицерин, а отличаются они остатками высших жирных кислот. Для обозначения структуры жирных кислот принято использовать упрощенные числовые символы. Первое число – это число углеродных атомов в молекуле жирной кислоты; число после двоеточия – это число двойных связей, а числа в скобках указывают на атомы углерода, при которых располагается двойная связь. Например, числовой код олеиновой кислоты (С Примеры насыщенных жирных кислот: С С С Примеры ненасыщенных жирных кислот: С С С С В животных жирах преобладают насыщенные жирные кислоты, а в растительных – ненасыщенные. Триацилглицерины могут содержать остатки высших жирных кислот (простые триацилглицерины) и разные (смешанные триацилглицерины). Например:
Воски – сложные эфиры высших насыщенных и ненасыщенных монокарбоновых кислот и высших одно- или двухатомных спиртов. Спирты и кислоты содержат обычно четное число углеродных атомов (16-36). Например, пчелиный воск имеет формулу:
 С– (СН С– (СН  ) )  – С – ОСН – С – ОСН  – (СН – (СН  ) )  – СН – СН 
 Сложные омыляемые липиды Сложные омыляемые липиды
1.
 Фосфолипиды Фосфолипиды
1.1. Глицерофосфолипиды. Общим структурным компонентом является фосфатидная кислота:
Примеры глицерофосфолипидов:
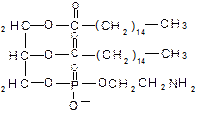 
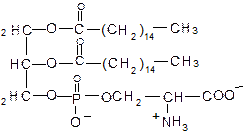 
Фосфатидилэтаноламин и фосфатидилхолин – главные липидные компоненты мембран клеток. Фосфатидилсерин является предшественником в синтезе этих соединений. Фосфатидилинозит(ол) входит в состав клеточных мембран животных, высших растений, различных микроорганизмов; особенно велико его содержание в миелиновых оболочках нервных волокон. 1.2 Сфингофосфолипиды. Они отличаются от глицерофосфолипидов тем, что содержат вместо глицерина ненасыщенный двухатомный спирт сфингозин:
Самыми распространенными сфингофосфолипидами являются сфингомиелины. Их характеризует наличие фосфохолина или фосфоэтаноламина в полярной голове. Сфингомиелины присутствуют в большинстве мембран животных клеток, особенно много их в миелиновых оболочках определенного типа. Пример сфингомиелина:
   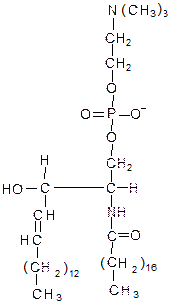
2.
 Гликолипиды Гликолипиды
2.1 Глицерогликолипиды (гликозилдиацилглицерины). В качестве углеводного компонента чаще всего встречается D-галактоза или D-глюкоза. Гликозилдиацилглицерины содержат один или два остатка моносахарида, связанного с ОН-группой глицерина β-гликозидной связью.
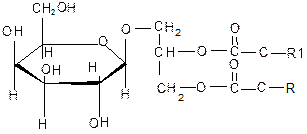
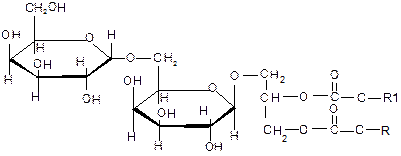
Глицерогликолипиды были выделены из листьев растений. В животных тканях не обнаружены. 2.2
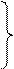
Галактоцереброзиды содержатся главным образом в мембранах клеток мозга, а глюкоцереброзиды, полярная голова которых представлена D-глюкозой, присутствуют в мембранах других (не нервных) клеток. Наиболее сложные сфингогликолипиды – ганглиозиды. Их очень крупные полярные головы образованы несолькими остатками сахаров: D-глюкозы, D-галактозы, N-ацетилглюкозамина, N-ацетилнейраминовой кислоты. Пример ганглиозида:


Из-за наличия N-ацетилнейраминовой кислоты все ганглиозиды являются кислыми соединениями. Ганглиозиды в больших количествах находятся в нервной ткани. В сером веществе мозга ганглиозиды составляют ~6% мембранных липидов. Они активно участвуют в контроле и регуляции межклеточных контактов рецепции ряда пептидных гормонов и некоторых токсинов. Неомыляемые липиды 1. Стероиды – жирорастворимые вещества, молекулы которых содержат 4 конденсированных кольца (стеран или циклопентанпергидрофенантрен):

Наиболее распространенными стероидами являются стеролы, т.е. стероидные спирты. Основной стерол в животных тканях – холестерин (ол). (С
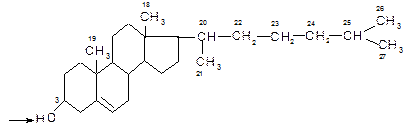
Холестерин и его эфиры с высшими жирными кислотами являются важными компонентами наружных клеточных мембран животных организмов и липопротеинов плазмы крови. В мембранах растений содержится стигмастерин (ол), который отличается от холестерина 22 и 23 углеродными атомами.
Классификация нуклеаз
Примеры нуклеаз: I. Эндонуклеазы 1) ДНК-аза-I. Ускоряет гидролиз внутренних фосфоэфирных связей между остатком фосфата и 3’-углеродным атомом дезоксирибозы.

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 585; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.017 с.) |

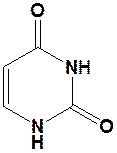
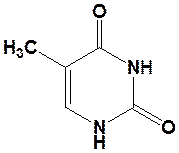

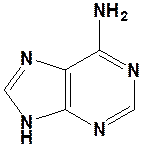
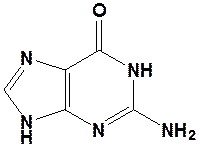

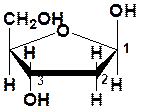

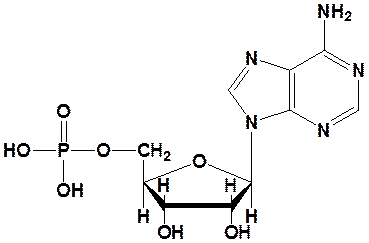
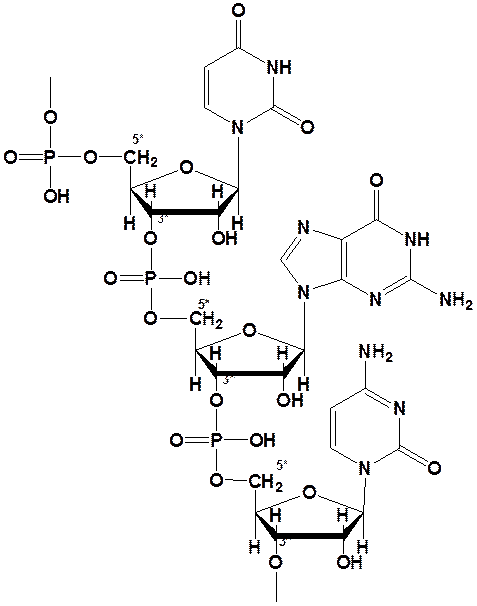
 и ее схема
и ее схема
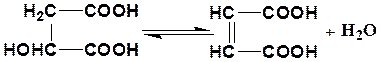 L–малат – гидролиаза
L–малат – гидролиаза

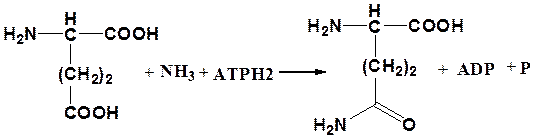 L-глутамат: NH3 – лигаза (АДФ)
L-глутамат: NH3 – лигаза (АДФ)
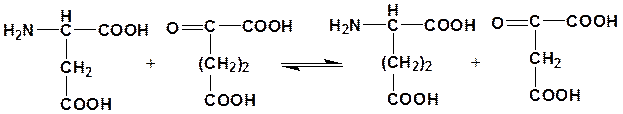 L-аспартат: a-кетоглутарат – аминотрансфераза
L-аспартат: a-кетоглутарат – аминотрансфераза



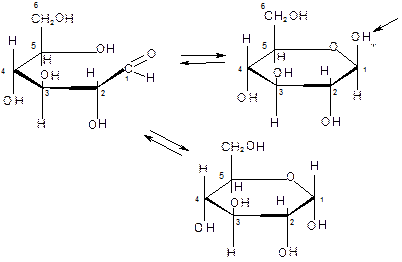
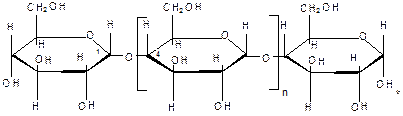


 Н
Н  СООН) – 18:1 (9) означает, что в ее состав входит 18 атомов углерода и имеется одна двойная связь, расположенная между 8 и 9-ым атомами углерода.
СООН) – 18:1 (9) означает, что в ее состав входит 18 атомов углерода и имеется одна двойная связь, расположенная между 8 и 9-ым атомами углерода. Н
Н  СООН пальмитиновая 16:0
СООН пальмитиновая 16:0 СООН стеариновая 18:0
СООН стеариновая 18:0 Н
Н 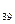 СООН арахиновая 20:0
СООН арахиновая 20:0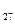 СООН линоленовая 18:3 (9,12,15)
СООН линоленовая 18:3 (9,12,15)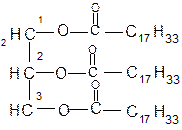



 О
О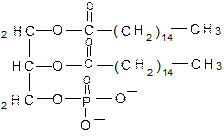
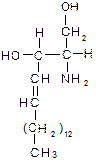

 Сфингогликолипиды. Содержат в своем составе сфингозин, остаток высшей жирной кислоты и один или несколько остатков углеводов. В зависимости от их числа различают цереброзиды и ганглиозиды. Например, галактоцереброзид имеет формулу:
Сфингогликолипиды. Содержат в своем составе сфингозин, остаток высшей жирной кислоты и один или несколько остатков углеводов. В зависимости от их числа различают цереброзиды и ганглиозиды. Например, галактоцереброзид имеет формулу: О):
О):


