
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Распад пиримидиновых основанийСодержание книги Поиск на нашем сайте
а) сначала дезаминирование у тех оснований, где есть NН

б) затем происходит восстановление

в) затем происходит гидролиз дигидроурацила:

В случае тимина вместо β-аланина образуется β-аминомасляная кислота. CO
7. Распад белков. Главный путь распада белков в живых организмах – гидролиз (протеолиз) осуществляется ферментами из класса гидролаз. При совместном действии эндопептидаз (пепсин, трипсин, химотрипсин), экзопептидаз (карбоксипептидаза, лейцинаминопептидаза) и дипептидазы из белков образуются аминокислоты.
 7.1. Распад аминокислот 7.1. Распад аминокислот
  CH CH

1. Распад по аминогруппе включает функционально связанные процессы: дезаминирование и переаминирование. В живых организмах описаны 4 вида дезаминирования, но преобладающим является окислительное дезаминирование, локализованное в матриксе митохондрий клеток печени, почек, слабее – в мышцах.
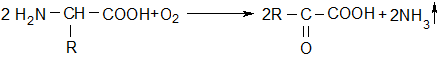
Реакция описана в 1935 г. Г. Кребсом. Из оксидоредуктаз наибольшей активностью обладает глутаматдегидрогеназа, когда субстратом реакции является L-глутамат. Окислительное дезаминирование идет в 2 стадии.
А)

Б)

Итак, из всех природных аминокислот легко подвергается окислительному дезаминированию только L-глу; остальные аминокислоты сначала превращаются в L-глу путем реакции переаминирования с α-кетоглутаратом:

Поэтому смысл реакции переаминирования в ее коллекторной функции: аминогруппы большинства аминокислот собираются в единой форме – в виде L-глу, которая затем подвергается окислительному дезаминированию. Реакция переаминирования открыта в 1937 году Браунштейном и Крицманом. 2. Распад по карбоксильной группе включает 2 пути:

Б) образование аминоациладенилата (см. биосинтез белков).

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 311; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.249.63 (0.007 с.) |

 - группа:
- группа: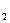 беспрепятственно выводится, NH
беспрепятственно выводится, NH  токсичен для животных, он обезвреживается в орнитиновом цикле.
токсичен для животных, он обезвреживается в орнитиновом цикле.



