Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 6. Свойства ферментовСодержание книги Поиск на нашем сайте
Оборудование, реактивы: баня водяная, пробирки химические, пипетки на 1, 2 и 5 мл; палочки стеклянные, пластинки стеклянные, бюретки прямые с краном на 50 мл, крахмал (1%-ный, 0,5%-ный, 1%-ный в хлориде натрия 0,3%-ном), соляная кислота (10%-ная), йод (0,3%-ный в йодиде калия 3%-ном), гидроксид натрия (10%-ный), сульфат меди (1%-ный и 3%-ный), тростниковый сахар (2%-ный), препарат дрожжевой сахарозы (1%-ный), фелингова жидкость, дигидрофосфат калия (115 М), гидрофосфат натрия (115 М).
Материалы: слюна разбавленная (см. Работу 4), слюна неразбавленная профильтрованная. Ход работы 1. Сравнение действия неорганических катализаторов и ферментов. В три пробирки наливают по 5 мл 1%-ного раствора крахмала. В первую пробирку добавляют 1 мл дистиллированной воды, во вторую ‑ 1 мл 10%-ной соляной кислоты, а в третью - 1 мл неразбавленной слюны. Пробирки 1 и 3 после перемешивания помещают в водяную баню при 380С, а пробирку 2 - в кипящую водяную баню. Через 15 ‑ 20 мин. все пробирки вынимают из водяной бани и из каждой берут пробы для определения в них крахмала и глюкозы: первой ‑ по реакции с йодом, второй - по реакции Троммера. Стеклянной палочкой наносят по капле раствора из каждой пробирки на стеклянную пластинку рядом с ранее нанесенной каплей раствора йода в йодиде калия, после чего капли соединяют и перемешивают. По интенсивности окраски пробы делают заключение о степени гидролиза крахмала. Для определения глюкозы из каждой пробирки берут по 3 мл раствора, добавляют 1 мл 10%-ного раствора гидроксида натрия и несколько капель 1%-ного раствора сульфата меди. Верхний слой жидкости нагревают до кипения. Появление желтого осадка оксида меди (I) или красного металлической меди указывает на наличие глюкозы. Результаты опыта заносят в таблицу:
Таблица 2
2. Специфичность действия амилазы (a-1,4-глюкан-4-глюкано-гидролаза; КФ 3.2.1.1.) и сахаразы (b-D-фруктофуранозид-фрукто-гидролаза; КФ 3.2.1.26). Нумеруют четыре пробирки. В пробирки 1 и 2 наливают по 2 мл раствора крахмала, в пробирки 3 и 4 ‑ по 2 мл раствора сахарозы. Затем в пробирки 1 и 3 вносят по 0,5 мл разбавленного раствора слюны, в пробирки 2 и 4 ‑ по 0,5 мл раствора препарата дрожжевой сахаразы. Перемешивают содержимое и ставят на 10 минут в водяную баню, нагретую до 38 ‑ 400С. После охлаждения проделывают реакции (см. Работу 4) с йодом на присутствие крахмала в пробах 1 и 2 и глюкозы ‑ в пробах 3 и 4. Делают заключение о специфичности изученных ферментов.
3. Влияние температуры на активность амилазы слюны. В четыре пронумерованные пробирки наливают по 2 мл 1%-ного р-ра крахмала. Пробирку 1 помещают в кипящую водяную баню, пробирку 2 - в водяную баню при 400С, пробирку 3 оставляют при комнатной температуре и пробирку 4 помещают в лед. Через 10 мин., когда содержимое пробирок примет заданную температуру, во все пробирки добавляют по 0,5 мл разбавленной слюны, перемешивают с помощью стеклянной палочки и оставляют в тех же условиях. Наблюдение за ходом гидролиза ведется по реакции с йодом. Для этого наносят на стеклянную пластинку несколько капель раствора йода и смешивают их с каплями гидролизуемой смеси, беря пробы через 1, 2, 4, 6, 8, 10 и 12 мин. По изменению окраски крахмала с йодом судят о степени гидролиза крахмала в каждой пробирке. Результаты наблюдений заносят в таблицу, помечая буквой с (синяя окраска) положительную пробу с йодом на крахмал, буквой к ‑ положительную пробу на декстрины (окраска красных тонов) и буквой ж ‑ отрицательную пробу (желтая окраска йода).
Таблица 3
На основании полученных данных делают вывод о величине температурного оптимума для амилазы слюны.
4. Влияние рН на активность ферментов. Серии растворов с определенными значениями рН получают, используя фосфатный буфер. Две бюретки заполняют 115 М раствором гидрофосфата натрия (Na2HPO4 ´ 2H2O) и 115 М раствором дигидрофосфата калия (КН2РО4). Растворы смешивают в определенных соотношениях таким образом, что в каждой пробирке получают по 5 мл буферной смеси с величинами рН: 5,59; 6,98; 7,38; 8,04. Для получения 5 мл фосфатной буферной смеси с рН 5,59 из бюреток к 0,25 мл Na2HPO4 добавляют 4,75 мл раствора КН2РО4; В каждую из четырех пробирок добавляют по 1 мл 0,5%-ного раствора крахмала, 1 мл разбавленной слюны и тщательно перемешивают содержимое с помощью стеклянной палочки. Далее все пробирки, не вынимая из них стеклянных палочек, помещают в водяную баню, нагретую до 400С. Спустя 3 - 5 мин. из всех пробирок палочками наносят на стеклянную пластинку по капле смеси рядом с предварительно уже нанесенными на нее каплями раствора йода. Капли соединяются, и, если наблюдается различие окраски с йодом в испытуемых пробах, пробирки вынимают из бани, охлаждают и добавляют в каждую по 3 - 4 капли раствора йода. При отсутствии заметного различия в окраске проб с йодом на стеклянной пластинке продолжают нагревание пробирок в водяной бане еще несколько минут, а затем вновь испытывают на пластинке пробы на степень расщепления крахмала. Эту операцию повторяют до тех пор, пока не произойдет заметных сдвигов в окраске проб с йодом. Продолжают инкубацию всех проб в присутствии добавленного йода и для каждой из них отмечают время, когда исчезнет синее окрашивание (конец амилолитического расщепления). Полученные результаты отражают графически: по оси абсцисс наносят рН опытов, а по оси ординат - время расщепления крахмала при соответствующих значениях рН. Соединяя точки линией, получают кривую, характеризующую зависимость активности фермента от значения рН среды.
5. Действие активаторов и парализаторов на амилазу слюны. В штативе располагают тремя рядами 36 пробирок и нумеруют их в каждом ряду. Во все пробирки вливают из бюретки по 1 мл воды, а затем в первые пробирки каждого ряда ‑ по 1 мл профильтрованной неразбавленной слюны. Содержимое пробирок хорошо перемешивают. Далее в каждом ряду 1 мл смеси из пробирки 1 переносят в пробирку 2, перемешивают, снова набирают 1 мл смеси и переносят в пробирку 3, и так вплоть до пробирки 12, из которой после перемешивания выливают 1 мл жидкости. Во все пробирки первого ряда наливают по 1 мл воды (контрольный ряд), в пробирки второго ряда ‑ по 1 мл р-ра хлорида натрия и в пробирки третьего ряда ‑ по 1 мл р-ра сульфата меди. Далее во все пробирки наливают из бюретки по 2 мл р-ра крахмала в следующем порядке: сначала в первые номера всех рядов, потом во вторые, и т.д. Содержимое перемешивают и ставят штатив в термостат при 400С на 15 мин. По охлаждении в каждую из них добавляют по капле р-ра йода и отмечают в каждом ряду номер пробирки, в которой реакция с йодом отрицательна. Деля степень разведения контрольной пробы, в которой реакция с йодом отрицательна, на степень разведения соответствующих проб с исследуемыми эффекторами, вычисляют, во сколько раз активатор (NaCl) или ингибитор (CuSO4) стимулирует или тормозит действие амилазы слюны.
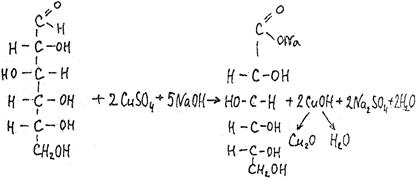
Работа 7. Качественные реакции на углеводы Оборудование, реактивы: пипетки на 1, 2 и 5 мл; пробирки химические; баня водяная; 1-нафтол (10%-ный спиртовой); серная кислота (конц.); гидроксид натрия (10%-ный); сульфат меди (5%-ный); реактив Фелинга; реактив Селиванова; раствор Люголя. Материалы: глюкоза, мальтоза, сахароза, фруктоза, крахмал, гликоген (1%-ные растворы). Ход работы 1. Реакция Подобедова - Молиша с 1-нафтолом (на углеводы). В пробирку берут 1 мл испытуемого раствора или крупинку твердого вещества, растворенного в 1 мл воды, добавляют 2 капли 10%-ного спиртового раствора 1-нафтола и по стенке пробирки приливают осторожно, без встряхивания, 2 мл конц. серной кислоты. Серная кислота опускается на дно пробирки, на границе двух жидкостей образуется кольцо красно-фиолетового цвета. Фурфурол и 5-оксиметилфурфурол, образующиеся из углеводов под действием серной кислоты, конденсируясь с двумя молями сульфинированного 1-нафтола, дают триарилметановый хромоген, который окисляется серной кислотой в окрашенное хиноидное соединение. 2. Реакция Троммера. В пробирку наливают 1 - 2 мл раствора глюкозы и равный объем 10%-ного раствора гидроксида натрия. К смеси прибавляют при встряхивании по каплям 5%-ный раствор сульфата меди (II). Осторожно нагревают верхнюю часть содержимого пробирки. Появляется желтое окрашивание - гидроксид меди (I), переходящее в красное - оксид меди (I), что указывает на положительную реакцию Троммера:
Реакцию Троммера проделывают с растворами мальтозы, сахарозы и крахмала. Избыток медной соли маскирует реакцию, так как гидроксид меди (II) при нагревании теряет воду и дает черный осадок оксида меди (II). В выводе укажите, для каких углеводов проба Троммера положительна, и с чем это связано.
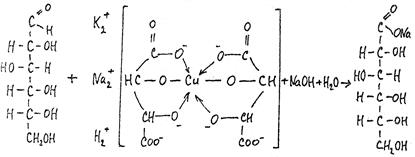
3. Реакция с фелинговой жидкостью. Нередко пользуются так называемой фелинговой жидкостью, в которой ион меди в степени окисления +2 находится в виде комплексного соединения с тартратами. Механизм реакции редуцирующих углеводов с фелинговой жидкостью такой же, как и реакции Томмера. Преимущество фелинговой жидкости: медь при избытке реактива не выпадает в виде оксида меди (II). К 1 - 2 мл раствора глюкозы приливают равный объем фелинговой жидкости и смесь нагревают до начинающегося кипения. Образуется красный осадок оксида меди (I).
Проделывают реакцию фелинговой жидкости с растворами мальтозы, сахарозы и крахмала. Какие 4. Реакция Селиванова на кетозы. При нагревании фруктозы (и других кетогексоз) с соляной кислотой образуется оксиметилфурфурол, который с резорцином образует соединение, окрашенное в вишнево-красный цвет.
Альдозы также дают эту реакцию, но она протекает медленнее и в особых условиях (температура и кислотность среды). В две пробирки наливают по 3 мл раствора Селиванова, в одну из них прибавляют 3 капли раствора глюкозы, в другую 3 капли раствора фруктозы. Обе пробирки помещают в водяную баню, нагретую до 800С, и держат в ней 8 мин. За это время в пробирке с фруктозой появляется красное окрашивание. 5. Реакция крахмала и гликогена с йодом. К 1 - 2 мл раствора крахмала прибавляют 1 - 2 капли раствора Люголя. Раствор окрашивается в синий цвет. Во 2-ю пробирку наливают 1-2 мл раствора гликогена, добавляют 1 - 2 капли раствора Люголя, перемешивают, появляется красно-бурое окрашивание. Различия в цвете комплексов йод-крахмала и йод-гликогена свидетельствует о различии структур крахмала и гликогена. Работа 8. Характерные реакции на На липиды. Оборудование, реактивы: баня водяная; пробирки; пипетки на 1, 2 и 5 мл; фарфоровые чашки; пробирки широкие с пробками, в которые вставлены воздушные холодильники; петролейный эфир; бензин; хлороформ; четыреххлористый углерод; спирт; эфир; едкий калий (5%-ный); раствор куриного белка; раствор мыла; карбонат натрия (5%-ный); спиртовой раствор едкого калия; соляная кислота (конц.); хлористый кальций (5%-ный раствор); свинец уксуснокислый (10%-ный раствор); бисульфат калия (крист.); натрий хлористый (крист.); фенолфталеин. Материалы: масло растительное, масло сливочное. Ход работы 1. Растворимость жиров. В 8 пробирок поместить по 1 - 2 капли подсолнечного масла, после чего прибавить в них последовательно по 2 - 3 мл растворителя: в первую - дистиллированную воду, во вторую - петролейный эфир, в третью - бензин, в четвертую - хлороформ, в пятую - четыреххлористый углерод, в шестую и седьмую - спирт, в восьмую - эфир. Взбалтыванием хорошо перемешать содержимое каждой пробирки, шестую или седьмую нагреть. Записать, какие из испытанных веществ являются растворителями жиров.
2. Эмульгирование жиров. Жиры при взбалтывании с водой образуют эмульсию, представляющую собой дисперсную систему, в которой мелкие капли жира взвешены в воде. Эмульсия масла в воде неустойчива, в спокойном состоянии наступает быстрое расслаивание, мелкие капли жира в процессе столкновения друг с другом соединяются в более крупные, переходящие далее в слой масла на поверхности воды. Чтобы придать стойкость эмульсии в воде. Необходимо введение ряда веществ, способных в результате адсорбции на поверхности шарика эмульгированного вещества уменьшить поверхностное натяжение масла, в результате чего происходит снижение поверхностной энергии и эмульсия приобретает устойчивость. Вещества, снижающие поверхностную энергию, называются эмульгаторами. Склонность некоторых веществ к образованию эмульсий важна как в биологическом, так и народнохозяйственном отношении. К числу природных эмульсий относятся молоко, лимфа, латекс (каучуки). Вещества, находящиеся в организмах животных и растений, свободно перемещаются совместно с током жидкости. Жиры, находящиеся в кишечнике в виде эмульсий, характеризуются большой поверхностью, способствующей более энергичному воздействию на них ферментов. Взять в 5 пробирок по равному количеству подсолнечного масла (4 - 5 капель), прилить в первую из них 5 мл дистиллированной воды, а в остальные прилить по 5 мл: во вторую - 5%-ный раствор КОН, в третью - 5%-ный раствор соды, в четвертую - раствор мыла, в пятую - раствор белка. Содержимое пробирок сильно встряхнуть и наблюдать степень стойкости возникших эмульсий во взятых пробирках. Результаты наблюдений занести в журнал.
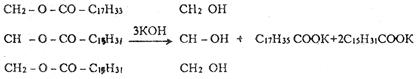
3. Омыление жиров. Жиры в присутствии щелочи подвергаются гидролизу, при этом образуется мыло и глицерин:
В широкую пробирку с 0,5 - 1 г масла прилить 5 мл спиртового раствора КОН. Содержимое перемешать, закрыть пробирку пробкой, в которую вставлен воздушный холодильник, и нагревать в течение 30 мин. После гидролиза содержимое пробирки перелить в фарфоровую чашку, прибавить 10 мл дистиллированной воды и осторожно нагреть для удаления спирта.
4. Реакции свободных жирных кислот. Содержимое фарфоровой чашки разделить на 3 части (по 2-3 мл в каждую из 3-х пробирок. - Образование нерастворимых кальциевых солей: в пробирку с 2 - 3 каплями калийного мыла (ранее отлитого в пробирку из фарфоровой чашки) прилить 5%-ный раствор хлорида кальция, образуются нерастворимые в воде кальциевые мыла жирных кислот (написать уравнение реакции). - Высаливание мыла: в другую пробирку с 2 - 3 мл раствора мыла прибавить порошок хлористого натрия, происходит осаждение - высаливание мыла. - Образование свинцового пластыря: в третью пробирку с 3 мл раствора мыла прилить несколько капель 10%-ного раствора ацетата свинца. Образуется осадок, который при нагревании делается вязким (свинцовый пластырь).
5. Акролеиновая реакция. Эта реакция используется с целью доказательства наличия в жирах глицерина, который при нагревании разлагается с образованием акролеина (акрилового альдегида). Взять в пробирку 2 - 3 капли масла, прибавить кристаллик бисульфата калия и нагреть, при этом образуется акролеин в виде белого пара с характерным резким запахом горелого сала.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ_________________________________________________3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 327; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.81.255 (0.007 с.) |