
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы саморегуляции системСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте Функционируют по принципу обратной связи. Обратная связь – это понятие, обозначающее влияние выходного сигнала системы на ее рабочие параметры. Различают положительную и отрицательную. "–" чаще встречается в биосистемах, направлена на снижение влияния выходного сигнала на рабочие параметры системы. "+" усиливает влияние выходного сигнала, в результате чего система может выходить из данного состояния. Гомеостаз – постоянство многих параметров.
18. Организм и клетка как химическая машина. Химический потенциал живой системы. Метаболический цикл – это открытая система последовательных р-ций, в ходе которых поступающий субстрат перерабатывается таким и происходит регенерация исходного продукта. Такой цикл можно рассматривать как «химическую машину», совершающую работу по превращению одних видов веществ и Е в другие. Увеличение энтропии, сопровождающее внутренние процессы в этой химической машине, определяется измерением суммарного потенциала системы и внешней среды, взятым с обратным знаком, и равно TdiS = -d(G + G*), где G — термодинамический потенциал системы, a G* — термодинамический потенциал внешней среды, за счет поступления продуктов из которой «работает» химический цикл. После совершения одного оборота цикла через время t система вновь вернется в первоначальное состояние, а =>, через время t dG = 0. При этом для внешней среды dG* <> 0, так как именно за счет взаимодействия с внешней средой и совершился оборот цикла с произведенной им за это время работой. Хим. потенциал — величина, определяющая ТД характеристику не системы в целом, а одной м-лы в этой системе. Если добавлять в систему м-лу за м-лой при постоянном давлении, то на добавление каждой новой частицы надо затратить в точности ту же работу, что на добавление любой предыдущей: объем системы будет расти, а плотность системы — и интенсивность взаимодействий в ней — меняться не будет. Поэтому ТД состояние м-лы в системе удобно определять величиной свободной энергии Гиббса G, деленной на число молекул N, µ= G/N Молекулы перетекают из той фазы, где их хим. потенциал выше, в ту, где их хим. потенциал ниже, — это понижает общую свободную энергию системы и приближает ее к равновесию. А в равновесии хим. потенциал мо-л в одной фазе равен хим. потенциалу тех же м-л в другой фазе.
19.Критерии спонтанности, самопроизвольности протекания процессов в ТД системах. Критерий устойчивости стационарного состояния – в виде положительного характера величины избыточной продукции энтропии при небольшом возмущении системы. Отрицательный характер этой величины указывает на неуст. стац. (особой) точки. Вблизи равновесия критерий устойч. > 0 совпадает с теоремой о минимуме продуцирования энтропии в стационарном состоянии. Что касается ТД критериев эволюции открытых систем, то эта задача решена только для состояний, близких к равновесию. Именно в этой области монотонное уменьшение скорости продуцирования энтропии < 0 и служит критерием самопроизвольного стремления к устойчивому стационарному состоянию. Обратимый ТД процесс - процесс перехода одного состояния системы в другое, если обратный переход не связан с некомпенсированным превращением E в А. Процесс перехода одного состояния системы в другое называется необратимым, если обратный переход связан с необходимостью E из вне. Биохим. р-ция обратима, если можно осуществить в прямом и обратном направлении (даже если Е из окружающей среды). Любой ТД обратимый процесс стремится к состоянию ТД равновесия, т.е. к наиболее деградирующему состоянию. Б\х обратимый процесс - стремится к равновесию, но не достигает его. Скорость прямой реакции =скорости обратной реакции. Формальный признак обратимости - время. Если для к-л процесса знак + можно заменить на знак - перед параметром времени (например, если t^2), то процесс обратим. Если t зависит от знака, то данный процесс является необратимым. По знаку и величине ТД потенциала можно судить о направленности процесса, если в результате процесса величина ТД потенциалов уменьшается, такой процесс является самопроизвольным, идет с выделением энергии и называется экзергоническим, если т/д потенциалы увеличивается, то процесс идет не самопроизвольный, требует притока энергии извне и называется эндергоническим.
20.Применение ТД в биологии: методы расчёта стандартной и реальной свободной энергии биохимических процессов. Свободная энергия Гиббса и Гельмгольца. Энергия – мера определённой формы движения материи. Является произведением фактора экстенсивности на интенсивность. Расчёт ТД параметров для ТД систем: ТД параметра в биолог. сист. всего 3: Z, H, S. только для обратимых процессов в состоянии равновесия: dZ =∆G =dH – TdS, ∆H=-dQ. dlnK/dT = - (∆Q/RT2). Н – энтальпия, Z (G) - ТД потенциал – свободная Е при постоянном давлении и t. dG0 – свободная Е = Е Гиббса, если все исходные в-ва и продукты р-ции определяются при 250С, это табличное значение. ∆Z=∆Z0+RTlnK, где К – это константа скорости биохим. р-ции; ∆Z0 – стандартный ТД потенциал (справочная величина); R – универсальная газовая постоянная. Свободная Е Гельмгольца (F) – часть Е, кот. полностью переходит в работу. Энергия: 1) высшая (механич, хим, электрич.); 2) тепловая или деградированная. TdS = dU + dA -dA = d (U - TdS) F=UTS – это свободная энергия Гельмгольца. dF = dU – TdS – это запись 2 закона ТД ч/з свободную Е Гельмгольца. Если V, T = const, то pdV=0, то dWmax=TdS-dU=-d(U-TS)=-dF; F=U-TS – термодинамический потенциал Гельм-Гольци или свободная энергия Гельм-Гольца. Если P, T = const, то dWmax=-d(U+pdV-TS)=-dG; G – т/д потенциал Гиббса или свободная энергия Гиббса В реальных условиях редко Р постоянно, а V системы изменяется, следовательно величины т/д потенциалов совпадают. Выполнение полезной работы при выполнении необратимого процесса всегда сопровождается рассеянием энергии, величину которой определяет произведением TdS, чем больше эта величина, тем более необратимым является процесс. По знаку и величине ТД потенциала можно судить о направленности процесса, если в результате процесса величина ТД потенциалов уменьшается, такой процесс является самопроизвольным, идет с выделением энергии и называется экзергоническим, если т/д потенциалы увеличивается, то процесс идет не самопроизвольный, требует притока энергии извне и называется эндергоническим. При достижении равновесия ТД потенциалы стремятся к минимальному значению. Процессы превращений энергии и совершения работы могут протекать до тех пор пока свободная энергия не станет равна нулю, а энтропия максимальной. Такое состояние носит названия ТД равновесия. Такое состояние в неживой природе является конечным состоянием, в направлении которого эволюционируют все ТД системы.
21. Потенциал переноса атомных группировок в различных трансферазных реакциях. ТРАНСФЕРАЗЫ, класс ферментов, катализирующих перенос фрагментов м-л (напр., метила, ацетила, гликозила) с одного соед. (донора) на др. соед. (акцептор). Во мн. случаях промежут. донором является кофермент, присоединяющий группу, подлежащую переносу. Подклассы Т. (их 8) различают по характеру групп, переносимых на акцептор. К подклассу Т., кат-щих перенос одноуглеродных фрагментов, относятся метил-трансферазы, Т. гидроксиметильных, формальных и др. родственных групп, карбоксил- и карбамоилтрансферазы и др. Перенос группы СН3 осущ-ся, напр., с 5-метил-тетрагидрофолиевой к-ты на гомоцистеин HSCH2CH2CH(NH2)COOH на последней стадии биосинтеза метионина. Универсальный донор групп СН3 при трансметилировании - S-аденозилметионин - субстрат метил-трансфераз, модифицирующих нуклеиновые к-ты; эти ферменты играют важную роль в функционировании генетич. аппарата клетки. Известны также Т., кат-щие метилирование жирных к-т, ненасыщ. фосфолипидов, полисахаридов и др. Многие Т., кат-щие перенос гидроксиметильных и формильных остатков (напр., серин-гидрокси-метилтрансфераза), содержат в качестве кофермента пирид-оксальфосфат. Универсальные доноры в этих р-циях-5,10-метилен- или 5-формилтетрагидрофолиевая к-та. Донор карбамоильного остатка для многих Т.-карбамоилфосфат (HO)2P(O)OC(O)NH2 (метаболит в биосинтезе уридиновой к-ты и аргинина). Наиб. Исследованный фермент этого подкласса - аспартат-карбамоилтрансфераза, катализирующая биосинтез К-карбамоил-L-аспарагиновой к-ты (осн. метаболита в синтезе пиримидиновых оснований). В отдельный подкласс объединяют Т., кат-щие перенос альдегидных и кетонных групп (фрагментов молекул углеводов). В него входит, напр., транскетолаза, переносящая фрагмент НОСН2С(О) в пентозофосфатном цикле. Подкласс Т. составляют ацилтрансферазы, кат-ющие перенос ацильной группы с образованием эфиров и амидов. Донором в этих р-циях обычно является ацилкофермент А (Пантотеновая кислота). Р-ции, кат-емые этими Т., наиб. характерны для метаболизма жирных к-т. Акцепторами ацетила (донор ацетилкофермент А) м. б. аминокислоты, глюкозамин, остаток фосфорной к-ты и др. Нек-рые Т. этого подкласса при трансляции в качестве донора используют аминоацил-транспортную РНК. Пример Т. этого подкласса-фосфатацетилтрансфераза, кат-ющая перенос ацетила на фосфорную к-ту с образованием ацетилфосфорной к-ты. К отдельному подклассу относят Т., кат-ющие перенос гликозильных остатков (гликозилтрансферазы). Нек-рые из этих Т. обладают также гидролитич. активностью, к-рая может рассматриваться как перенос гликозильного остатка на молекулу воды. Акцептором может служить также Н3РО4 в случае фосфорилаз. Наиб. распространен перенос остатка углевода от олигосахаридами богатого энергией метаболита на др. молекулу углевода. К наиб. изученным Т. этого подкласса можно отнести ферменты синтеза гликогена [напр., гликоген (крахмал)синтетазу и галоктозилтрансферазу]. В отдельный подкласс объединяют Т., катализирующие перенос алкильных групп (отличающихся от СН3), как замещенных, так и не замещенных. Хорошо изученные Т. этого подкласса-глутатионтрансферазы, катализирующие перенос разл. остатков на глутатион, а также метионин-аденозил- и енолпируват-трансфераза. Отдельно рассматривают подкласс Т., катализирующих перенос групп, содержащих атом N. Т. этого подкласса ответственны за перенос аминогрупп. Аминотрансферазы катализируют перенос аминогруппы с аминокислот на 2-оксокислоты. Эта р-ция является, по существу, окислит.-восстановительной. Однако из-за того, что осн. ф-цией этих ферментов считается перенос групп NH2, они классифицируются как Т., а не как оксидоредуктазы. Наиб. изученный фермент этого подкласса-аспартатаминотрансфераза, содержащая в качестве кофермента пиридоксальфосфат. Важный подкласс Т.- ферменты, катализирующие перенос групп, содержащих атом P (этот подкласс наз. киназами). Большинство ферментов этого подкласса относятся к фос-фотрансферазам, катализирующим перенос остатка фосфорной к-ты на разл. акцепторы. Так, гексокиназа катализирует перенос остатка фосфорной к-ты с АТФ на группу ОН D-гексозы, 3-фосфоглицераткиназа-с АТФ на карбоксильную группу 3-фосфо-D-глицериновой к-ты. Т. этого подкласса катализируют также перенос нуклеотидных фрагментов (нуклеотидилтрансферазы); напр., РНК-полимеразы осуществляют перенос остатковрибонуклеотидов при синтезе РНК. Среди Т. этого подкласса известны также ферменты, катализирующие перенос остатка Н3РО4 с регенерацией донора (р-ции кажущегося внутримол. переноса); напр., фосфоглюкомутаза переносит остаток этой к-ты с a-D-глюкозо-1,6-дифосфата на a-D-глюкозу-1-фосфат с образованием a-D-глюкозо-6-фосфата и молекулы исходного донора. В подкласс Т. объединены также ферменты, катализирующие перенос фрагментов, содержащих атом S (напр.,арилсульфотрансфераза катализирует перенос сульфогруппы на производные фенола).
21.Понятие макроэргической связи. Характеристика АТФ как универсального аккумулятора энергии в биосистемах. Макроэргические связи – связь при разрыве которой выделяется порядка 8-9 ккал. При их гидролизе выделяется от 20тыс Дж. Самые макроэргические соединения: 1) ацетиладенилат – 62,5 кДж; 2) фосфоенолпируват – 61 кДж; 3) 1,3-дифосфоглицерат 54,5 кДж; 4) карбомоилфосфат 51,5 кДж; 5) ацетилфосфат 47,5 кДж; 6) ацетилкоэнзим А – 35-48кДж; 7) S-аденозинметионин 44 кДж; 8) креатинфосфат 42,5 кДж; 9) АТФ 35 кДж; 10) пирофосфат 32,5 кДж. Макроэргические соединения – характ-ся наличием фосфатных групп. Энергия, освобождающаяся при отщеплении фосфатных групп, может исп-ся для синтеза биоважных веществ с повышенным запасом свободной энергии и для процессов жизнедеятельности, связанных с превращением свободной хим. Е в работу (механич., активного переноса в-в, электрическую и т.д.). Важнейшим из этих соединений является аденозинтрифосфорная кислота — АТФ. Нуклеотидный кофермент аденозинтрифосфат [АТФ (АТР)] является наиболее важной формой сохр. хим. Е в клетках. Расщепление АТФ — высоко экзоэргическая реакция. Хим. Е гидролиза АТФ (ΔG) может исп-ся для сопряжения с эндоэргическими процессами, такими, как биосинтез, движение и транспорт. Другие нуклеозидтрифосфатные коферменты (ГТФ, ЦТФ и УТФ), хим. похожие на АТФ, выполняют в метаболических процессах иные функции. В АТФ цепочка из трех фосфатных остатков связана с 5'-OH-группой аденозина. Фосфатные группы обозначаются как α, β и γ. Рибоза связана с α-фосфатом фосфоэфирной связью. Три фосфатных остатка соединены между собой менее устойчивыми фосфоангидридными связями. При физиологических значениях рН АТФ несет четыре отрицательных заряда. Собственно действующим коферментом является комплекс АТФ с ионом Mg2+, координационно связанным с α- и β-фосфатом (Mg2+ ּ АТФ4-). Гидролиз АТФ: АТФ + H2O = АДФ + фосфат и сопровождается ↓ свободной Е (в клетке): dF=50 кдж/моль (12 000 кал/моль). Значения выше, чем у большинства р-ций гидролиза. При ферментативном гидролизе АТФ в клетке отщепляющаяся фосфатная группа всегда переносится на субстрат, запас Е в котором оказывается в результате больше, чем в исходном соединении. Изменение свободной энергии ΔGo' гидролиза фосфоангидридных связей в АТФ при рН 7 в станд. усл. составляет от -30 до -35 кДж/моль. Независимо от того, какая из ангидридных связей АТФ при этом расщепляется, величина ΔGo' остается практически постоянной. В клетке действительное изменение свободной энергии при гидролизе АТФ ΔG' еще гораздо выше, так как концентрации АТФ, АДФи неорг. фосфата (Рi) существенно более низки, чем в стандартных условиях, а АТФ присутствует в избытке по сравнению с АДФ. На величину ΔG' влияют также величина рН и концентрация ионов Mg2+. Предположительно в физиологических условиях Е гидролиза АТФ до АДФ и неорг. фосфата равна примерно -50 кДж/моль. Немногие соединения содержат связи с энергией гидролиза, достаточной, чтобы за счет энергетического сопряжения обеспечить синтез АТФ из АДФ и Рi (субстратное фосфорилирование). Например, синтез сахарозы из глюкозы и фруктозы происходит за счёт энергии, освобождающейся при реакции гидролиза АТФ, путём образования промежуточного активированного соединения — глюкозо-1-фосфата: 1) АТФ + глюкоза=АДФ + глюкозо-1-фосфат; 2) глюкозо-1-фосфат + фруктоза= сахароза + фосфат. Суммарная реакция: АТФ + глюкоза + фруктоза=АДФ + сахароза + фосфат. Энергетический баланс процесса: АТФ=АДФ + фосфат — 29,3 кдж/моль (—7000 кал/моль) (уменьшение свободной энергии); глюкоза + фруктоза=сахароза + 23 кдж/моль (+5500 кал/моль) (увеличение свободной энергии). Потеря энергии на тепло 6,3 кдж/моль (1500 кал/моль), т. е. КПД процесса 79%. При синтезе белков и нуклеиновых кислот от АТФ отщепляется не одна концевая фосфатная группа, а две последние (пирофосфат). Т. о., все процессы накопления (аккумулирования) энергии в организмах должны сводиться к процессам образования АТФ, т. е. фосфорилирования (включения фосфатных групп в АДФ или АМФ). Фосфоенолпируват и 1,3-дифосфоглицерат. Оба соединения являются промежуточными продуктами гликолиза. Сукцинил-КоА, гидролиз которого до сукцината сопряжен в цитратном цикле с синтезом ГТФ. Креатинфосфат, с помощью которого в мышце при необходимости может регенерироваться АТФ.
23.Причины высоких значений потенциала переноса при гидролизе ди- и полифосфатов. Разнообразие макроэргических соединений в биосистемах. В качестве меры потенциала переноса фосфатных групп у высокоэнергетических соединений произвольно выбрано изменение свободной энергии гидролиза ΔGo'. Потенциал переноса электронов такой системы (т.е. склонность системы отдавать и принимать электроны) определяется ее окислительно-восстановительным потенциалом в стандартных условиях (стандартным восстановительным потенциалом E° и соответственно Е°' при pH 7). В качестве меры химического потенциала переноса протона кислотно-основной пары служит величина рКа — отрицательный логарифм константы диссоциации кислоты Ка. Чем сильнее кислота, тем меньше ее рКа. Кислоты с небольшими pKа могут протонировать основания с высокими рКа. Самые макроэргические соединения: 1) ацетиладенилат – 62,5 кДж; 2) фосфоенолпируват – 61 кДж; 3) 1,3-дифосфоглицерат 54,5 кДж; 4) карбомоилфосфат 51,5 кДж; 5) ацетилфосфат 47,5 кДж; 6) ацетилкоэнзим А – 35-48кДж; 7) S-аденозинметионин 44 кДж; 8) креатинфосфат 42,5 кДж; 9) АТФ 35 кДж; 10) пирофосфат 32,5 кДж. Макроэргические соединения – характ-ся наличием фосфатных групп. Энергия, освобождающаяся при отщеплении фосфатных групп, может исп-ся для синтеза био важных в-в с повышенным запасом свободной энергии и для процессов жизнедеятельности, связанных с превращением свободной хим. Е в работу (механич., активного переноса в-в, электрическую и т.д.). Фосфоенолпируват и 1,3-дифосфоглицерат. Оба соединения являются промежуточными продуктами гликолиза. Сукцинил-КоА, гидролиз которого до сукцината сопряжен в цитратном цикле с синтезом ГТФ. Креатинфосфат, с помощью которого в мышце при необходимости может регенерироваться АТФ.
24.Типы энергетического обмена в биосистемах Энергетический обмен – совокупность р-ций, сопровождающийся освобождением Е. Белки - 17,6 кДж (Количество высвобожденной энергии на 1 гр.), углеводы - 17,6 кДж, жиры - 38,9 кДж. Основное значение эн. обмена в том, что при разрушении сложных орг. в-в высвобождается Е, необходимая для реакций биосинтеза. Этапы энерг. обмена: 1) Подготовительный — Проходит в ЖКТ животных и человека и пищевар. вакуолях одноклеточных организмов. Сложные орг в-ва расщепляются до простых соединений, мономеров → в кровь → претерпевают дальнейшие изменения. Расщепление в лизосомах полисахаридов до моносахаридов, жиров до глицерина и жирных кислот, белков до аминокислот, нуклеиновых кислот до нуклеотидов. Вся Е рассеивается в виде тепла.; 2) бескислородный (=гликолиз, аэробный) — окисление в-в без участия кислорода до более простых. Глюкоза расщепляется на 2 молекулы ПВК. Если гликолиз идёт в мышцах, то получается молочная кислота. Осуществление процесса на внешних мембранах митохондрий при участии ферментов. Итог: 2 м-лы АТФ, 2 ПВК (дальнейшая судьба ПВК зависит от условий: если О2 нет - брожение), 2 НАД∙Н + Н+ (источник протонов, накапливаются в перемитохондриальном пространстве), 80кДж накапливается (идет на синтез АТФ), остальная энергия рассеивается в виде тепла; 3) кислородный — (клеточное дыхание) дальнейшее превращение ПВК в условиях О2 происходит в митохондриях. Суть: полное окисление глюкозы до СО2 и Н2О. Стадии: 1) окислительное декарбоксилирование ПВК; 2) цикл Кребса = цикл трикарбоновых кислот. Итог 1 и 2: на 1 молекулу ПВК – 3 СО2 (в атмосферу), 8 НАД∙Н + Н+, 1 ФАД∙Н + Н+, 2 АТФ; 3) электрон-транспортная цепь. Условие – мембраны митохондрий не должны быть повреждены. Проходит на мембранах крист. Итог: запасается 55% энергии и 45 % рассеивается в виде тепла. 34 АТФ. Суммарное уравнение всего энергетического обмена: С6Н12О6 + 6О2 + 6Н2О + 38АДФ + 38Н3РО4 → 6СО2 + 12Н2О + 38АТФ. Сходство эн. обмена в клетках растений, животных, человека и грибов — доказательство их родства. Броже́ние — это анаэробный метаболический распад молекул питательных веществ, например глюкозы, без окисления в чистом виде. Брожение не высвобождает всю имеющуюся в молекуле энергию; оно просто позволяет продолжаться гликолизу (процесс, выходом которого на одну молекулу глюкозы являются две молекулы АТФ), восполняя восстановленные коферменты. Результатом брожения являются этанол, углекислый газ, другие продукты, а далее -молочная кислота, уксусная кислота, этилен и другие восстановленные метаболиты.
25. Типы аккумуляции и пути расходования энергии в биосистемах. ТД сопряжение экзэргонической и эндэргонической стадии биопроцессов; примеры. В процессе энергетического метаболизма происходит аккумуляция энергии, полученной в результате окислительно-восстановительных превращений субстратов в такую форму, которая может быть использована для роста клеток и осуществления всех их функций. Основными типами аккумуляции энергии в клетки являются: 1. трансмембранная разность электрохимических потенциалов ионов. 2. макроэргические химические соединения. Поступление веществ в организм происходит в результате дыхания (кислород) и питания. В ЖКТ продукты питания расщепляются до простых веществ. При расщеплении происходит гидролиз полимеров (белков, полисахаридов и других сложных органических веществ) до мономеров, всасывающихся в кровь и включающихся в промежуточный обмен. Промежуточный обмен (внутриклеточный метаболизм) включает 2 типа реакций: катаболизм и анаболизм. 1. Катаболизм - процесс расщепления органических молекул до конечных продуктов. Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции). 2. Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции). Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для реакций окисления. В результате этих реакций происходит освобождение энергии, которая необходима организмам в процессах жизнедеятельности для осуществления различных видов работы. Живые организмы с точки зрения термодинамики - открытые системы. Между системой и окружающей средой возможен обмен энергии, который происходит в соответствии с законами термодинамики. · Первый закон - закон сохранения энергии; его можно сформулировать так: общая энергия системы и окружающей среды - величина постоянная. · Второй закон гласит, что все физические и химические процессы в системе стремятся к необратимому переходу полезной энергии в хаотическую, неуправляемую форму. Мерой перехода или неупорядоченности системы служит величина, называемая энтропией (S), она достигает максимума, когда система приходит в истинное равновесие с окружающей средой. Направление химической реакции определяется значением ΔG. Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими. Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую. Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими. Если абсолютное значение ΔG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии. В клетках самопроизвольно протекают только те химические процессы, которые приводят к уменьшению свободной энергии системы. В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора. Сопряжение двух реакций возможно при наличии общего промежуточного продукта. Например, фосфорилирование глюкозы. Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической: (1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль). Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы. (2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль). При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой фосфорилирование глюкозы, легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима: (3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль). Пример 2, реакции с участием глутаминсинтетазы. Сначала концевая фосфатная группа переносится с АТФ на глутамат с образованием высокоэнергетического смешанного ангидрида. Далее фосфатная группа промежуточного продукта вытесняется NH3 с образованием глутамина и свободного фосфата. Баланс и величина ΔGo' суммарной реакции соответствуют сумме балансов и значений свободных энергий отдельных реакций. Биологические мембраны содержат «ионные каналы», по которым отдельные ионы избирательно проникают через мембрану. Проницаемость и полярность мембраны зависят от электрохимического градиента, т. е. от концентраций ионов по обе стороны мембраны (концентрационного градиента) и от разности электрических потенциалов между внутренней и внешней сторонами мембраны (мембранного потенциала). На внутренней стороне плазматической мембраны преобладает избыток отрицательных зарядов. Потенциал покоя обеспечивается, прежде всего, катионами Na+ и K+, а также органическими анионами и ионом Cl-. Распределение ионов между внешней средой и внутренним объемом клетки описывается уравнением Нернста:
где ΔΨG — трансмембранный потенциал (в вольтах, В), т.е. разность электрических потенциалов между двумя сторонами мембраны при отсутствии транспорта ионов через мембрану (потенциал равновесия). Ионы гидроксония («H+-ионы») также могут формировать электрохимический градиент. свободная энергия переноса протона (разность между электрохимическими потенциалами протонов на двух сторонах мембраны) зависит от градиента концентрации, т. е. от разности рН (ΔpH) по ту и другую стороны мембраны. Кроме того, определенный вклад вносит и трансмембранный потенциал ΔΨ. Обе эти величины формируют протондвижущую силу Δp, являющуюся мерой работы ΔΨG , которую может совершать H+-градиент. Образование протонного градиента в дыхательной цепи также сопряжено с окислительно-восстановительным процессом: Механизм регуляции образования и потребления АТФ называется дыхательным контролем. Он основан на сопряжении упомянутых процессов с общими коферментами и другими факторами. В отсутствие АДФ АТФ-синтаза не в состоянии использовать протонный градиент на внутренней митохондриальной мембране. Это в свою очередь тормозит электронный перенос в дыхательной цепи, вследствие чего НАДН не может быть вновь окислен в НАД+. Возникающее в результате высокое соотношение НАДН/НАД+ тормозит цитратный цикл. И наоборот, высокие скорости потребления АТФ стимулируют усвоение пищи и дыхательную цепь по тому же механизму. Если создание протонного градиента подавлено, процессы окисления субстрата и переноса электронов протекают значительно быстрее, чем обычно. При этом вместо синтеза АТФ выделяется тепло.
26. Термодинамическая характеристика анаэробного распада глюкозы. Расчет КПД. Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса: С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O. При анаэробном гликолизе в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза. Восстановление пирувата в лактат катализирует лактатдегидро-геназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD+ из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NAD+. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О. Строение лактатдегидрогеназы, механизм действия и значение определения активности этого фермента для диагностики заболеваний.
|
||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 746; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.170 (0.014 с.) |

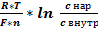 =D ψG
=D ψG 


