
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамика биологических процессовСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Термодинамическое равновесие * отсутствует поток вещества и энергии в окружающую среду и обратно * на поддержание этого состояния не затрачивается свободная энергия * работа способности системы равна 0, т/д потенциалы равны 0 * энтропия максимальна * в системе отсутствуют градиенты Переход на новый стац. уровень: 2 пути: 1) «овершот» - по нему переходят живые организмы при изм внеш. усл. (приспособление). График. Нижняя стрелочка – это старый стац. уровень. Верхняя стрелочка – это новый стац. уровень. 2) «ложный старт» - усиление или уменьшение О2, выращивание лука с О2 и без. График. С О2 – аэробный распад углеродов. Без О2 – обмен в-в переходит на анаэробный путь. А если потом снова дать О2 – то получится график 2 (то что обведено кружочком – там осущ-ся уничтожение продуктов анаэробного пути). Пример для чела: пока не расщепится молочная к-та осуществлять работу дальше нельзя.
17.Теорема Пригожина и направленность эволюции биосистем. Энтропия и биологический прогресс. Стац. сост. хар-ся min ежесекундным приростом энтропии (благодаря этому происходит эволюция). Теорема: при постоянных внеш. усл. в системе, находящейся вблизи положения ТД равновесия в стац. сост., скорость возрастания энтропии, за счёт необходимости внутр. процессов, принимает постоянное минимальное значение отличное от нуля. Или: В стационарных состояниях при фиксированных внешних параметрах локальная продукция энтропии в открытой т/д системе стремится к минимальному значению. Энтропия – мера рассеивания свободной энергии, следовательно любая открытая т/д система в стационарном состоянии стремится к минимальному рассеиванию свободной энергии. Если в силу причин система отклонилась от стационарного состояния, то вследствие стремления системы к минимальной энтропии, в ней возникают внутренние изменения, возвращающие ее в стационарное состояние. Величина, кот это всё характеризует: β= T* (dS/dt), где β – диссипативная фукнкция. β>0, min. С этим связан Критерий эволюции открытых систем: ∆β/dt < 0 Баланс АТФ при анаэробном гликолизе Анаэробный гликолиз по сравнению с аэробным менее эффективен. В этом процессе катаболизм 1 моль глюкозы без участия митохондриальной дыхательной цепи сопровождается синтезом 2 моль АТФ и 2 моль лактата. АТФ образуется за счёт 2 реакций субстратного фосфорилирования. Поскольку глюкоза распадается на 2 фосфотриозы, то с учётом стехиометри-ческого коэффициента, равного 2, количество моль синтезированного АТФ равно 4. Учитывая 2 моль АТФ, использованных на первом этапе гликолиза, получаем конечный энергетический эффект процесса, равный 2 моль АТФ. Таким образом, 10 цитозольньгх ферментов, катализирующих превращение глюкозы в пируват, вместе с лактатдегидрогеназой обеспечивают в анаэробном гликолизе синтез 2 моль АТФ (на 1 моль глюкозы) без участия кислорода.
Значение окислительного декарбоксилирования пирувата Реакции пируватдегидрогеназного комплекса связывают метаболические пути гликолиза,глюконеогенеза, синтеза жирных кислот с циклом лимонной кислоты. ПДГ-комплекс имеет огромное значение в поддержании гомеостаза. Энергетический метаболизм аэробных тканей (например, мозга) очень зависит от превращения пирувата в ацетил-КоА, поэтому такие ткани более чувствительны к нарушениям ПДГ-комплекса. Большинство нарушений, связанных с недостаточностью пируватдегидрогеназной активности, обусловлены мутациями пируватдегидрогеназы. Главными последствиями таких нарушений являются энцефалопатии и церебральные молочные ацидозы. Энергетический обмен Для жизнедеятельности организма необходима энергия. Растения аккумулируют солнечную энергию в органических веществах при фотосинтезе. В процессе энергетического обмена органические вещества расщепляются и энергия химических связей освобождается. Частично она рассеивается в виде тепла, а частично запасается в молекулах АТФ. У животных энергетический обмен протекает в три этапа. Первый этап — подготовительный. Пища поступает в организм животных и человека в виде сложных высокомолекулярных соединений. Прежде чем поступить в клетки и ткани, эти вещества должны разрушиться до низкомолекулярных, более доступных для клеточного усвоения веществ. На первом этапе происходит гидролитическое расщепление органических веществ, идущее при участии воды. Оно протекает под действием ферментов в пищеварительном тракте многоклеточных животных, в пищеварительных вакуолях одноклеточных, а на клеточном уровне — в лизосомах. Реакции подготовительного этапа: белки + Н20 -> аминокислоты + Q; жиры + Н20 -> глицерин + высшие жирные кислоты + Q; полисахариды -> глюкоза + Q. У млекопитающих и человека белки расщепляются до аминокислот в желудке и в двенадцатиперстной кишке под действием ферментов — пептидгидролаз (пепсина, трипсина, хемотрипсина). Расщепление полисахаридов начинается в ротовой полости под действием фермента птиалина, а далее продолжается в двенадцатиперстной кишке под действием амилазы. Там же расщепляются и жиры под действием липазы. Вся энергия, выделяющаяся при этом, рассеивается в виде тепла. Образующиеся низкомолекулярные вещества поступают в кровь и доставляются ко всем органам и клеткам. В клетках они поступают в лизосому или непосредственно в цитоплазму. Если расщепление происходит на клеточном уровне в лизосомах, то вещество сразу же поступает в цитоплазму. На этом этапе происходит подготовка веществ к внутриклеточному расщеплению. Второй этап — бескислородное окисление. Второй этап осуществляется на клеточном уровне при отсутствии кислорода. Он протекает в цитоплазме клетки. Рассмотрим расщепление глюкозы, как одного из ключевых веществ обмена в клетке. Все остальные органические вещества (жирные кислоты, глицерин, аминокислоты) на разных этапах втягиваются в процессы ее превращения. Бескислородное расщепление глюкозы называется гликолизом. Глюкоза претерпевает ряд последовательных превращений. Вначале она преобразуется во фруктозу, фосфорилируется — активируется двумя молекулами АТФ и превращается во фруктозо-дифосфат. Далее молекула шестиатомного углевода распадается на два трехуглеродных соединения — две молекулы глицерофосфата (триозы). После ряда реакций они окисляются, теряя по два атома водорода, и превращаются в две молекулы пировиноградной кислоты (ПВК). В результате этих реакций синтезируются четыре молекулы АТФ. Так как первоначально на активацию глюкозы было затрачено две молекулы АТФ, то общий итог составляет 2АТФ. Таким образом, выделяющаяся при расщеплении глюкозы энергия частично запасается в двух молекулах АТФ, а частично расходуется в виде тепла. Четыре атома водорода, которые были сняты при окислении глицерофосфата, соединяются с переносчиком водорода НАД+ (никотинамид-динуклеотидфосфат). Это такой же переносчик водорода, как и НАДФ+, но участвует в реакциях энергетического обмена. Обобщенная схема реакций гликолиза: С6Н1206 + 2НАД+ -> 2С3Н403 + 2НАД•2H 2АДФ -> 2АТФ Восстановленные молекулы НАД•2Н поступают в митохондрии, где окисляются, отдавая водород. В зависимости от типа клеток, ткани или организмов пировиноградная кислота в бескислородной среде может превращаться далее в молочную кислоту, этиловый спирт, масляную кислоту или другие органические вещества. У анаэробных организмов эти процессы называются брожением. Молочнокислое брожение: С6Н1206 + 2НАД+ -> 2С3Н403 + 2НАД•2Н <=> 2С3Н603 + 2НАД+ Глюкоза ПВК молочная кислота
Спиртовое брожение: С6Н1206 + 2НАД+ -> 2С3Н403 + 2НАД•2Н <=> 2С2Н5ОН + 2С02 + 2НАД+ Глюкоза ПВК этиловый спирт
Третий этап — биологическое окисление, или дыхание. Этот этап протекает только в присутствии кислорода и иначе называется кислородным. Он протекает в митохондриях. Пировиноградная кислота из цитоплазмы поступает в митохондрии, где теряет молекулу углекислого газа и превращается в уксусную кислоту, соединяясь с активатором и переносчиком коэнзимом-А (рис. 17). Образующийся ацетил-КоА далее вступает в серию циклических реакций. Продукты бескислородного расщепления — молочная кислота, этиловый спирт — также далее претерпевают изменения и подвергаются окислению кислородом. В пировиноградную кислоту превращается молочная кислота, если она образовалась при недостатке кислорода в тканях животных. Этиловый спирт окисляется до уксусной кислоты и связывается с КоА. Циклические реакции, в которых происходит преобразование уксусной кислоты, носят название цикла ди- и трикарбоновых кислот, или цикла Кребса, по имени ученого, впервые описавшего эти реакции. В результате ряда последовательных реакций происходит декарбоксилирование — отщепление углекислого газа и окисление — снятие водорода с образующихся веществ. Углекислый газ, образующийся при декарбоксилировании ПВК и в цикле Кребса, выделяется из митохондрий, а далее из клетки и организма в процессе дыхания. Таким образом, углекислый газ образуется непосредственно в процессе декарбоксилирования органических веществ. Весь водород, который снимается с промежуточных веществ, соединяется с переносчиком НАД+, и образуется НАД•2Н. При фотосинтезе углекислый газ соединяется с промежуточными веществами и восстанавливается водородом. Здесь идет обратный процесс. Общее уравнение декарбоксилирования и окисления ПВК: 2С3Н403 + 6Н20 + 10НАД+ -> 6С02 + 10НАД• Н. Проследим теперь путь молекул НАД•2Н. Они поступают на кристы митохондрий, где расположена дыхательная цепь ферментов. На этой цепи происходит отщепление водорода от переносчика с одновременным снятием электронов. Каждая молекула восстановленного НАД•2Н отдает два водорода и два электрона. Энергия снятых электронов очень велика. Они поступают на дыхательную цепь ферментов, которая состоит из белков — цитохромов. Перемещаясь по этой системе каскадно, электрон теряет энергию. За счет этой энергии в присутствии фермента АТФ-азы синтезируются молекулы АТФ. Одновременно с этими процессами происходит перекачивание ионов водорода через мембрану на наружную ее сторону. В процессе окисления 12 молекул НАД-2Н, которые образовались при гликолизе (2 молекулы) и в результате реакций в цикле Кребса (10 молекул), синтезируются 36 молекул АТФ. Синтез молекул АТФ, сопряженный с процессом окисления водорода, называется окислительным фосфорилированием. Этот процесс был впервые описан русским ученым В. А. Энгельгардтом в 1931 г. Конечным акцептором электронов является молекула кислорода, поступающая в митохондрии при дыхании. Атомы кислорода на наружной стороне мембраны принимают электроны и заряжаются отрицательно. Положительные ионы водорода соединяются с отрицательно заряженным кислородом, и образуются молекулы воды. Вспомним, что кислород атмосферы образуется в результате фотосинтеза при фотолизе молекул воды, а водород идет на восстановление углекислого газа. В процессе энергетического обмена водород и кислород вновь соединяются и превращаются в воду. Обобщенная реакция кислородного этапа окисления: 2С3Н403 + 4Н + 602 -> 6С02 + 6Н20; 36АДФ -> 36АТФ. Итак, выход молекул АТФ при кислородном окислении в 18 раз больше, чем при бескислородном.
Суммарное уравнение окисления глюкозы на двух этапах: С6Н1206 + 602 —> 6С02 + 6Н20 + Е —> Q (тепло). 38АДФ —> 38АТФ Таким образом, при расщеплении глюкозы на двух этапах образуется суммарно 38 молекул АТФ, причем основная часть — 36 молекул — при кислородном окислении. Такой выигрыш энергии обеспечил преимущественное развитие аэробных организмов по сравнению с анаэробными. Эффективность энергетического обмена. Общее количество энергии, выделившееся в процессе энергетического обмена, составляет 2880 кДж/моль. Из них часть рассеивается в виде тепла, а часть запасается в 38 молекулах АТФ. Энергия, запасенная в 1 моль АТФ, составляет 30,6 кДж/моль. В 38 молекулах АТФ запасается 38 • 30,6= 1162,8 кДж/моль. Эффективность процесса дыхания составляет: (1162,8: 2880) • 100% = 40,37%. Таким образом, при аэробном окислении глюкозы запасается в виде АТФ 40,37% энергии. При анаэробном окислении образуются лишь две молекулы АТФ. Рассчитаем эффективность этого процесса. Общее количество энергии спиртового брожения составляет 210 кДж/моль. Эффективность спиртового брожения: (2 •30,6: 210) • 100% = 29,14%. Общее количество энергии при молочнокислом брожении (гликолиз в мышцах) составляет 150 кДж/моль. Эффективность молочнокислого брожения: (2 • 30,6: 150) • 100% = 40,8%. 29. Этапы унификации энергетических субстратов в процессах катаболизма. ЦТК начинается с подготовительного этапа – окислительное декарбоксилирование ПВК до ацетил –КоА. ПВК является одним из рех конечных продуктов гидролиза при гликолизе – анаэробного процесса распада глюкозы. Ацетил – КоА – при окислении аминокислот и жирных кислот, т.е. не только углеводов. Таким образом, в качестве энергетического субстрата могут выступать все основные запасные вещества – углеводы, белки, жиры. Наиболее важный процесс деградации жирных кислот – β – окисление, которое происходит в митохондриях. При этом жирные кислоты активируются в цитоплазме и присоединяются к ацетил – КоА, а затем с помощью транспортной системы попадают в митохондриальный матрикс, где разрушаются в β – окислении до ацетил –КоА, который в свою очередь полностью окисляется до СО2 в ЦТК. Таким образом, β – окисление тесно связано с ЦТК и дыхательной цепью. Так при каждом цикле такого окисления образуется 1 молекула ФАДН2 и 1 молекула НАДН2. В дыхательной цепи ФАДН2 через КоА дает 2 молекулы АТФ, а НАДН2 – 3 молекулы АТФ. А весь цикл дает 5 молекул АТФ. При β – окислении пальмитиновой кислоты происходит 7 циклов; в итоге 35 молекул АТФ. 8 молекул ацетил – КоА. Сгорая в ЦТК, каждая дает 12 молекул АТФ; в итоге 96 молекул АТФ. Таким образом, при полном окислении: 35+96=131 молекула АТФ, но на активирование пальмитиновой кислоты ушла 1 молекула, поэтому 130 молекул АТФ. 130 АТФ*35,4= 4602 кДж\моль*Е При сгорании пальмитиновой кислоты образуется 9797 кДж энергии. η=4602/9797 * 100%=47% 47 % энергии идет на синтез АТФ, остальная часть энергии рассеивается в виде теплоты
30.Энергетическая сущность окислительного фосфорилирования. Коэффициент Р/О. Окислительное фосфорилирование осуществляет в живых клетках синтез молекул АТФ из АДФ и фосфорной кислоты за счет энергии окисления молекул органических веществ (субстратов). В результате о.ф. в клетка накапливается АТФ – макроэргическое соединение, расходуемое затем на обеспечение энергией различных процессов жизнедеятельности. Основные субстраты о.ф. – органические кислоты, образующиеся в цикле трикарбоновых кислот. Энергия, образующаяся при прохождении потока электронов по дыхательной цепи, используется для сопряженного фосфорилирования АДФ. Соотношение окисления и фосфорилирования определяется коэфф Р/О – количество моль фосфорилированного АДФ на ½ моль кислорода. Коэфф Р/О зависит от точки вхождения восстановительных эквивалентов в цепь транспорта электронов. Для НАДН2 и субстратов (малат), которые окисляются НАДН-дегидрогеназами. Р/О=3. Для ФАДН2, когда происходит превращение сукцината в фумарат в ЦТК Р/О=2. Т.е. Цепь транспорта электронов функционирует как протонная (Н+)-помпа, осуществляя перенос протонов из матрикса ч/з внутреннюю мембрану в межмембранное пространство. Перенос протонов приводит к возникновению разности концентрации Н+ с двух сторон митохондриальной мембраны: более высокая концентрация будет снаружи и более низкая – внутри. Электрохим потенциал способен заставлять протоны двигаться в обратном направлении, но мембрана непроницаема для них кроме отдельных участков, называемых протонными каналами. Обратный перенос протонов в матрикс является экзоорганическим процессом, высвобождающаяся при этом энергия используется на фосфорилирование АДФ. Этот процесс катализирует Н+-АТФ-синтетаза. Дыхательная цепь является частью процесса окислительного фосфорилирования.
31. Современное представление о строении и переносе электронов в дыхательной цепи митохондрий. Последовательность расположения компонентов дыхательной цепи определяется величиной их RedOx-потенциала и способностью переносить только электроны (e) либо одновременно и электроны, и протоны (p). Электроны переносятся от элементов с более низкими стандартными потенциалами (т.е. от более активных восстановителей) к элементам с более высокими стандартными потенциалами. I комплекс – НАДН2:CoQ-оксидоредуктаза (ФМН-зависимая, с FeS-центрами). Принимает на стороне митохондриального матрикса 2 Н (2 e + 2 p) от НАДН2, имеющего самый низкий стандартный потенциал (Е0= - 0,32 В), окисляя его до НАД, высвобождает 2 p в межмембранное пространство МТХ, а 2 e передает дальше по e-транспортной цепи – на III комплекс. II комплекс – сукцинат-дегидрогеназа (ФАД-зависимая, с FeS-центрами), принимает 2 e и 2 p от ФАДН2 с Е0= - 0,15 В (окисляя его до ФАД) на стороне митохондриального матрикса и передает их напрямую на CoQ III комплекса, минуя I комплекс. III комплекс – CoQН2:cyt c-оксидоредуктаза (с FeS-центром; включает в себя убихинон, FeS-белок и цитохромы b, c1, c), принимает e от комплексов I и II и передает на IV комплекс e-транспортной цепи, а также высвобождает в межмембранное пространство 2 p, полученных от II комплекса либо захваченных из митохондриального матрикса сопряжено с переносом пары e от I комплекса. IV комплекс – цитохромоксидаза (комплекс цитохромов a, a3), переносит e с cyt c III комплекса на конечный акцептор – О2, восстанавливая его до Н2О с Е0= + 0,82 В в митохондриальном матриксе. НАДН2-дегидрогеназа и CoQ – способны переносить как e, так и р. Поэтому являются 2 точками сопряженной перекачки р. Механизм третьей точки сопряжения не ясен. В итоге переносятся по цепи 2 e и с одной стороны внутренней митохондриальной мембраны на другую – 6 р. В случае, когда донор e – ФАДН2, только 4 р, т.к. минуется первая точка сопряжения. 32. Современные представления о механизме сопряжения окисления и фосфорилирования в биосистемах. В начале исследования этого механизма выдвигаемые гипотезы формировались в две группы: химическую и конформационную. Сторонники химической гипотезы, к которым относилось подавляющее число исследователей, отталкивались от прецедента субстратного фосфорилирования, которое реализуется на предварительных стадиях гликолиза. Это обычная ферментативная реакция между водорастворимыми субстратами. Конформационная гипотеза опиралась на представление о том, что процесс окисления НАДН может привести к формированию локальных напряжений внутренней мембраны митохондрий, запасающих часть энергии, выделяемой в процессе окисления. Затем, возвращаясь к исходному состоянию, мембрана подобно расправляющейся пружине может передать свободную энергию участникам реакции фосфорилирования. Такие изменения структуры митохондриальной мембраны могли бы быть опосредованы, например, каким-либо мембранно-связанным белком. Затем появилась альтернативная гипотеза, получившая название хемиосмотической. В 1961 году английский биохимик П. Митчел высказал предположение, что для сопряжения окисления НАДН2 с синтезом АТФ из АДФ и Ф необходима целостность внутренней мембраны митохондрий, т. е. она должна чётко отделять внутреннее пространство митохондрии («матрикс») от цитоплазмы клетки. Это была качественно новая идея. То, что многие ферменты в клетке нормально функционируют только в тесном контакте с мембраной или даже встроены внутрь мембраны, было известно, но топология мембранной системы никогда не считалась важной для протекания биохимических реакций. Термодинамика биологических процессов 1. Подходы: феноменологический и детальный. Значение имеют т/д параметры только в исходном и конечном состоянии. Термодинамика – это наука, изучающая наиболее общие закономерности превращения различных видов энергии в системе. 2. Практическая значимость т/д в биологии. Позволяет оценить энергетические изменения, происходящие в результате биохимических реакций; рассчитать энергию разрыва конкретных хим. связей; рассчитать осмотическое давление по обе стороны полупроницаемой мембраны; рассчитать влияние концентрации соли в растворе на растворимость макромолекул. Применяется для описания процессов, протекающих в электрохимических ячейках. Привлекается для обоснования теории возникновения и эволюции жизни на Земле.
5. Классификация ТД систем; особенности живых организмов, как ТД систем. Система – всякий материальный объект, состоящий из большого числа частиц. Система – совокупность взаимодействующих между собой относительно элементарных структур или процессов, объединяющихся в целое выполнением некоторой общей функции, несводимой к функциям ее компонентов. Т/д система – часть пространства с материальным содержимым, ограниченная оболочкой. Система – тело или группа тел, реально или мысленно выделенных из окружающей среды. Окр. среда – всё, что находится в контакте с системой. Термодинамическая система – группа взаимодействующих тел системы, между которыми происходит обмен теплотой или веществом, либо она описывается термодинамическими параметрами. Окружающая среда – всё, что находится в контакте с системой. Выделяют несколько типов систем по их способности взаимодействовать с внешней средой: 1. Изолированная система – с-ма, которая не обменивается с окр. средой ни веществом, ни Е (пр: космонавт в космосе). 2. Замкнутая - система, которая не обменивается с окр. средой веществом, но обменивается Е и работой (горячий чай в стакане с крышкой – на холод). 3. Открытая т/д система - которая обменивается с окр средой и веществом и энергией (живой организм). Т/Д функция – совокупность физич. и химич. свойств системы, которые определяют ее сост-е. Параметры (2 основн-х типа): · экстенсивные, зависят от количества вещества в системе (масса, объем), · интенсивные, не зависят от количества вещества в системе (давление, t0).
6.Характеристика ТД функций, применяемых для анализа биолог процессов. Функция – совокупность физ. и хим. св-в, кот. определяют конкретное сост. системы. Напр:t,V,P. ТД функции = ТД параметры. ТД параметры сост. системы – измеримые св-ва системы, связанные с Е и характеризующие её состояние. Основные параметры состояния – параметры, поддающиеся прямому измерению. Те, которые нельзя измерить непосредственно, рассм. как функции основных параметров сост-я. Типы: 1) экстенсивные (=факторы ёмкости) – это ТД фукнции, кот зависят от кол-ва или числа частиц и их массы. Напр: масса, объём, E, энтропия (S), энтальпия (Н). Св-во системы = сумме свойств частей. 2) интенсивные – не зависят. Напр: t, давление, скорость изменения энтропии. Состояние системы – совокупность всех физ. и хим. св-в системы. ТД процесс - изменение сост. системы, характ-ся изм. её ТД параметров. Изменение может происходить при различных условиях, различают: 1). Равновесные и неравновесные процессы. Равн. пр. – непрерывный ряд равновесных сост. сист.; сост., не изм-ся во времени и не требующие для своего поддержания каких-либо внешних факторов. Неравн. — это пр-сы, после протекания кот. систему нельзя вернуть в исходное сост. без того, чтобы в ней не осталось каких-либо изменений. 2). Обратимые и необратимые процессы. Обр. – пр-сы, допускающие возможность возвращения системы в первоначальное сост. без того, чтобы в окр. среде остались какие-либо изменения. В противном случае – необр. 3). Самопроизвольные и несамопроизвольные процессы. Сам. – процессы, происходящие сами собой (не требующие затраты Е извне) и приближающие систему к равновесию. Несам. – процессы, требующие затраты Е извне. Некоторые частные виды процессов: а) изотермический (T = const); б) изобарный (p = const); в) изохорный (V = const); г) адиабатический (нет обмена теплотой между системой и окр. средой); д) изобарно – изотермический (p = const, T = const); е) изохорно – изотермический (V = const, T = const).
7.Внутренняя энергия, теплота и работа, как ТД функции. Энергия – мера определённой формы движения материи при её превращении из одной формы в другую. Е - мера способности системы совершать работу. Является произведением фактора экстенсивности на интенсивность. Напр: E=р*v, E=m*P и т.д Закон сохранения Е: - Е не создаётся из ничего и не может превратиться в ничто. ТД равновесие - состояние системы, при котором способность совершать работу =0 и из которой она не может выйти без затраты Е из вне. Все системы стремятся к этому состоянию. Внутренняя Е (U) – весь запас внутр. кинетической и потенциальной Е в-ва. Абсолютное значение внутр. Е определить невозможно. Важно кол-но определить изменение внутр. Е при переходе из одного состояния в другое: ∆U=U2-U1. В равновесном сост. система обладает определённым запасом Е => внутр. Е является функцией состояния. Работа и теплота – две возможные формы передачи Е от одной системы к др. Работа – это Е, передаваемая одним телом другому, не зависящая от t тел и не связанная с переносом массы. Работа положительна (А > 0), если она совершается системой против внешних сил, и отрицательна (А < 0), если она выполняется над системой. В хим. рассматривают работу расширения, совершаемую системой, тогда равновесному процессу всегда соответствует мах работа. Теплота – Е, передаваемая одним телом другому, зависящая от t тел и не связанная с переносом массы. Теплота положительна (Q > 0), если теплота поступает в систему (эндотермическим процесс), и отрицательна (Q < 0), если теплота отводится из системы (экзотермический). В равновесном состоянии система не обладает ни запасом теплоты, ни запасом работы, поэтому они являются функциями процесса. Передача теплоты или совершение работы осущ‑ся лишь при взаимодействии системы с внеш. средой или другой системой.
8.Первый закон ТД в биологии; доказательства его применимости к живым системам. Своеобразие проявления первого закона ТД в биосистемах. Закон: работа совершаемая системой = разности м/у количеством теплоты, сообщаемой системой и изменением её внутр. Е: ∆А = ∆Q - ∆U. Закон – это количественная форма закона сохранения энергии. Кол-во теплоты, поступающей в систему расходуется на ↑ внутр. Е системы за вычетом совершенной работы. Внутренняя Е (U) – сумма (совокупность) всех типов Е и взаимодействий входящих в систему частиц. (Е вращательного движения атомов, Е взаим-вия водородных атомов). Работа биосистемы может совершаться за счёт энтропии и внутр. Е (но не внеш. теплоты, т.к. если бы можно было за счёт притока из вне биосист. нагревались бы 1740С, см. ниже в этом же вопросе – это типа своеобразие закона) (это следствие 1 закона). Доказательство справедливости закона для биосистем: 1780 Лавуазье и Лаплас опыт с морскими свинками. Е хим. связей в белках, жирах и углеводах переходит в тепловую – метод непрямой калориметрии. Свинок кормили – мерили тепло, столько же прод питания сжигали – тоже мерили, сравнили, получили числа одного порядка. По умному: совпадение тепловых эффектов при прямом сжигании продуктов и при их окислении в орг-ме морской свинки свидетельствует о том, что пути превращения прод-в питания в метаб-ких процессах и хим. р-циях вне живой клетки яв-ся эквивалентами с точки зрения суммарных тепловых эффектов. Живые орг-мы не являются источником новой Е. Окисление поступающих в живой организм пит. в-в приводит к высвобождению в нем эквивалетного кол-ва Е. Еще док-во: работа мышцы при 250С (289К = Т), КПД = 30% = 1/3. КПД = Т1-Т2/Т1. 1/3 = Т1-298К/Т1. 1/3 = 1- 298/ Т1. -2/3 = - 298/ Т1. 2/3Т1 = 298. Т1 = (298*3) /2 = 447К = 1740С. Метод прямой калориметрии исполь-ся и на человеке (Этуотер). Исполь-ся герметичная камера: ч/з систему труб подается определ. кол-во О2, считают сколько выд-ся СО2, Н2О и т.д. есть датчики на t. Ограничения: 1) живой объект не должен накапливать массу и расти. 2) жив организм не должен совершать работу (физ. нагрузку). Кол-во Е, поглощенной за сутки чел. орг-мом вместе с пит. в-ми, равно выделенной за это же время теплоте. След-но, закон справедлив для жив. орг-мов. Метод непрямой калориметрии: С полным и неполным газовым анализом. Ввели коэффициент: при расщеплении 1 мол-лы глюкозы исп-ся 6 мол-л О2, а выделяется 6 мол-л СО2, 6 мол-л Н2О и 678 кал. ДК = выд СО2 в ед времени / погл О2 в ед времени. Производят сравнение состава и объема вдых. и выдых. воздуха. Исп. мешок Дугласа. Для анализа исп. газоанализаторы: ГА Холдейна: система стеклян. трубочек, погл-щая CO2 и O2. Сейчас ГА с поглощением световых потоков. Нормальный дых. коэфф. 0,85±0,03. Нахождение КЭК (калориметрический эквивалент кислорода) – численно равен кол-ву Е, высвобождающейся в организме при потреблении 1 л О2. В клинических условиях исп. неполный ГА, не считают СО2. Считают объем поглощенного О2 с пом. спирографа. Диаграмма под наклоном, из замкнутой системы постепенно уходит О2.
9.Характеристика энтальпии системы как функция состояния. Тепловой эффект процесса. Хим. и биохим. р-ции чаще протекают при постоянном давлении (обычно равном атмосферн.), чем при пост. объеме. Поэтому для упрощения расчета изобарических пр-сов была введена функция состояния ТД системы, называемая энтальпией (теплосодержанием). Энтальпия (Н) системы = сумме ее внутренней Е и произведения объема (V) на давление (P): H = U + PV Обычно определяют не абсолютную величину энтальпии, а ее изменение в рез-те пр-са или реакции: ∆H = ∆U + P ∆V Выражают [ Дж · моль-1]. В связи с тем, что при биохим. р-циях изменение объема чаще всего бывает незначительно, величина P ∆V тоже мала, то ей обычно пренебрегают, принимая ∆H = ∆U, т.е. изменение энтальпии практически = изм. внутр. Е системы. Изменение энтальпии как функции состояния не зависит от пути протекания процесса, и явл-ся полезной величиной при анализе различных ТД процессов. Для химических реакций в газовой фазе справедливо: QP – QV = ∆(pV) = ∆nRT, т. е. ∆H = ∆U + ∆nRT, где ∆n — изменение числа моль газообразных веществ в ходе реакции. Итак, ∆U соответствует тепловому эффекту изохорного процесса, а ∆H – изобарного. Энтальпия реакции – это изменение энтальпии системы при протекании химической реакции. Она может быть больше нуля или меньше нуля. Если ∆H > 0, то Q > 0 (эндотермические реакции). Если ∆H < 0, то Q < 0 (экзотермические реакции). Положительное значение энтальпии (+∆H) указывает на поглощение тепла в ходе процесса или р-ции, а отрицательное (-∆H) – на его выделение. Если ТД эффект р-ции характеризуют через величину тепловой энергии Q, то знаки меняют на противоположные. Следовательно, если в результате реакции происходит выделение тепла (+ Q), то энтальпия системы уменьшается, а при его поглощении из внешней среды (- Q) она увеличивается. Реакции при которых происходит выделение тепла - экзотермическими, а те, при которых тепло поглощается из внешней среды – эндотермическими. В связи с тем, что энтальпия, подобно внутренней энергии, является функцией состояния, ее изменение зависит только от начального и конечного состояния системы, а не от путей перехода или последовательности хим. реакций. Это правило, называемое правилом Гесса, позволяет вычислить тепловые эффекты таких хим. и биохим. превращений, для которых известны только исходные соединения и конечные продукты, а промежуточные стадии еще не исследованы. Тепловой эффект реакции – мах кол-во теплоты, выделяющееся в необратимом процессе при p = const или V = const, если все вещества имеют одинаковую t и отсутствуют другие виды работ, кроме работы расширения. В хим. ТД стандартное состояние - состояние системы, выбираемое как точка отсчета при оценке ТД величин. Необходимость выбора обусловлена тем, что не м. б. рассчитаны абсолютные значения энергий Гиббса, энтальпий и других ТД функций для данного в-ва. Станд.е состояние хар-ся станд. условиями – температура 250С (298.15 К) и давление 1 атм. Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами. В качестве станд. состояния для простых в-в принимают устойчивое фазовое и хим. состояние элемента при данной температуре. Для расчета теплового эффекта хим. реакций исп-т термохим. уравнения, в которых обязательно указывается агрегатное состояние реагирующих в-в и продуктов реакции; для твердых в-в указывается их полиморфная модификация: С-графит, С-алмаз. В термохим. уравнениях также указывается тепловой эффект реакции или изменение энтальпии химической реакции, рассчитанное для стандартных условий. Основу всех термохимических расчетов составляет закон Гесса, который можно представить в виде: QV = ∆U при V = const и QP = ∆H при p = const.
10.Закон Гесса, его применимость к биопроцессам. Следствие закона Гесса, его практическое значение. Закон: тепловой эффект хим. р-ции, который развивается ч/з определённое количество стадий, не зависит от пути перехода, а зависит только от теплосодержания исходных и конечных продуктов р-ции. 1836 г. Практич. применение: 1) можно рассчитать тепловые эффекты процессов, которые не могут протекать физически. 2) возможно рассчитать тепл. эффект р-ций и образование продуктов, кот мы не м. опр-ть на практике (обр-ие СО из С). Ств. + О2 = СО2 + 97 ккал/моль; СО + 1/2 О2 = СО2 + 68 ккал/моль; Ств. + 1/2 О2 = СО + 29 ккал/ моль. 3) расчёт калорийности продукта. Т.е. закон Гесса дает возможность рассч. тепл. эф. пр-сов в тех случаях, когда их трудно измерить в определён. усл-ях или когда в этих усл-ях нельзя осуществить этот пр-с. Тепловой эффект р-ции – мах кол-во теплоты, выд-ся в необратимом процессе при p = const или V = const, если все в-ва имеют одинаковую t и отсутствуют другие виды работ, кроме работы расширения. Стандартным |
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1452; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.43.200 (0.014 с.) |


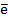 и
и  от НАДН2 И ФАДН2 проходят через 3 или 2 участка сопряжения, соответственно. Т.е при переносе 1 пары
от НАДН2 И ФАДН2 проходят через 3 или 2 участка сопряжения, соответственно. Т.е при переносе 1 пары 


