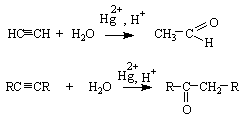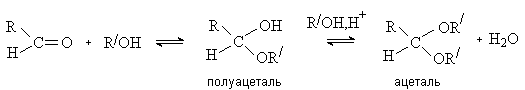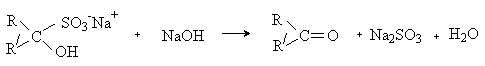Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции нуклеофильного замещенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Общая схема реакции: R - НаI +:N- → R - N +:НаI- Нуклеофил отдает субстрату свою пару электронов, за счет которой образуется новая связь, а галоген уходит со своей парой электронов в виде галогенид-аниона. При этом происходит алкилирование нуклеофила. Для нуклеофильного замещения у атома углерода в состоянии sp3-гибридизации установлено два основных механизма: бимолекулярное нуклеофильное замещение (SN2) и мономолекуляное нуклеофильное замещение (SN1). Бимолекулярное нуклеофильное замещение – это синхронный процесс, который протекает в одну стадию. Разрыв старой и образование новой связи происходят одновременно. Нуклеофил атакует субстрат со стороны, противоположной уходящей группе (с тыла), и постепенно вытесняет ее из молекулы: N: + R-Hal → [N….R….Hal] → N-R + Hal- переходное SN2-реакции имеют следующие основные признаки:
Скорость реакции зависит от концентрации и субстрата, и нуклеофила. Реакция имеет второй общий порядок (первый по субстрату и первый по нуклеофилу) и описывается кинетическим уравнением: v=k[RHal][N]
2. Стереохимический Если нуклеофильное замещение происходит у асимметрического атома углерода, то имеет место обращение конфигурации, так как в переходном состоянии три нереагирующие группы и центральный атом углерода находятся в одной плоскости, а входящая и уходящая группы расположены на одной прямой, перпендикулярной этой плоскости. В результате структура выворачивается, как зонтик.
На первой стадии под действием растворителя происходит гетеролитический разрыв связи в субстрате, в результате чего образуется карбокатион. Процесс протекает медленно и определяет скорость реакции в целом. На второй стадии карбокатион быстро реагирует с нуклеофилом, давая продукт замещения. SN1-реакции имеют следующие основные признаки. 1. Кинетический Скорость реакции зависит только от концентрации субстрата, поскольку нуклеофил не участвует в лимитирующей стадии процесса. Реакция имеет первый порядок и описывается кинетическим уравнением: v=k[RHal] 2. Cтереохимический признак Если нуклеофильное замещение происходит у асимметрического атома углерода, то, как правило, образуется рацемическая смесь, так как атака нуклеофилом плоского карбокатиона с обоих сторон равновероятна. Факторы, влияющие на ход нуклеофильного замещения Легкость протекания реакции и ее механизм зависят от многих факторов, среди которых можно выделить следующие:
Влияние строения углеводородного радикала. Реакционная способность первичных, вторичных и третичных алкилгалогенидов в реакциях нуклеофильного замещения различна, причем порядок реакционной способности зависит от механизма реакции. Скорость реакций, протекающих по механизму SN1, зависит от стабильности карбокатиона, образующегося на первой стадии реакции. Таким образом, реакционная способность алкилгалогенидов в реакциях SN1 возрастает в ряду: перв <вторич< третич который соответствует ряду стабильности карбокатионов. Успех реакции SN2 определяется эффективностью атаки нуклеофила на положительно заряженный реакционный центр субстрата. Поэтому электронодонорные радикалы R, понижая положительный заряд на реакционном центре, замедляют нуклеофильную атаку. Увеличение объема R затрудняет подход нуклеофила к реакционному центру. Совместное действие индуктивного и объемного эффектов определяет ряд реакционных особностей субстратов в реакциях нуклеофильного замещения: перв >вторич> третич. Высокой реакционной способностью, независимо от механизма реакции, обладают аллил- и бензилгалогениды. В процессе SN1 они образуют карбокатионы, стабилизированные засчет р, π-сопряжения: Легкость, с которой аллил- и бензилгалогениды вступают в SN2-реакции, объясняют участием кратных связей в стабилизации переходного состояния. Влияние природы уходящей группы. Реакционная способность алкилгалоненидов зависит от прочности связи углерод – галоген, которая уменьшается в ряду: C-F > C-Cl > C-Br > C-I. Не менее важно, чтобы уходящая группа была термодинамически стабильна. (Она должна быть более устойчива, чем атакующий субстрат нуклеофил). Хорошими (относительно устойчивыми) уходящими группами являются слабые основания. Галогенид-анионы – хорошие уходящие группы. Относительная стабильность возрастает по мере уменьшения их основности в ряду: F- < Cl- < Br- < I- Параллельно увеличивается и реакционная способность алкилгалогенидов: RF < RCl < RBr < RI Влияние природы нуклеофила. Нулеофильность – это способность частицы взаимодействовать с атомом углерода, несущим целый или частичный положительный заряд. Нуклеофильность является кинетической характеристикой и определяется константами скоростей соответствующих реакций. Нуклеофилы, как и основания, могут быть сильными и слабыми. Единой шкалы нуклеофильности не существует, так как относительная сила нуклеофила может изменяться в зависимости от природы субстрата и растворителя. Однако можно выделить следующие основные закономерности: 1) отрицательно заряженные нуклеофилы сильнее, чем нейтральные молекулы (сопряженные им кислоты): OH- > H2O; RO- > ROH; NH2- > NH3 2) для элементов одного периода с ростом электроотрицательности атома нуклеофильность уменьшается: NH2- > OH- > F- R3C- > RNH2- > RO- > F- 3) электронодонорные заместители увеличивают, электроноакцепторные – уменьшают нуклеофильность. Например, для кислородсодержащих нуклеофилов установлен следующий ряд реакционной способности: RO- > OH- > ArO- > RCOO- В рассмотренных примерах порядок нуклеофильности реагентов совпадает с порядком их основности и объясняется теми же причинами. Однако сила нуклеофила определяется не только его основностью, но и поляризуемостью. 4) Для элементов одной подгруппы с возрастанием заряда ядра нуклеофильность увеличивается, несмотря на уменьшение основности: RS- >RO- I- > Вr- > Cl- > F- Рост нуклеофильности связан с увеличением поляризуемости атомов и ионов по мере увеличения их радиуса. Чем выше поляризуемость нуклеофила, тем легче деформируется его электронное облако и тем в большей степени он способен передать электронную плотность субстрату. Такой порядок нуклеофильности может быть объяснен также с позиций принципа ЖМКО. Основность по Бренстеду проявляется во взаимодействии с жесткой кислотой Н+, в то время как нуклеофильность проявляется во взаимодействии с более мягким кислотным центром – атомом углерода, для которого предпочтительным будет взаимодействие с мягкими основаниями Льюиса – RS- и I-. Относительная сила нуклеофилов зависит от природы растворителя. Чем меньше размер аниона, тем лучше он сольватируется полярными протонными растворителями (т.е. растворителями, способными образовывать с анионом водородные связи), что снижает его реакционную способность. При замене растворителя порядок реакционной способности нуклеофилов может меняться на противоположный. В соответствии с механизмами SN2 и SN1 природа нуклеофила оказывает влияние на ход SN2-реакции, так как нуклеофил участвует в лимитирующей (и единственной) стадии процесса, и не влияет на скорость реакций, протекающих по механизму SN1, лимитирующая стадия которых протекает без участия нуклеофила. Влияние природы растворителя Растворитель влияет на скорость и механизм реакций нуклеофильного замещения. Протеканию реакции по механизму SN1 способствуют сильноионизирующие растворители. К ним относятся полярные протонные растворители (вода, спирты, карбоновые кислоты), так как они хорошо сольватируют ионные интермедиаты: отрицательно заряженную уходящую группу – за счет водородных связей, карбокатион – за счет свободных пар электронов. Влияние растворителя на SN2-реакции проявляется в меньшей степени и зависит от распределения зарядов в исходном и переходном состояниях. Как правило, их скорость уменьшается с ростом полярности растворителя и увеличивается при переходе от протонных растворителей к апротонным (диметилформамид, диметилсульфоксид, ацетонитрил). В апротонных растворителях, которые не способны к образованию водородных связей, нуклеофил (а это, как правило, анион) в меньшей степени сольватирован и, следовательно, обладает большей силой, что важно для SN2-реакции. Таким образом, протеканию реакций по механизму SN2 способствуют:
Реализации механизма SN1 способствуют:
По легкости замещения галогена независимо от механизма реакции галогенпроизводные располагаются в следующий ряд: аллил- и бензилгалогениды > алкилгалогениды > винил- и арилгалогениды Галогенпроизводные, содержащие связь (винил- и арилгалогениды), обладают очень низкой реакционной способностью. Реакция протекает по иному механизму. Малую подвижность галогена в винил- и арилгалогенидах объясняют увеличением прочности связи C-Hal за счет сопряжения пары электронов галогена с электронами π -связей: Реакции нуклеофильного замещения галогена широко используются в органическом синтезе. С их помощью можно заменять галоген на другие функциональные группы или углеводородные радикалы и получать из галогенпроизводных любые классы органических соединений. Примеры синтетического использования галогенпроизводных алифатических углеводородов приведены в таблице. Таблица. SN-реакции галогенпроизводных
Винил- и арилгалогениды инертны по отношению к нуклеофильным реагентам. Замещение галогена в галогенбензолах возможно только в очень жестких условиях. Введение электроноакцепторных заместителей в орто - и пара -положения к галогену активизируют галогенарены в SN-реакциях. Реакции элиминирования В процессе отщепления (дегидрогалогенирования) от молекулы галогеноводорода отщепляется HHal и образуется алкен. Отщепление протекает под действием сильных оснований – концентрированных растворов гидроксидов щелочных металлов в спирте, алкоголятов или амидов щелочных металлов. Основания отщепляют протон в ß -положении, одновременно из молекулы уходит галоген в виде галогенид-аниона. Если возможно образование двух разных продуктов отщепления, то преимущественно образуется наиболее замещенный у двойной связи алкен, который является термодинамически более стабильным (правило Зайцева): Реакции элиминирования могут протекать, по мономолекулярному (Е1) или бимолекулярному (Е2) механизмам. Е1-реакции протекают параллельно с реакциями SN1 и включают две стадии. Сначала образуется карбокатион, от которого затем отщепляется под действием основания протон. Реакции Е2 протекают параллельно с реакциями SN2 и включают одну стадию, в ходе которой одновременно происходит разрыв старых и образование новых связей. Механизм отщепления (Е1 или Е2) определяется теми же факторами, что и соответствующие процессы нуклеофильного замещения (SN1 и SN2). Конкуренция реакций нуклеофильного замещения и элиминирования Процессы отщепления и нуклеофильного замещения всегда протекают параллельно, так как все нуклеофилы одновременно являются и основаниями. Соотношение продуктов отщепления и замещения зависит от природы реагентов и условий проведения реакции. Подбирая условия реакции и реагент, можно добиться преимущественного протекания реакции в нужном направлении. Факторы, способствующие протеканию отщепления: 1) Высокая основность реагента. Сильные основания будут атаковать в первую очередь атом водорода в ß -положении, а не углерод. Так, под действием алкоголят-анионов, которые являются сильными основаниями, протекает в основном отщепление, в то время как менее основные тиолят-анионы реагируют по атому углерода и дают продукты замещения: CH3-CHI-CH3 + C2H5O-Na+→ CH3-CH=CH2 + C2H5OH + NaI CH3-CHI-CH3 + C2H5S-Na+→ (CH3)2CH-S-C2H5 +NaI Протеканию отщепления способствует не только высокая основность, но и большой объем реагента, что затрудняет его атаку по атому углерода. Поэтому третичные алкоголят-анионы дают, основном, продукты отщепления. 2) Малополярные растворители. Один и тот же реагент – гидроксид калия, в водном растворе реагирует как нуклеофил с образованием продуктов замещения, а в менее полярном растворителе – спирте дает в основном продукты отщепления. 3) Высокая температура. Реакции отщепления имеют большую энергию активации, чем реакции замещения, и поэтому их скорость возрастает в большей степени при увеличении температуры. 4) Протеканию отщепления способствует большой объем углеводородного радикала субстрата, что затрудняет атаку реагента по атому углерода. Склонность галогенпроизводных к реакциям отщепления возрастает в ряду: первичные < вторичные < третичные Взаимодействие оснований с третичные алкилгалогениды приводит в основном к отщеплению. Лекция № 11 АЛЬДЕГИДЫ И КЕТОНЫ Альдегиды и кетоны содержат карбонильную группу С=О. Общая формула:
Методы получения.
Химические свойства. Альдегиды и кетоны – один из наиболее реакционноспособных классов органических соединений. Их химические свойства определяются присутствием карбонильной группы. Вследствие большого различия в электроотрицательностях углерода и кислорода и высокой поляризуемости π -связи связь С=О обладает значительной полярностью (µС=О=2,5-2,8 D). Атом углерода карбонильной группы несет эффективный положительный заряд и является объектом для атаки нуклеофилов. Основной тип реакций альдегидов и кетонов – реакции нуклеофильного присоединения A N. Кроме того, карбонильная группа оказывает влияние на реакционную способность связи С-Н в α -положении, повышая ее кислотность. Таким образом, молекулы альдегидов и кетонов содержат два основных реакционных центра – связь С=О и связь С-Н в α -положении:
2.1. Реакции нуклеофильного присоединения. Альдегиды и кетоны легко присоединяют нуклеофильные реагенты по С=О связи. Процесс начинается с атаки нуклеофила по карбонильному атому углерода. Затем образующийся на первой стадии тетраэдрический интермедиат присоединяет протон и дает продукт присоединения:
Активность карбонильных соединений в AN–реакциях зависит от величины эффективного положительного заряда на карбонильном атоме углерода и объема заместителей у карбонильной группы. Электронодонорные и объемистые заместители затрудняют реакцию, электроноакцепторные заместители повышают реакционную способность карбонильного соединения. Поэтому альдегиды в AN–реакциях активнее, чем кетоны:
Активность карбонильных соединений повышается в присутствии кислотных катализаторов, которые увеличивают положительный заряд на карбонильном атоме углерода:
Альдегиды и кетоны присоединяют воду, спирты, тиолы, синильную кислоту, гидросульфит натрия, соединения типа NH2X. Все реакции присоединения идут быстро, в мягких условиях, однако образующиеся продукты, как правило, термодинамически не устойчивы. Поэтому реакции протекают обратимо, и содержание продуктов присоединения в равновесной смеси может быть низким. Присоединение воды. Альдегиды и кетоны присоединяют воду с образованием гидратов. Реакция протекает обратимо. Образующиеся гидраты термодинамически не стабильны. Равновесие смещено в сторону продуктов присоединения только в случае активных карбонильных соединений.
Продукт гидратации трихлоруксусного альдегида хлоральгидрат – устойчивое кристаллическое соединение, которое используется в медицине как успокаивающее и снотворное средство. Присоединение спиртов и тиолов. Альдегиды присоединяют спирты с образованием полуацеталей. При избытке спирта и в присутствии кислотного катализатора реакция идет дальше – до образования ацеталей
Реакция образования полуацеталя протекает как нуклеофильное присоединение и ускоряется в присутствии кислот или оснований.
Процесс образования ацеталя идет как нуклеофильное замещение ОН группы в полуацетале и возможен только в условиях кислотного катализа, когда группа ОН превращается в хорошую уходящую группу (H2O).
Образование ацеталей – обратимый процесс. В кислой среде полуацетали и ацетали легко гидролизуются. В щелочной среде гидролиз не идет. Реакции образования и гидролиза ацеталей играют важную роль в химии углеводов. Кетоны в аналогичных условиях кеталей не дают. Тиолы как более сильные нуклеофилы, чем спирты, образуют продукты присоединения и с альдегидами, и с кетонами.
Присоединение синильной кислоты Синильная кислота присоединяется к карбонильным соединением в условиях основного катализа с образованием циангидринов.
Реакция имеет препаративное значение и используется в синтезе α-гидрокси- и α -аминокислот (см. лек. № 14). Плоды некоторых растений (например, горький миндаль) содержат циангидрины. Выделяющаяся при их расщеплении синильная кислота оказывает отравляющее действие. Присоединение бисульфита натрия. Альдегиды и метилкетоны присоединяют бисульфит натрия NaHSO3 c образованием бисульфитных производных.
Бисульфитные производные карбонильных соединений – кристаллические вещества, не растворимые в избытке раствора бисульфита натрия. Реакция используется для выделения карбонильных соединений из смесей. Карбонильное соединение может быть легко регенерировано обработкой бисульфитного производного кислотой или щелочью:
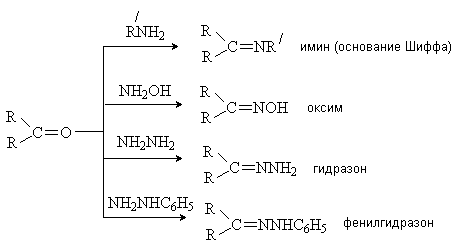
Взаимодействие с соединениями общей формулы NH2X. Реакции протекают по общей схеме как процесс присоединения-отщепления. Образующийся на первой стадии продукт присоединения не устойчив и легко отщепляет воду:
По приведенной схеме с карбонильными соединениями реагируют аммиак, первичные амины, гидразин, замещенные гидразины, гидроксиламин:
Образующиеся производные представляют собой кристаллические вещества, которые используют для выделения и идентификации карбонильных соединений. 2.2. Реакции по α -углеродному атому. Кето-енольная таутомерия. Водород в α -положении к карбонильной группе обладает кислотными свойствами, так как образующийся при его отщеплении анион стабилизируется за счет резонанса:
Результатом протонной подвижности атома водорода в α -положении является способность карбонильных соединений к образованию енольных форм за счет миграции протона из α -положения к атому кислорода карбонильной группы:
Кетон и енол являются таутомерами. Таутомеры – это изомеры, способные быстро и обратимо превращаться друг в друга за счет миграции какой-либо группы (в данном случае – протона). Равновесие между кетоном и енолом называют кето-енольной таутомерией. Большинство карбонильных соединений существуют преимущественно в кетонной форме. Содержание енольной формы возрастает с увеличением кислотности карбонильного соединения, а также в случае дополнительной стабилизации енольной формы за счет водородной связи или за счет сопряжения. Таблица 8. Содержание енольных форм и кислотность карбонильных соединений
Например, в 1,3-дикарбонильных соединениях подвижность протонов метиленовой группы резко увеличивается за счет электроноакцепторного влияния двух карбонильных групп. Кроме того, енольная форма стабилизируется за счет наличия в ней системы сопряженных α -связей и внутримолекулярной водородной связи:
Енолизация и образование енолят-анионов являются первыми стадиями реакций карбонильных соединений, протекающих по α -углеродному атому. Важнейшими из них являются галогенирование и альдольно-кротоновая конденсация. Галогенирование Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2, Br2, I2) с образованием α –галогенпроизводных:
Реакция катализируется кислотами или основаниями. Скорость реакции не зависит от концентрации и природы галогена. Процесс протекает через образование енольной формы (медленная стадия), которая затем реагирует с галогеном (быстрая стадия). Таким образом, галоген не участвует в скорость-определяющей стадии процесса.
Если карбонильное соединение содержит несколько α -водородных атомов, то замещение каждого последующего происходит быстрее, чем предыдущего, вследствие увеличения их кислотности под действием электроноакцепторного влияния галогена. В щелочной среде ацетальдегид и метилкетоны дают тригалогенпроизводные, которые затем расщеплятся под действием избытка щелочи с образованием тригалогенметанов (галоформная реакция):
Реакции конденсации В присутствии каталитических количеств кислот или щелочей карбонильные соединения, содержащие α -водородные атомы, претерпевают конденсацию с образованием α-гидроксикарбонильных соединений.
В образовании связи С-С участвуют карбонильный атом углерода одной молекулы (карбонильной компоненты) и α -углеродный атом другой молекулы (метиленовой компоненты). Эта реакция носит название альдольной конденсации (по названию продукта конденсации ацетальдегида – альдоля). При нагревании реакционной смеси продукт легко дегидратируется с образованием α,ß -непредельного карбонильного соединения:
Такой тип конденсации носит название кротоновой (по названию продукта конденсации ацетальдегида – кротонового альдегида). В качестве метиленовой компоненты в реакциях конденсации могут выступать не только карбонильные соединения, но и другие С-Н-кислоты. Реакции конденсации имеют препаративное значение, так как позволяют наращивать цепь углеродных атомов. По типу альдольной конденсации и ретроальдольного распада (обратный процесс) протекают многие биохимические процессы: гликолиз, синтез лимонной кислоты в цикле Кребса, синтез нейраминовой кислоты.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 13081; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.99.39 (0.013 с.) |