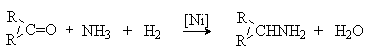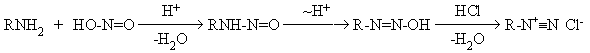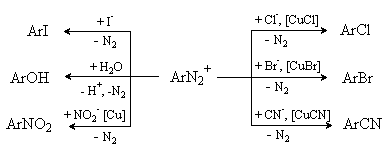Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологически важные гидроксикислоты.Содержание книги
Поиск на нашем сайте Гликолиевая кислота HOCH2COOH содержится во многих растениях, например, свекле и винограде. Молочная кислота (соли лактаты) CH3CH(OH)COOH. Яблочная кислота (соли малаты) HOOCCH(OH)CH2COOH.
Лимонная кислота (соли цитраты)
Содержится в плодах цитрусовых, винограде, крыжовнике. Является ключевым соединением в цикле трикарбоновых кислот. Образуется из щавелевоуксусной кислоты путем конденсации ее с ацетилкоферментом А и далее в результате последовательных стадий дегидратации и гидратации превращается в изолимонную кислоту.
Винная кислота (соли тартраты) HOOCCH(OH)CH(OH)COOH. Оксокислоты Оксокислоты – гетерофункциональные соединения, содержащие карбоксильную и карбонильную (альдегидную или кетонную) группы. В зависимости от взаимного расположения этих групп различают γ -, α -, ß - и т.д. оксокарбоновые кислоты. Для получения оксокислот применимы обычные методы введения карбоксильной и оксогрупп. 2.2. Химические свойства Оксокислоты вступают в реакции, характерные для карбоксильной и карбонильной групп. Отличительная черта оксокислот – легкость, с которой протекает их декарбоксилирование. α -Оксокислоты легко отщепляют СO2 и СО при нагревании в присутствии серной кислоты.
ß -Оксокислоты неустойчивы и самопроизвольно декарбоксилируются с образованием кетонов. CH3COCH2COOH CH3COCH3 + CO2 ß -Оксокислоты и их эфиры обладают специфическими свойствами, которые связаны с их повышенной СН-кислотностью. ß -оксокислоты существуют в виде двух таутомерных форм: кетонной и енольной, причем содержание енольной формы в равновесной смеси значительное. Енольные формы дополнительно стабилизируются за счет внутримолекулярной водородной связи.
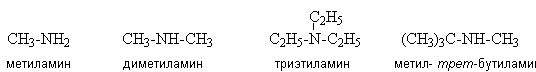
Лекция № 13 АМИНЫ Амины можно рассматривать как производные аммиака, в котором атомы водорода замещаются на углеводородные радикалы. Классификация В зависимости от числа углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины, а также четвертичные аммониевые соли.
По природе углеводородного радикала, связанного с атомом азота, различают алкиламины, алкилариламины, ариламины, гетероциклические амины. Алкиламины содержат только алифатические углеводородные радикалы, например:
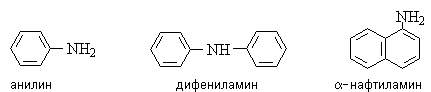
Ариламины содержат ароматические радикалы с атомом азота в ароматическом кольце, например:
Алкилариламины содержат алифатические и ароматические радикалы, например:
Гетероциклические амины содержат атом азота в цикле, например:
Методы получения.
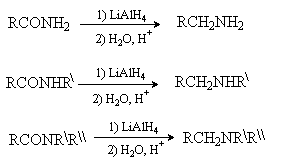
ArNO2 В качестве восстановителей используют водород в присутствии катализаторов (Ni, Pt, Pd), металл (Fe, Zn, Sn) и кислоту, соли металлов в низших степенях окисления (SnCl2, TiCl3). Нитрилы при восстановлении также дают первичные амины. RCN [H]: H2/Ni; LiAlH4 Амиды карбоновых кислот в осстанавливаются до аминов комплексными гидридами металлов. Из соотвествующих амидов могут быть получены первичные, вторичные и третичные амины.
3) Восстановительное аминирование альдегидов и кетонов.
4.Перегруппировка Гофмана. Используется для получения первичных аминов.
Химические свойства аминов определяются присутствием атома азота с неподеленной парой электронов, наличие которой обуславливает их основные и нуклеофильные свойства. Алифатические амины являются сильными основаниями и превосходят по основности аммиак. Их водные растворы имеют щелочную реакцию. RNH2 + H2O = RNH3+ + OH - Ароматические амины – слабые основания, что связано с разрушением при протонированиии стабильной сопряженной системы, в которой участвует неподеленная пара электронов азота. При взаимодействии с кислотами амины образуют растворимые в воде аммониевые соли. RNH2 + HX → RNH3+ X - Первичные и вторичные амины являются слабыми N-H кислотами (рКа=33-35) и образуют соли при взаимодействии с активными металлами. RNH2 + Na → RNH- Na+ + 1/2 H2 Нуклеофильные свойства Алкилирование аминов Амины обладают нуклеофильными свойствами и алкилируются алкилгалогенидами и спиртами (см. методы получения). Ацилирование аминов Амины ацилируются карбоновыми кислотами и их производными с образованием амидов карбоновых кислот. 2RNH2 + R/COX → R/CONHR + RNH3X (X=Cl, OCOR/) Взаимодействие аминов с азотистой кислотой Первичные, вторичные и третичные амины по-разному взаимодействуют с азотистой кислотой, что используется для установления типа амина. Неустойчивую азотистую кислоту генерируют действием сильной кислоты на нитриты. Третичные алифатические амины при обычной температуре с азотистой кислотой не взаимодействуют. Вторичные амины образуют с азотистой кислотой устойчивые нитрозамины – жидкие или твердые продукты желтого цвета. R2NH + NaNO2 + HCl R2N-N=O + NaCl + H2O нитрозамин Нитрозамины являются сильными канцерогенами. Показана возможность синтеза нитрозаминов в желудке человека из содержащихся в пище и лекарственных препаратах вторичных аминов и нитритов Канцерогенное действие нитрозаминов основано на их способности алкилировать нуклеофильные центры ДНК, что приводит к онкогенным мутациям. Первичные алифатические амины реагируют с азотистой кислотой с выделением газообразного азота. Реакция идет через образование неустойчивого первичного нитрозамина, который изомеризуется в диазогидроксид, превращающийся далее в соль диазония.
нитрозамин диазогидроксид соль диазония Дальнейший ход реакции зависит от природы углеводородного радикала. Если R – алифатический радикал, то соль диазония очень неустойчива и немедленно разлагается с образованием молекулы азота и карбокатиона, который затем взаимодействует с находящимися в реакционной среде нуклеофилами (например, с растворителем) или отщепляет протон и дает продукт элиминирования. Например, превращения катиона н-пропилдиазония могут быть представлены следующей схемой:
Реакция не имеет препаративного значения. Процесс используется в аналитических целях для количественного определения первичных алифатических аминов, в том числе природных α -аминокислот, по объему выделяющегося азота. Соли арилдиазония более устойчивы и могут быть выделены из реакционной смеси. Они являются высокореакционноспособными соединениями и широко используются в органическом синтезе. Реакции солей арилдиазония Процесс получения ароматических диазосоединений называется диазотированием и выражается следующим суммарным уравнением. ArNH2 + NaNO2 + 2HCl → ArN2+Cl- + NaCl + 2H2O Реакции солей арилдиазония можно разделить на два типа: реакции с выделением азота и реакции без выделения азота. Реакции, протекающие с выделением азота. Этот тип реакций представляет собой замещение в ароматическом кольце, уходящей группой в котором является молекула азота N2.
Реакции используются для введения различных заместителей в ароматическое кольцо. Реакции, протекающие без выделения азота. Наиболее важной реакцией этого типа является азосочетание. Катион диазония обладает слабыми электрофильными свойствами и вступает в реакции электрофильного замещения с аренами, содержащими сильные электронодонорные заместители. При этом образуются азосоединения.
Азосоединения содержат длинную систему сопряженных связей и поэтому окрашены. Они используются как красители. Образование окрашенных соединений при взаимодействии солей арилдиазония с ароматическими аминокислотами (тирозин, гистидин) используется для их качественного и количественного определения. Реакции ароматического кольца ариламинов Аминогруппа является сильным активирующим заместителем и ориентантом 1 рода. Анилин легко бромируется бромной водой с образованием триброманилина.
В большинстве реакций электрофильного реакционноспособная аминогруппа предварительно защищается путем ацилирования. После проведения реакции ацильную защиту снимают кислотным или щелочным гидролизом.
Лекция № 15
|
||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 637; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.009 с.) |



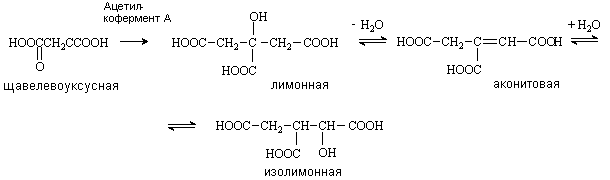






 ArNH2
ArNH2