
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции с участием боковых цепей алкилбензолов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Галогенирование Толуол хлорируется на свету или в присутствии перекисей только по метильной группе с образованием первоначально бензилхлорида, и затем бензальхлорида и бензотрихлорида:
Реакция протекает по цепному радикальному механизму через образование бензильного радикала, который отличается повышенной термодинамической стабильностью. Стабильность бензильного радикала объясняется сопряжением неспаренного электрона, расположенного на р- орбитали, с π - электронами бензольного кольца. Радикальное хлорирование высших алкилбензолов протекает н ерегиоселективно. Так, например, при хлорировании этилбензола на свету образуются следующие продукты:
В отличие от хлорирования бромирование осуществляется исключительно в α -положение по отношению к бензольному кольцу. Различие в селективности хлорирования и бромирования связано с более высокой реакционной способностью атомарного хлора, а более реакционноспособный реагент, как правило, менее селективен. Окисление Алкильные группы, связанные с кольцом, легко окисляются под действием окислителей, таких как Na2Cr2O7 или KMnO4. В результате образуются продукты окислительной деструкции боковых цепей - ароматические карбоновые кислоты:
Реакции с разрушением ароматической системы. Гидрирование Хотя ароматическое кольцо бензола гидрируется в значительно более жестких условиях, чем двойная или тройная связь алкенов и алкинов, бензол и его производные могут быть прогидрированы до производных циклогексана:
Хлорирование Бензол не подвергается свободнорадикальному замещению по действием хлора или брома. Энергетически предпочтительнее оказывается радикальное присоединение хлора к бензолу с образованием гексахлорциклогексана при УФ-облучении:
Окисление Бензольное кольцо, в силу своей особой стабильности, устойчиво к действию большинства окислителей. В очень жестких условиях бензол окисляется в малеиновый ангидрид. Конденсированные ароматические углеводороды более реакционноспособны в реакциях окисления, чем бензол. Лекция № 9 ГАЛОГЕНПРОИЗВОДНЫЕ План Галогенпроизводные - это производные углеводородов, в которых один или несколько атомов водорода замещены на галоген. В зависимости от типа гибридизации атома углерода, связанного с атомом галогена, различают следующие основные типы галогенпроизводных: Галогенпроизводные, содержащие связь С(sр3)- HaI Галогенпроизводные, содержащие связь С(sр2)- HaI, С(sр)- HaI
Методы получения
RH + Hal2 → RHal + HHal Hal:Cl, Br.
RCH=CH2 + HHal → RCHHalCH3 RC ≡CH + HHal → RCHal=CH2 + HHal→ RCHal2CH3
RCH=CH2 + Hal2 → RCHHalCH2Hal
ROH + HBr → RBr +H2O
Hal:Cl, Br. Химические свойства Галогенпроизводные содержат два основных реакционных центра – σ-связь С-Hal и σ-связь С-Н в ß -положении к атому галогена. Атом углерода, связанный с атомом галогена несет частичный положительный заряд и может атаковаться нуклеофилами. Атом водорода в ß -положении обладает слабыми кислотными свойствами и может отщепляться под действием оснований. Таким образом, основные типы реакций, характерные для галогенпроизводных, – это реакции нуклеофильного замещения (SN) и отщепления (E), причем различие в реакционной способности галогенпроизводных разного типа в этих реакциях очень велико. Галогенпроизводные, содержащие кратные связи или бензольное кольцо, вступают также в реакции, характерные для ненасыщенных и ароматических углеводородов, с учетом влияния на эти реакционные центры атома галогена, что было рассмотрено ранее (присоединение галогеноводородов к винилхлориду, электрофильное замещение в галогенаренах).
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 611; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.251.22 (0.007 с.) |

 +3CI2 →
+3CI2 →  + 3НCI
+ 3НCI и
и 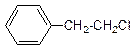
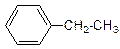 +[О] →
+[О] → 
 [О] →
[О] → 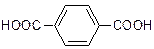
 + 3Н2 →
+ 3Н2 → 
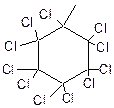
 + CI2 →
+ CI2 →  +НCI
+НCI


