
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация химических реакций.Содержание книги
Поиск на нашем сайте Химическая реакция это превращение, приводящее к изменению строения, элементного состава или конфигурации и органического соединения. В общем случае химическая реакция может быть представлена следующим уравнением:
Субстрат – органическое соединение, принимающее участие в химической реакции. Обычно (но не всегда) субстрат – более сложная молекула в системе, структура которой определяет структуру продукта реакции. Реагент является вторым компонентом химической реакции, обычно, небольшая органическая или неорганическая молекула. Условия проведения реакции – внешние условия, благоприятствующие ее протеканию: температура, давление, определенный растворитель. Катализатор – вещество, ускоряющее химическую реакцию, но не участвующее в ней непосредственно. Одной из стадий любой химической реакции является разрыв химической связи. В органических реакциях он может протекать по одному из двух механизмов: 1. Гомолитический разрыв связи. При гомолитическом разрыве каждая из образующихся частиц получает по одному неспаренному электрону, Гомолитический разрыв приводит к образованию свободных радикалов:
2. Гетеролитический разрыв связи. При гетеролитическом разрыве химическая связь рвется таким образом, что одна из частиц, обладающаяменьшейэлектроотрицательностью,теряетэлектроныиприобретаетположительныйзаряд, вторая частица приобретает оба электрона и заряжается отрицательно:
Положительно заряженная частица называется электрофилом (E+), а отрицательно заряженная– нуклеофилом (Nu). Таким образом, три типа частиц могут участвовать в химической реакции: 1. Свободные радикалы, образовавшиеся при гомолитическом разрыве: ×Cl, ×CH3. 2. Электрофильные реагенты (E+), такие какH+, +CH3, Br+. 3. Нуклеофильные реагенты (Nu), такие какOH-, NO2-, Br- Выделяют следующие типы химических реакций 1. Замещение (S) 2. Присоединение (A) 3. Элиминирование (отщепление) (E) 4. Перегруппировка 5. Окисление [O] и восстановление [H] Механизм химической реакции – это последовательность стадий, через которую протекает химическая реакция. Механизм химической реакции определяется характером субстрата, типом химического превращения и природой реагента. Обозначатся двухбуквенным кодом, в котором первая буква обозначает тип химической реакции, а индекс – тип реагента. Например: АN – нуклеофильное присоединение; SE – электрофильное замещение и т.д.
Механизмы реакций, характерные для различных классов органических соединений
Тема 2. Структура, свойства, биологическое значение карбонових кислот и их функциональных производных АКТУАЛЬНОСТЬ ТЕМЫ Карбоновые кислоты и их эфиры в большом количестве распространены в природе. Запахи цветов, плодов, ягод обусловлены эфирными веществами. Карбоновые кислоты и их производные поступают в организм человека с пищей, а затем превращаются в более простые вещества. Карбоновые кислоты и их соли входят в состав буферных систем (бикарбонатной, фосфатной, гемоглобиновой и др.), которые поддерживают постоянство рН крови и тканей. Некоторые карбоновые кислоты и их соли являются лекарственными препаратами. Например, изовалериановая кислота входит в состав валидола, бензоат натрия – отхаркивающее и слабо дезинфицирующее средство, уретаны - эфиры карбаминовой кислоты обладают снотворным и транквилизирующим действием и применяются в психиатрической практике. Знание структуры и свойств карбоновых кислот поможет в успешном изучении курсов биохимии, фармакологии и других медицинских дисциплин. ЦЕЛИ ОБУЧЕНИЯ ОБЩАЯ ЦЕЛЬ: Уметь прогнозировать химические свойства карбоновых кислот и их производных, которые берут участие в протекании большинства биохимических процессов. Достижение этой цели обеспечивается выполнением конкретных целей. КОНКРЕТНЫЕ ЦЕЛИ: УМЕТЬ: 1. Идентифицировать карбоксильную группу. 2. Различать реакции, которые проходят по функциональной группе и по углеродному скелету. 3. Прогнозировать химические свойства карбоновых кислот на основании электронного строения их молекул. 4. Прогнозировать свойства дикарбоновых и ненасыщенных кислот и их специфические реакции. 5. Интерпретировать биологическую роль карбоновых кислот и их производных. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ 1. Классификация и номенклатура карбоновых кислот (Приложение 4.). Электронное представление о строении карбоксильной группы. 2. Химические свойства карбоновых кислот. Кислотные свойства - образование солей. Реакции нуклеофильного замещения (SN) взаимодействие со спиртами (реакция этерификации), с аммиаком и аминами, образование ангидридов, замещение водорода при α-углеродном атоме, декарбоксилирование. 3. Классификация и номенклатура дикарбоновых кислот. Реакции образования солей, амидов и сложных эфиров. Отношение к нагреванию. 4. Ненасыщенные дикарбоновые кислоты. Химические свойства. 5. Медико-биологическое значение карбоновых кислот (Приложение 5).
Основная литература 1. Губський Ю.І. Біоорганічна хімія: Підручник. – Вінниця: Нова книга, 2004. – С.126-141
Решение обучающих задач Задача 1. В тканях человека посредством целого ряда реакций происходят разнообразные превращения карбоновых кислот и их производных. Напишите цепочку превращений малоновой кислоты, назовите вещества А и В:
Эталон решения: 1. Первая реакция протекает с выделением СО2, следовательно, это реакция декарбоксилирования. В результате декарбоксилирования малоновой кислоты образуется уксусная кислота (вещество А): HOOC – CH2 – COOH 2. Вторая стадия – это реакция вещества А (уксусной кислоты) с этиловым спиртом – реакция этерификации: Реакция этерафикации уксусной кислоты этиловым спиртом протекает по уравнению:
В результате реакции образуется сложный эфир (вещество В). Его название согласно номенклатуре IUPAC: этилацетат. НАБОР ЗАДАНИЙ ДЛЯ КОНТРОЛЯ САМОПОДГОТОВКИ Задание 1. В организме человека протекают реакции гидролиза сложных эфиров. Какая кислота образуется при гидролизе метилацетата? А. Уксусная В. Щавелевая C. Молочная D. Малоновая Е. Муравьиная Задание 2. Щавелевая кислота содержится в щавеле и может попадать в организм с пищей. Чем следует подействовать на щавелевую кислоту, чтобы получить ее амид? А. Раствор NaOH В. C2H5OH С. NH3 D. Метиламин E.CH3COOH
Задание 3. Дикарбоновые кислоты участвуют в цикле трикарбоновых кислот. Какая из приведенных кислот образует циклический ангидрид при нагревании? А. НООС-СООН В. НООС-СН2-СООН С. НООС-СН2-СН2-СООН D. НООС-(СН2)4-СООН E. НООС-(СН2)5-СООН
Задание 4. Масляная кислота содержится в прогорклом масле. Определите, как называется эта кислота по номенклатуре ИЮПАК. А. Пропановая В. Бутановая С. Оксибутановая D. Оксобутановая E. 2,3- диметилбутановая
Задание 5. Назовите следующее соединение: НООС-СН2-СООН А. Щавелевая кислота В. Акриловая кислота С. Малоновая кислота D. Янтарная кислота Е. Фумаровая кислота
Задание 6. Назовите следующее соединение: СН2=СН-СООН А. Щавелевая кислота В. Акриловая кислота С. Малоновая кислота D. Янтарная кислота Е. Фумаровая кислота
Задание 7. К уксусной кислоте был добавлен этанол. Какой продукт реакции получился? К какому классу относится данное соединение? А. Диэтиловый эфир, простые эфиры В. Этилацетат, простые эфиры С. Этилацетат, сложные эфиры D. Уксусный ангидрид, ангидриды Е. Диэтиловый эфир, сложные эфиры
Задание 8. Уксусный ангидрид широко используется в промышленности. Каким реагентом обрабатывают уксусную кислоту, чтобы его получить? А. Р2О5 В. НСl С. Н3РО4 D. РСl5 Е. NН3
Задание 9. Студенту дали задание получить в лаборатории бутановую кислоту. Какие реактивы ему нужно использовать? А. Бутанон + Ag2О/NН3 В. Бутанол + Ag2О/NН3 С. Бутаналь + Ag2О/NН3 D. Бутан + Ag2О/NН3 Е. Бутен + Ag2О/NН3
Задание 10. Осуществите цепочку превращений и назовите вещества А, В, С:
Эталоны ответов: 1 – А, 2 – C, 3 – C, 4 – B, 5 – C, 6 – B, 7 – C, 8 – A, 9 – C.
Приложение 4.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 594; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |



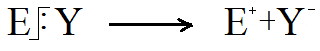

 CH3 – COOH + CO2
CH3 – COOH + CO2




