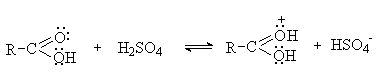Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фенолы. Химические свойства.Содержание книги
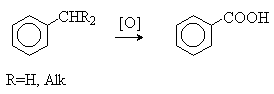
Поиск на нашем сайте Кислотные свойства Фенолы являются более сильными кислотами, чем спирты, что обусловлено стабилизацией фенолят-аниона за счет делокализации отрицательного заряда по ароматическому кольцу. Нуклеофильные свойства фенолов Фенолы являются более слабыми нуклеофилами, чем спирты, что связано со значительным снижением электронной плотности на атоме кислорода вследствие сопряжения ОН группы с ароматическим кольцом. Для увеличения нуклеофильности фенолы переводят в феноляты, которые легко алкилируются и ацилируются с образованием соответственно простых и сложных эфиров. Реакции электрофильного замещения в ароматическом кольце фенолов Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто- и пара- положения. Активирующее влияние гидроксильной группы настолько сильно, что в отдельных случаях реакцию трудно остановить на стадии введения только одного заместителя. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами. Фенол легко бромируется бромной водой с образованием трибромфенола.
Окисление фенолов. Хиноны Фенолы легко окисляются. При окислении пространственно затрудненных фенолов образуются устойчивые феноксильные радикалы.
Хиноны широко распространены в природе и играют роль антибиотиков, пигментов, витаминов, коферментов.
Двухатомные фенолы – гидрохинон, резорцин, пирокатехин широко распространены в природе. Резорцин применяется как антисептическое средство при лечении кожных заболеваний. Гидрохинон является структурным элементом природных соединений, например, витаминов группы Е. Восстановительная способность гидрохинонового фрагмента используется в окислительно-восстановительных процессах, сопровождающих дыхание. Самим гидрохинон служит исходным веществом в синтезе многих лекарственных средств. Простые эфиры Простые эфиры можно рассматривать как производные спиртов, в которых атом водорода гидроксильной группы замещен на углеводородный радикал. По природе связанных с кислородом углеводородных радикалов различают: диалкиловые эфиры алкилариловые и диариловые эфиры циклические простые эфиры Методы получения
R-Hal + R/O-Na+ → R-OR/ + NaHal
Химические свойства
Простые эфиры обладают низкой реакционной способностью. Их реакции можно разделить на три группы: реакции по атому кислорода; реакции по С-Н связи в α -положении; реакции с разрывом связи С-О. Атом кислорода с неподеленными парами электронов обуславливает основные свойства простых эфиров. Простые эфиры являются слабыми основаниями и образуют оксониевые соединения при взаимодействии с сильными протонными кислотами и кислотами Льюиса. Реакции с разрывом связи С-О протекают в жестких условиях в присутствии сильных кислот. Алкоголят анион RO- является сильным основанием и плохой уходящей группой, поэтому его отщепления возможно только после предварительного превращения в хорошую уходящую группу путем протонирования. Лекция № 12 КАРБОНОВЫЕ КИСЛОТЫ Методы получения
Окислители: KМnO4 в кислой или нейтральной среде, K2Cr2O7 в кислой среде.
В качестве окислителей используют KMnO4, Na2Cr2O7, кислород в присутствии солей Co и Mn.
RC≡ N + H2O + NaOH → RCOONa + NH3
Карбоновые кислоты содержат карбоксильную группу
2.1. Кислотные свойства Карбоновые кислоты – одни из самых сильных органических кислот. Их водные растворы имеют кислую реакцию: RCOOH + H2O = RCOO- + H3O+ Карбоновые кислоты образуют соли при взаимодействии с активными металлами и большинством оснований: При взаимодействии с сильными неорганическими кислотами карбоновые кислоты могут проявлять основные свойства, присоединяя протон по карбонильному атому кислорода. Протонирование карбоновых кислот используется для активации карбоксильной группы в реакциях нуклеофильного замещения. Карбоновые кислоты образуют межмолекулярные водородные связи и существуют в основном в виде димеров.
|
||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 2372; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.01 с.) |




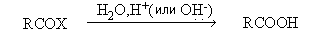
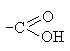 , в которой непосредственно связаны между собой карбонильная группа и гидроксил. Их взаимное влияние обуславливает новый комплекс свойств, отличных от свойств карбонильных соединений и гидроксилпроизводных. Реакции с участием карбоновых кислот протекают по следующим основным направлениям.
, в которой непосредственно связаны между собой карбонильная группа и гидроксил. Их взаимное влияние обуславливает новый комплекс свойств, отличных от свойств карбонильных соединений и гидроксилпроизводных. Реакции с участием карбоновых кислот протекают по следующим основным направлениям.