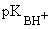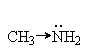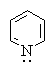Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние строения на силу кислот и оснований.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Сила кислоты зависит от природы атома при кислотном центре и от его структурного окружения. Для оценки относительной силы кислот важны такие характеристики атома при кислотном центре как его электроотрицательность и поляризуемость. При прочих равных условиях для элементов одного периода с ростом электроотрицательности атома кислотность соединений увеличивается, так как высокая электроотрицательность атома при кислотном центре стабилизирует образующийся при отщеплении протона анион. Так, кислотность уменьшается в ряду: OH-кислоты> NH-кислоты> CH-кислоты
Электроотрицательность атома зависит не только от его природы, но и от типа гибридизации и возрастает по мере увеличения s-характера гибридных орбиталей. Параллельно возрастает кислотность соединений:
Для элементов одной подгруппы с возрастанием заряда ядра кислотность соединений увеличивается: OH-кислоты < SH-кислоты
Увеличение кислотности соединений, несмотря на снижение электроотрицательности атомов в подгруппе, связано с увеличением их поляризуемости по мере возрастания радиуса атома. Большая поляризуемость атома способствует лучшей делокализации отрицательного заряда и повышению стабильности сопряженного основания. При одинаковой природе атома при кислотном центре сила кислоты определяется его структурным окружением. Увеличению силы кислоты способствует делокализация отрицательного заряда в сопряженном основании (анионе) и его рассредоточение на большем количестве атомов. Так, карбоновые кислоты – одни из самых сильных органических кислот. Их сила обусловлена стабилизацией карбоксилат-аниона за счет делокализации отрицательного заряда в сопряженной системе. В результате отрицательный заряд в карбоксилат-анионе рассредоточен между двумя атомами кислорода, а обе связи С-O абсолютно равноценны:
Фенолы являются более сильными кислотами, чем спирты, за счет резонансной стабилизации фенолят-аниона, отрицательный заряд которого делокализован по ароматическому кольцу:
В результате по силе органические OH-кислоты могут быть расположены в следующий ряд:
Введение заместителя в связанный с кислотным центром углеводородный радикал влияет на силу кислоты. Электроноакцепторные(ЭА) заместители увеличивают, а электронодонорные(ЭД) - уменьшают кислотность. Влияние электроноакцепторных заместителей связано с их способностью делокализовать отрицательный заряд и, тем самым стабилизировать сопряженное основание (анион). Влияние электронодонорных заместителей приводит к дестабилизации аниона. Электроноакцепторные заместители увеличивают силу алифатических и ароматических карбоновых кислот, электронодонорные заместители действуют в противоположном направлении:
Аналогичное влияние оказывают заместители на кислотность спиртов и фенолов. При одинаковом структурном окружении для элементов одного периода с ростом электроотрицательности атома при основном центре основность соединений уменьшается: аммониевые основания > оксониевые основани я
Снижение основности связано с тем, что более электроотрицательный атом прочнее удерживает неподеленную пару электронов, которую он должен отдать на образование связи с протоном. Увеличение s-характера гибридных орбиталей приводит к снижению основности:
Для элементов одной подгруппы с возрастанием заряда ядра основность уменьшается: оксониевые основания > сульфониевые основания Введение электронодонорных заместителей увеличивает, а введение электроакцепторных - понижает основность. Так, электронодонорные заместители увеличивают основность алифатических и ароматических аминов, увеличивая склонность электронной пары азота к атаке протона. Электроноакцепторные заместители напротив снижают электронную плотность неподеленной пары электронов азота и делают ее менее восприимчивой для атаки протоном:
Если свободная пара электронов азота находится в сопряжение с двойной связью или ароматическим кольцом, основность снижается. Так, в анилине свободная пара электронов азота сопряжена с ароматическим кольцом.
Протонирование анилина приводит к нарушению сопряжения и энергетически менее выгодно, чем протонирование алифатических аминов.
Амиды карбоновых кислот являются очень слабыми основаниями из-за сопряжения пары электронов азота с карбонильной группой. В результате атом азота приобретает частичный положительный, а атом кислорода – частичный отрицательный заряд, и протонирование амидов происходит, как правило, по атому кислорода.
Основность азотсодержащих гетероциклических соединений также определяется доступностью пары электронов азота для атаки протона. Высокой основностью обладают насыщенные азотсодержащие гетероциклы, в которых атом азота находится в состоянии sp3-гибридизации. Основность пиридиниевого атома азота (sp2-гибридизация) ниже. Наконец, пиррольный атом азота практических лишен основных свойств, так как его протонирование означает разрушение ароматической гетероциклической системы:
Кислоты и основания Льюиса Дж. Льюисом была предложена более общая теория кислот и оснований. Основания Льюиса – это доноры пары электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.) Кислоты Льюиса – это акцепторы пары электронов, т.е. соединения, имеющие вакантную орбиталь (ион водорода и катионы металлов: H+, Ag+, Na+, Fe2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3). Таким образом, основания Бренстеда и Льюиса – это одни и те же частицы. Однако основность по Бренстеду есть способность присоединять только протон, в то время как основность по Льюису – понятие более широкое и означает способность к взаимодействию с любой частицей, имеющей низколежащую свободную орбиталь. Кислотно-основное взаимодействие по Льюису есть доноро-акцепторное взаимодействие и любую гетеролитическую реакцию можно представить как взаимодействие кислоты и основания Льюиса:
Единой шкалы для сравнения силы кислот и оснований Льюиса не существует, так как их относительная сила будет зависеть от того, какое вещество взято за стандарт (для кислот и оснований Бренстеда таким стандартом является вода). Для оценки легкости протекания кислотно-основного взаимодействия по Льюису Р. Пирсоном была предложена качественная теория “жестких” и “мягких” кислот и оснований. Жесткие основания обладают высокой электроотрицательностью и низкой поляризуемостью. Они трудно окисляются. Их высшие занятые молекулярные орбитали (ВЗМО) имеют низкую энергию. Мягкие основания имеют низкую электроотрицательность и высокую поляризуемость. Они легко окисляются. Их высшие занятые молекулярные орбитали (ВЗМО) имеют высокую энергию. Жесткие кислоты имеют высокую электроотрицательность и низкую поляризуемость. Они трудно восстанавливаются. Их низшие свободные молекулярные орбитали (НСМО) имеют низкую энергию. Мягкие кислоты обладают низкой электроотрицательностью и высокой поляризуемостью. Они легко восстанавливаются. Их низшие свободные молекулярные орбитали (НСМО) имеют высокую энергию. Самая жесткая кислота - Н+, самая мягкая – СН3Hg+. Наиболее жесткие основания – F- и OH-, наиболее мягкие – I- и Н-. Таблица 5. Жесткие и мягкие кислоты и основания.
Принцип жестких и мягких кислот и оснований Пирсона (принцип ЖМКО): Жесткие кислоты преимущественно взаимодействуют с жесткими основаниями, а мягкие кислоты – с мягкими основаниями. Это выражается в больших скоростях реакций и в образовании более устойчивых соединений, так как взаимодействие между близкими по энергии орбиталями эффективнее, чем взаимодействие между орбиталями, значительно различающимися по энергии. Принцип ЖМКО используют для определения преимущественного направления конкурирующих процессов (реакции элиминирования и нуклеофильного замещения, реакции с участием амбидентных нуклеофилов); для направленного создания детоксикантов и лекарственных препаратов. Лекция № 5
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1195; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.238.204 (0.007 с.) |