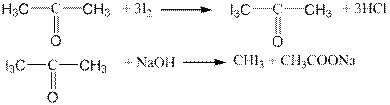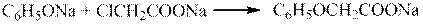Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
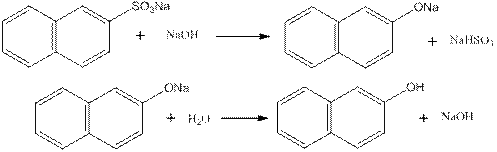
Получение натриевой соли 2-нафталинсульфокислотыСодержание книги
Поиск на нашем сайте
Реактивы: 2-нафталинсульфокислота, карбонат натрия. Оборудование: коническая колба (стакан), фарфоровая чашка, пипетки, плитка.
В термостойкой конической колбе или стакане на 100 мл растворяют в 10-15 мл воды 2,08 г (0,01 моль) 2-нафталинсульфокислоты при нагревании. К полученному раствору добавляют раствор 2,5 г (0,023 моль) карбонат натрия в 10 мл воды до щелочной реакции на лакмус. После охлаждения смесь фильтруют для отделения углекислого газа. Фильтрат упаривают в фарфоровой чашке до появления первых кристаллов. Полная кристаллизация продолжается несколько часов. Вторую фракцию кристаллов можно получить дальнейшим упариванием маточного раствора. Обе фракции сушат в фарфоровой чашке на водяной бане. Натриевая соль 2-нафталинсульфокислоты получается в виде мелких стекловидных пластинок (выход 66% от теоретического). Определите выход продукта.
Получение β - нафтола
Реактивы: гидроксид натрия, натриевая соль 2-нафталинсульфокислоты, 20%-ая соляная кислота. Оборудование: тигель, фарфоровая чашка, пипетки, плитка, термометр.
В тигле расплавляют 2,8 г (0,07 моль) гидроксида натрия в 5 мл воды. Когда температура плава достигнет 2800С, к нему при энергичном перемешивании, добавляют по возможности быстро 0,92 г (0,004 моль) натриевой соли 2-нафталинсульфокислоты, причем температура реакционной массы не должна опускаться 2600С. Затем температуру повышают до 3000С; реакционная масса при этом становится очень пористой вследствие выделения из нее водяного пара. Собственно реакция начинается при температуре 310-3200С и продолжается 5 минут. При температуре выше 3200С плав темнеет и становится жидким; его быстро выливают на железный противень. Застывшую массу измельчают в ступке и растворяют в возможно малом количестве воды. Раствор подогревают и подкисляют при перемешивании раствором соляной кислоты (1:1). При охлаждении β - нафтол выделяются в виде бесцветных игл. Кристаллы отфильтровывают и промывают подкисленной водой. Полученное вещество перекристаллизовывают из воды, слегка подкисленной соляной кислотой. Выход β - нафтола составляет около 70%; т. пл. 1220С.
После получения проведите идентификацию полученного вещества, используя в качестве эталона β - нафтол (имеющийся реактив). Для этого определите физические константы (температура плавления, растворимость и R f) и сделайте вывод (см. 3.5.) о структуре полученного вещества: β - нафтола и 2-нафталинсульфокислоты.
В отчете пишут уравнения реакции и механизм сульфирования нафталина.
Лабораторная работа №15 «Нитрование»
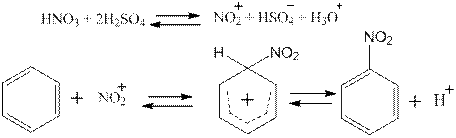
Введение в молекулу органического соединения нитрогруппы называется реакцией нитрования. Впервые ее осуществил Митчерлих при получении нитробензола. В зависимости от природы субстрата и характера нитрующего агента механизм реакции может быть различным. Так, введение нитрогруппы в ароматическое ядро протекает по электрофильному механизму. Для наиболее распространенного случая нитрования смесью концентрированных азотной и серной кислот на примере бензола можно представить следующей схемой:
Электрофильный характер реакции определяется атакой на молекулу бензола нитроний - катиона NO2+ c образованием промежуточного σ - комплекса и последующем отщеплением протона. Если для нитрования используется разбавленная азотная кислота, а в качестве субстрата углеводороды жирного ряда (реакция Коновалова, 1888), то процесс протекает по радикальному цепному механизму, который может осуществляться с участием азотной кислоты:
Для ароматического ряда выбор нитрующего агента определяется реакционной способностью нитруемого соединения в процессах электрофильного замещения. Для нитрования применяют азотную кислоту различной концентрации. При этом необходимо учитывать, что нитрование сопровождается образованием воды, которая, разбавляя азотную кислоту, может привести к остановке реакции. Во избежание влияния разбавления в реакционную среду в качестве водоотнимающего средства добавляют концентрированную серную кислоту. Особенно широко применяют заранее приготовленные смеси азотной и серной кислот (нитрующие смеси) в соотношении 1:1. В лабораторной практике часто используется нитрующая смесь из нитрата натрия или калия и концентрированной серной кислоты. Для получения нитросоединений ароматического и алифатического рядов используют также парафазное нитрование оксидами азота. Реакция нитрования экзотермична, т.е. происходит с выделением тепла. Очень много теплоты выделяется также при разбавлении серной кислоты водой. Поэтому во многих случаях проходиться прибегать к внешнему охлаждению содержимого колбы, а также практиковать медленное прибавление реагентов.
Практическая часть
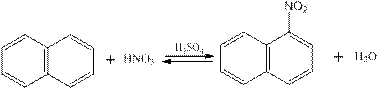
α - Нитронафталин
Реактивы: нафталин, серная кислота концентрированная, азотная кислота концентрированная, этиловый спирт. Оборудование: фарфоровый стакан вместимостью 50 мл; термометр; мешалка.
В фарфоровом стакане смешивают 2,5 мл серной кислоты с 2 мл воды и приливают 2 мл азотной кислоты. Температуру реакционной смеси отслеживают термометром, который помещен в смесь и укреплен в штативе. Нитрующую смесь нагревают до 500С и вносят 2,5 г хорошо измельченного нафталина. Реакционную смесь перемешивают на магнитной мешалке в течение 1 часа при 500С. Затем температуру повышают до 600С и перемешивают еще 1 час. После охлаждения реакционной массы полученный нитронафталин всплывает на поверхность кислоты в виде пористой лепешки. Продукт отделяют и промывают в фарфоровой чашке кипящей водой несколько раз. При этом с парами воды отгоняются остатки нафталина. Расплавленный нитронафталин выливают тонкой струей в стаканчик с холодной водой при сильном перемешивании. Застывший в виде мелких шариков продукт фильтруют и сушат на воздухе. После того как нитронафталин высохнет, определяют выход. Выход 86% от теоретического. Проведите очистку α - нитронафталина перекристаллизацией из этилового спирта. Выпавшие кристаллы после перекристаллизации отфильтровывают, высушивают. Затем определяют температуру плавления, растворимость и проводят ТСХ. Полученные данные сравнивают с теоретическими данными. α - Нитронафталин – желтый кристаллический продукт с Т. Пл. 600С. Растворяется в этаноле, эфире, хлороформе, ацетоне. Хроматография: адсорбент: Sorbfil, элюент: ацетон – петролейный эфир – бензол – метанол – водный раствор аммиака (концентрированный) (100:200:50:2). α - Нитронафталин вводится в ацетоновом растворе. R f =0.8.
В отчете пишут все наблюдения, уравнения реакции и механизм нитрования нафталина. Делают вывод о полученном продукте по результатам идентификации.
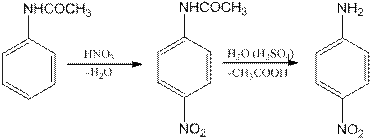
п - Нитроацетанилид и п - нитроанилин
Реактивы: ацетанилид, серная кислота концентрированная, 25%-ный раствор серной кислоты, азотная кислота концентрированная, 10%-ный раствор гидроксида натрия. Оборудование: фарфоровый стакан вместимостью 50 мл; термометр; мешалка.
В стаканчике на 50 мл растворяют при перемешивании 5 г ацетанилида в 10 мл концентрированной серной кислоте при температуре не выше 400С. Затем в охлажденный до 50С реакционный раствор медленно приливают при постоянном перемешивании смесь 4 мл концентрированной серной и 2,4 мл азотной кислоты, наблюдая за температурой, которая не должна быть выше 150С. Реакционную смесь выдерживают при этой температуре 45 мин и выливают в 250-300 мл охлажденной льдом водой. Отбирают для анализа пробу вещества, которую сушат при температуре 100-1500С. п - Нитроацетанилид – аморфное твердое вещество бледно-желтого цвета, труднорастворимое в большинстве органических растворителей, Т. пл. 2100С. Сырой п - нитроацетанилид помещают в колбу с обратным холодильником и кипятят с 26 мл 25%-ной серной кислоты до полного растворения. Горячий раствор фильтруют и подщелачивают 10%-ным раствором гидроксида натрия. После охлаждения выпавшие кристаллы п - нитроанилина отфильтровывают, промывают холодной водой и перекристаллизовывают из воды. Выход 4 г (78% от теоретического из расчета на ацетанилид). п - Нитроанилин – желтые кристаллы с т. пл. 1470С. Растворяется в этиловом спирте, ацетоне, эфире, плохо в воде. Хроматография: адсорбент: Sorbfil, элюент: ацетон – петролейный эфир – бензол – метанол – водный раствор аммиака (концентрированный) (100:200:50:2). α - Нитронафталин вводится в ацетоновом растворе. R f =0.7.
Определяют выход полученного вещества, температуру плавления, растворимость и проводят ТСХ и сравнивают полученные результаты с теоретическими данными. Делают соответствующий вывод.
Лабораторная работа №16 «Галогенирование»
Галогенированием называются реакция введения одного или нескольких атомов галогена в молекулу органического соединения. В зависимости от природы галогена различают фторирование, хлорирование, бромирование и иодирование, а в зависимости от количества вводимого – моно-, ди- и полигалогенирование. Методы введения галогена в органическое соединение могут быть разделены на две группы: 1. прямое галогенирование – замещение атома водорода галогеном, а также присоединение галогенов и галогенводородов по месту разрыва кратных связей; 2. непрямое галогенирование – замещение атомами галогена гидроксильной группы, кислорода карбонильной группы и диазагруппы органических соединений. Прямое галогенирование осуществляют с помощью галогенов (Cl2, Br2, I2) или смешанных галогенов (BrCl, FCl, ICl и т.д.) При непрямом галогенировании применяют галогенводородные кислоты и кислородсодержащие кислоты галогенов либо их соли со щелочными металлами. Иодоформ
Реактивы: ацетон, иод, иодид калия, 10%-ный раствор гидроксида натрия. Оборудование: стакан вместимостью 150 мл, воронка капельная.
В стакан помещают 2 г иодида калия, приливают 4 мл дистиллированной воды и после растворения соли добавляют 1 г иода. К полученному раствору приливают 10 мл воды. Затем в реакционную массу вводят 2,5 мл ацетона и при перемешивании по каплям добавляют из капельной воронки 10%-ный раствор гидроксида натрия до исчезновения красноватой окраски раствора. Иодоформ, который при этом выпадает в виде желтого кристаллического осадка, через 30 мин отфильтровывают, промывают небольшим количеством воды и высушивают на воздухе. Иодоформ (трииодметан) – твердое кристаллическое вещество желтого цвета со специфическим запахом и т. пл. 1190С. Растворяется в этиловом спирте, диэтиловом эфире, хлороформе. В воде практически не растворим. Под действием света быстро гидролизуется раствором щелочи, поэтому следует избегать сильнощелочной среды в процессе синтеза. Хроматография: адсорбент: Sorbfil, элюент: гексан – ацетон – бензол – метанол (20:20:5:1). Иодоформ вводится в ацетоновом растворе. R f =0.81.
Определяют выход полученного вещества, температуру плавления, растворимость и проводят ТСХ и сравнивают полученные результаты с теоретическими данными. Делают соответствующий вывод.
Лабораторная работа №17 «Алкилирование»
Реакциями алкилирования называют реакции, включающие замену атома водорода органического соединения алкильным радикалом. В зависимости от того, при каком атоме в молекуле происходит замещение водорода, N-, O-, и С-алкилирование. Независимо от природы реакционного центра субстрата и его строения, а также от строения алкилирующего агента во всех случаях процессы протекают по электрофильному механизму. Практическая часть
Феноксиуксусная кислота
Реактивы: фенол, хлоруксусная кислота, 10%-ный раствор соляной кислоты, 25%-ный раствор гидроксида натрия, 10%-ный раствор карбоната натрия, соляная кислота, диэтиловый эфир. Оборудование: круглодонная колба вместимостью 50 мл; обратный воздушный холодильник, делительная воронка, стакан на 100 мл, водяная баня, термометр; мешалка.
В круглодонной колбе смешивают 1 г фенола, 10 мл 25%-ного раствора гидроксида натрия и 2,4 г хлоруксусной кислоты. Осторожно, хлоруксусная кислота вызывает ожоги кожи! Смесь нагревают на кипящей водяной бане с воздушным обратным холодильником в течение 1 ч, а затем охлаждают 6 мл 10%-ной соляной кислоты до рН 3-5 и экстрагируют дважды эфиром порциями по 5 мл. Эфирные вытяжки осторожно смешивают в стакане с 10 мл раствора карбоната натрия. После прекращения выделения углекислого газа смесь встряхивают в делительной воронке. Эфирный слой отбрасывают, а водный медленно и осторожно при размешивании в стакане подкисляют концентрированной соляной кислотой до рН 3-5. Выпавшую феноксиуксусную кислоту отфильтровывают, промывают водой и высушивают на воздухе. Перекристаллизовывают из воды. Определите выход полученного вещества, температуру плавления, растворимость и проведите ТСХ и сравните полученные результаты с теоретическими данными. Сделайте соответствующий вывод. Феноксиуксусная кислота представляет собой бесцветные пластинки или иглы. Т. пл. 990С, плохо растворима в воде, хорошо – в этиловом спирте, диэтиловом эфире, бензоле, уксусной кислоте. Хроматография: бумага типа «быстрая» или адсорбент: Sorbfil, элюент: изопропиловый спирт – раствор аммиака - вода (6:1:1). Проявление в сушильном шкафу при 140-1500С в течение 30 мин, в результате появляется желтое пятно. R f =0.58.
Определяют выход полученного вещества, температуру плавления, растворимость и проводят ТСХ и сравнивают полученные результаты с теоретическими данными. Делают соответствующий вывод.
|
||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1703; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.008 с.) |