
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перед началом лабораторной работыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
547(07) К40 Д.Г. Ким, А.В. Журавлёва, Т.В. Тюрина ОРГАНИЧЕСКАЯ ХИМИЯ Учебное пособие Челябинск Издательство ЮУрГУ УДК 547(076.5) К40 Одобрено учебно-методической комиссией химического факультета Рецензенты: Д. х. н., профессор Козьминых В.О., Оренбургский государственный университет Кафедра органической химии Пермского государственного университета, зав. кафедрой, д.х.н., профессор Шуров С.Н.
Органическая химия: учебное пособие/ Д.Г. Ким, А.В.Журавлёва, Т.В.Тюрина. - Челябинск: Изд. ЮУрГУ, 2009. - 125 с.
Практикум по органической химии составлен в соответствии с программой дисциплины «Химия» для студентов нехимических специальностей высших учебных заведений. Пособие включает темы: изучение состава органических соединений их очистка и определение физических констант; ознакомительный (малый) практикум; методы синтеза органических соединений; идентификация органических соединений. Раздел «Изучение состава органических соединений их очистка и определение физических констант» включает качественный и функциональный анализ, тонкослойную хроматографию, перегонку, перекристаллизацию, возгонку, определение температуры плавления и кипения, показателя преломления. Ознакомительный (малый) практикум включает получение и изучение свойств важнейших представителей основных классов органических соединений: углеводородов, галогенпроизводных углеводородов, кислород- и азотсодержащих соединений и гетероциклических соединений. В части «Методы синтеза органических соединений» студенты осваивают основные методы синтеза основных представителей органических соединений с использованием различных реакций: нитрование, сульфирование, галогенирование, алкилирование, ацилирование, окисления и восстановления. Завершает пособие часть «Идентификация органических соединений», в которой студенты идентифицируют и устанавливают структуры органических соединений с использованием физических, химических и физико-химических методов анализа (инфракрасная спектроскопия, масс-спектрометрия, тонкослойная хроматография). В приложении приведены необходимые справочные данные для выполнения лабораторных работ. 1. ОСНОВНЫЕ ПРАВИЛА И ОРГАНИЗАЦИЯ РАБОТЫ В ЛАБОРАТОРИИ ОРГАНИЧЕСКОЙ ХИМИИ
1.1. Техника безопасности Общие положения Работа в лаборатории должна производиться только в халатах; запрещается работать в верхней одежде и головных уборах. Студенты обязаны соблюдать в лаборатории чистоту и порядок; во время работы следует поддерживать тишину. В лаборатории запрещается принимать пищу или класть продукты на рабочий стол. В случае какого бы то ни было происшествия необходимо немедленно сообщить об этом преподавателю и лаборанту. Перед началом лабораторной работы Получив от преподавателя разрешение на выполнение работы, студент должен обратиться к дежурному лаборанту и получить от него инструктаж по правилам работы на используемой установке; после этого с разрешения лаборанта студент может приступать к самостоятельной работе. Без разрешения преподавателя и лаборанта работать на приборах и установках категорически запрещается. При выполнении работы Категорически запрещается пробовать вещества на вкус, нюхать вещества из горлышек склянок, при растворении веществ в пробирке зажимать отверстие пальцем. Опыты проводить только с таким количеством веществ, которые обозначены в методическом руководстве по проведению каждого опыта. Наливать или насыпать вещества можно только над столом или специальным поддоном; просыпанные или случайно пролитые вещества надо немедленно убирать специальной тряпочкой. Горелку (или спиртовку) зажигать только спичкой или лучиной; спичку зажигают движением от себя (и от соседа). Нельзя ни в коем случае держать голову близко к пламени или наклоняться над ним. При нагревании вещества в пробирке ее сначала необходимо целиком прогреть над пламенем, нельзя сразу направлять пламя на границу поверхности жидкости в пробирке; отверстие пробирки во время ее нагревания должно быть направлено от себя и соседа. Нельзя ставить горячие пробирки в штатив из пластмассы. Необходимо соблюдать осторожность при работе со всякого рода электроприборами и электрооборудованием; при обнаружении неисправности следует прекратить работу, отключить прибор от сети и обратиться к преподавателю или лаборанту. По окончании работы По окончании работы студенты обязаны: выключить электроприборы, вымыть использованную посуду, закрыть водопроводные краны, убрать свое рабочее место, сдать лаборанту используемую посуду и реактивы и получить разрешение преподавателя покинуть лабораторию.
Оказание первой доврачебной помощи В случае пореза стеклом необходимо сначала убедиться, что в ранке нет осколков, и затем ватой, смоченной спиртом или раствором перманганата калия, удалить кровь, после чего края раны смазать иодом и забинтовать. При небольших термических ожогах следует смазать обожженное место глицерином или спиртом; при более значительных ожогах обожженное место следует смазать мазью от ожогов или концентрированным раствором перманганата калия и наложить повязку. Нельзя смазывать рану вазелином или жиром. При попадании на кожу кислоты необходимо немедленно смыть кислоту большим количеством воды, затем промыть пострадавшее место 3%-ным раствором соды и смазать мазью от ожогов. При ожогах щелочью обожженное место следует промыть водой и затем раствором борной кислоты. При попадании кислоты или щелочи в глаз необходимо промыть его водой, затем раствором соды или борной кислоты соответственно и внести в глаз каплю касторового масла. В более тяжелых случаях следует вызвать скорую помощь. Источники опасности при работе с органическими растворителями Органические растворители занимают особое место среди применяемых в лабораториях огнеопасных веществ. Они легко воспламеняются, быстро горят и с трудом тушатся. Пары многих органических растворителей даже при комнатной температуре способны образовывать с воздухом пожаровзрывоопасные смеси. Опасность применения и хранения органических растворителей зависит от ряда условий — количества и горючести жидкости, температуры, герметичности аппаратуры или тары, наличия источников воспламенения и т. д. Правила безопасности работы со стеклянной химической посудой и ампулами 1. При закрывании толстостенного сосуда пробкой следует держать его за верхнюю часть горла ближе к пробке; руки должны быть защищены полотенцем. 2. Нагретый сосуд нельзя закрывать притертой пробкой до тех пор, пока он не охладится. 3. При переливании жидкостей следует пользоваться воронкой. 4. При нагревании жидкости в пробирке отверстие последней должно быть направлено в сторону от себя и соседей. 5. При переносе сосуда с горячей жидкостью нужно пользовался полотенцем, держа сосуд за дно и горловину. 6. Работы, при которых возможно образование давления в сосуде, перегрев его, поломка и разбрызгивание горячих жидкостей, необходимо вести в вытяжном шкафу и по фронту работ устанавливать предохранительные щитки из оргстекла. 7. Смешение и разбавление веществ, сопровождающееся выделением тепла, следует проводить в термостойкой стеклянной или фарфоровой посуде. Практическая часть Опыт №1. Перекристаллизация бензойной кислоты из воды Реактивы: бензойная кислота (или реактив, предложенный преподавателем). Оборудование: стакан, колба, воронка, фильтр. В стакане вместимостью 50 мл растворяют при нагревании 0,1 г бензойной кислоты в 5 мл дистиллированной воды. Горячий раствор быстро отфильтровывают в колбочку через складчатый фильтр. Фильтрат охлаждают. Выпавшие кристаллы отфильтровывают и высушивают.
Опыт №2. Возгонка нафталина
Реактивы: нафталин (или реактив, предложенный преподавателем). Оборудование: песчаная баня, фарфоровая чашка, термометр, воронка, фильтр. Технический нафталин помещают в небольшую фарфоровую чашку, накрывают ее листом фильтровальной бумаги с мелкими проколами (20-30 отверстий) и плотно прижимают фильтровальную бумагу опрокинутой стеклянной воронкой, отверстие которой закрыто ватным тампоном (рис.3.11.). Чашку с веществом нагревают на песчаной бане, снабженной термометром, ртутный шарик которого должен находиться на уровне дна фарфоровой чашки. Нагревают чашку с веществом до температуры ниже Тпл нафталина на 10-200С. После того, как на стенках воронки появится налет вещества, прибор оставляют при данной температуре (отключить нагревательный прибор) на 1-1,5 часа.
1 – песчаная баня; 2 – фарфоровая чашка; 3 – воронка; 4 – термометр; 5 – возгоняемое вещество; 6 – ватный тампон.
За это время, возгоняющееся вещество будет проникать через отверстие в фильтровальной бумаге, и оседать на внутренних стенках воронки в виде крупных кристаллов.
Определяют температуры плавления бензойной кислоты и нафталина до и после их очистки. Взвешивают очищенные вещества и определяют выход чистого вещества в процентах.
Опыт №3. Экстракция анилина.
Реактивы: анилин, четыреххлористый углерод. Оборудование: делительная воронка, стаканы. В делительную воронку вместимостью 100 мл наливают 30 мл смеси анилина и воды (1:2) и добавляют 10 мл четыреххлористого углерода CCl4. Четыреххлористый углерод – один из немногих органических растворителей, имеющий большую плотность, чем вода (p =1,59 г/мл), поэтому он сразу опускается на дно воронки. Закрывают воронку стеклянной пробкой и несколько раз энергично встряхивают, чтобы слои перемешались. Затем для выравнивания давления воронку переворачивают краном вверх и приоткрыванием его выпускают образовавшиеся пары. Встряхивание с последующим приоткрыванием крана повторяют несколько раз. В результате анилин переходит в слой четыреххлористого углерода, т.е. экстрагируется им. После отстаивания и четкого расслоения разделяют образовавшиеся слои. В каком слое находится анилин: верхнем или нижнем? Полученный экстракт высушивают от воды путем добавления хлористого кальция. Для выделения анилина из экстракта используют перегонку (опыт №4).
Опыт №4. Разделение смеси анилина и четыреххлористого углерода простой перегонкой
Опыт выполняется преподавателем! Реактивы: раствор анилина в четыреххлористом углероде Оборудование: прибор для перегонки, колба, водяная баня, электрическая плитка. Собирают прибор для перегонки (рис. 3.12.). В круглодонную колбу вместимостью 50 мл через воронку наливают раствор анилина в четыреххлористом углероде, полученный в опыте №3. Помещают в колбу несколько «кипелок» для равномерного кипения. Закрывают колбу пробкой с вставленным в нее термометром так, чтобы ртутный шарик термометра находился на 0,5 см ниже отводящей трубки. Пускают воду в обратный холодильник, под колбу подводят водяную баню и начинают нагревать так, чтобы перегонка проходила с постоянной скоростью.
Рис. 3.12. Прибор для перегонки. На асбестовое сито 2, закрепленное в штативе 1, ставят колбу 3 с пробками, плотно закрепленными в горловинах. В верхней пробке делают отверстие для термометра 4, а в боковой - для трубки 6 с краном 5, которая соединяет колбу с холодильником Либиха 7. Колбу 3 выбирают такого размера, чтобы подвергаемая перегонке жидкость занимала 2/3 ее объема. Аллонж 8 опускают в колбу-приемник 10. Шланг 9 подсоединяют к крану с водой.
Температура кипения CCl4 76,50С. До температуры 800С перегоняется CCl4 (фракция 1). Затем убирают водяную баню, помещают под колбу асбестовую сетку и продолжают нагрев. Во время быстрого повышения температуры собирают в другую колбу промежуточную фракцию 2, а затем в интервале 180-1900С перегоняют анилин (фракция 3). Температура кипения анилина 1840С. Измеряют объемы фракций цилиндром.
Вопросы коллоквиума: 1. Перечислите методы очистки веществ и дайте им краткую характеристику. 2. Какие вещества можно очищать возгонкой? При какой температуре проводят возгонку? 3. На каком свойстве соединений основана перегонка? Лабораторная работа №2 «Определение физических констант органических соединений» К простейшим физическим константам веществ относятся температуры плавления и кипения, плотность вещества и показатель преломления. Температура плавления вещества – это температура, при которой вещество из твердого (кристаллического) состояния переходит в жидкое. Началом плавления считается момент размягчения вещества и переход его в жидкое состояние, а концом – образование прозрачной жидкости. Если вещество химически чистое, то его температура плавления колеблется в интервале 0,5-1,00С. Четкая температура плавления вещества является признаком его чистоты. Определение температуры плавления проводят обычно в приборе, состоящем из круглодонной (или плоскодонной) колбы с длинным горлом и широкой пробирки, вставленной в это горло через корковую пробку. В пробирку помещают термометр, на шарик которого надевают резиновое кольцо для закрепления капилляра (рис.3.13а). В капилляр помещают вещество, температуру которого определяют. Колбу заполняют глицерином и греют. Температуру плавления определяют визуально.
а) б) в) г)
Рис. 3.13. а) прибор Тиле для определения температуры плавления с естественной циркуляцией жидкости (часть между точками 1 и 2 обматывают тонким асбестовым картоном); б), в) упрощенные приборы для определения температуры плавления; г) Прибор для определения температуры кипения (по Сиволобову).
Жидкость кипит, когда давление ее паров равно атмосферному давлению, т.е. температура кипения жидкости зависит от давления. Обычно температуру кипения определяют по методу Сиволобова. В стеклянную трубочку помещают несколько капель исследуемой жидкости. Туда же погружают тонкий капилляр, запаянный с верхнего конца (рис. 3.13б). Трубку с жидкостью и капилляром прикрепляют к термометру. Когда при медленном нагревании из тонкого капилляра начинают выделяться пузырьки воздуха, температура кипения жидкости считается достигнутой. В настоящее время для определения температуры плавления веществ используют специальные аппараты: блок для определения температуры плавления (рис.3.14.,3.15.) и столик Кофлера.
Рис.3.14. Блок для определения температуры плавления: 1 – вольтметр; 2 – лампа для освещения; 3 - увеличительное стекло; 4 – трубка с термометром и нагревательной спиралью.
Рис.3.15. Прибор для определения температуры плавления с воздушным термостатированием и электрообогревом: 1 – подставка из изолирующего материала; 2 – кожух; 3 – рубашка с электрообогревом; 4 – капилляр с веществом; 5 – термометр.
Плотность вещества – это одна из его основных физических характеристик, численно равная массе единицы объема тела: ρ = m/ V где ρ – плотность вещества, m – масса,V – объем. Плотность вещества обычно уменьшается с ростом температуры (из-за теплового расширения тел) и увеличивается с повышением давления. Единицей плотности в международной системе единиц (СИ) служит кг/м3. На практике часто применяют г/см3, г/л. В ряде случаев предпочитают пользоваться относительной плотностью d, представляющей собой отношение плотности данного вещества к плотности другого при определенных условиях. Относительная плотность выражается отвлеченным числом. Обычно ее определяют по отношению к плотности дистиллированной воды при 4 0С. Относительную плотность жидкостей можно определять при помощи ареометров, пикнометров и специальных весов. Ареометры применяют для быстрого определения относительной плотности жидкости (рис.3.16.,3.17.).
Рис.3.16. Определение плотности вещества при помощи ареометра: 1 – шкала плотности; 2 – связующая масса; 3 – балласт (дробь); 4 – цилиндр с исследуемой жидкостью.
а) Постоянной массы (денсиметр) б) постоянного объема; 1 – шкала плотности; 2 – балласт (дробь); 3 – связующая масса; 4 – встроенный термометр; 5 – тарелка для гирь; 6 – метка.
Шкалы ареометров градуируются в единицах плотности или при определении концентрации растворов в процентах (по объему или по массе). В нижней части ареометра имеется шарик, заполненный дробью (реже – ртутью). Для определения относительной плотности жидкость наливают в широкий стеклянный цилиндр и осторожно погружают в нее ареометр. Прибор не должен касаться стенок сосуда. Чем больше относительная плотность жидкости, тем меньше в нее погружен ареометр. Значение относительной плотности показывает деление на шкале, против которого установился уровень жидкости. Для более точного определения относительной плотности пользуются пикнометрами вместимостью 1 -2 мл (рис. 3.18.,3.19.). Для этого пикнометр предварительно моют ацетоном, спиртом или эфиром, высушивают в сушильном шкафу, а затем взвешивают на аналитических весах при комнатной температуре пустым, потом с водой, а затем с исследуемой жидкостью. Находят массу равных объемов исследуемой жидкости и воды. Относительную плотность жидкости определяют по формуле: d = (m – m п) / B где m – масса пикнометра с исследуемой жидкостью; m п – масса пустого пикнометра; B – водное число пикнометра (численно равное отношению массы воды в объеме пикнометра при 200С к массе воды в объеме пикнометра при 40С).
Рис. 3.18. Пикнометры для определения относительной плотности жидкостей: а, б – Рейшауэра; в – Ренье; г – с капиллярной пробкой; д – Менделеева; е – Оствальда.
Рис.3.19. Определение плотности жидкости с помощью пикнометра.
Показатель преломления n – представляет собой отношение синуса угла падения света на поверхность раздела двух сред к синусу угла отражения света: n = sin α/ sin β. Эта величина используется для идентификации жидких веществ и характеристики их чистоты. Показатель преломления зависит от температуры и резко меняется с изменением длины волны света, поэтому измерения проводят при постоянной температуре и монохроматическом свете. Обычно опыт ведет при 200 С и при длине волны, соответствующей длине волны желтой линии натрия D (λ = 589,3 нм). Так, символ nD20 означает, что показатель преломления был определен для линии D при 200С. Для большинства жидких органических веществ показатель преломления находится в пределах от 1,3 до 1,8.
Рис.3.20. Рефрактометр ИРФ-22: 1- верхнее полушарие измерительной головки; 2, 9 – маховики; 3 – нижнее полушарие измерительной головки; 4 – осветительное зеркало; 5 – зеркало для освещения шкалы; 6 – окошко; 7 – зрительная труба; 8 – окуляр; 10 – термометр; 11 – ящик; 12 – гнездо для ключа.
Работа на рефрактометре проводится в следующем порядке: открывают верхнее полушарие измерительной головки (рис. 3.20.) и протирают смоченной эфиром ватой гипотенузные плоскости осветительной (А, рис.3.21.) и измерительной (Б, рис.3.21.) призм и дают эфиру испариться (сильно смачивать эфиром полушария 1 и 3 не следует). Поворотом маховика 2 надо привести измерительную головку в такое положение, чтобы плоскость нижнего полушария 3 и гипотенузная плоскость измерительной призмы (Б) приняли горизонтальное положение. Затем на плоскость измерительной призмы наносят посредством стеклянной палочки или капилляра несколько капель исследуемого вещества (палочка не должна касаться призмы) и осторожно закрывают верхнее полушарие 1 измерительной головки. Осветительное зеркало 4 устанавливают так, чтобы свет от источника поступал к осветительной призме и освещал поле зрения.
Рис.3.21. Измерительная головка
А – осветительная призма; Б – измерительная призма; 1 и 3 – полушария измерительной головки; 7 – зрительная труба; 8 – окуляр.
Зеркало 5 для освещения шкалы ставят в такое положение, чтобы свет поступал в окошко 6, освещающее шкалу прибора. Глядя в зрительную трубу этой границы (при этом она становится более рефрактометре ИРФ-22: четкой, хотя в некоторых случаях может а- шкала; б- вид перекрестия понадобиться дополнительная наводка на с границей света и тени. резкость). Показатель преломления зависит от температуры, поэтому при измерении она должна быть постоянной (200С). Показатель преломления уменьшается на 3-8 единиц в четвертом знаке после запятой при повышении температуры на 10С. Для наблюдения за постоянством температуры около измерительной головки вмонтирован термометр 9. Когда в измерительной головке установится постоянная температура, при помощи маховика 2 необходимо точно совместить границу раздела света и тени с перекрестием сетки (рис. 30б) и снять отчет по шкале показателя преломления. Показатель преломления измеряется с точностью до четвертого знака после запятой. Первые три цифры (1,45…) – это ближайшие, находящиеся ниже горизонтального штриха сетки цифры шкалы. Третий знак после запятой соответствует числу целых мелких делений, расположенных между ближайшим нижним оцифрованным делением и горизонтальным штрихом сетки. Четвертый знак после запятой получается визуально интерполяцией в пределах того деления, в котором находится горизонтальный штрих сетки. Так, например, в случае, изображенном на рис. 24а, показатель преломления равен 1,4593.
Практическая часть
Опыт №1. Определение температуры плавления.
Реактивы: реактив по указанию преподавателя. Оборудование: прибор для определения температуры плавления вещества, капилляры. По указанию преподавателя определяют температуру плавления вещества. Для этого в капилляр помещают вещество, температуру которого нужно определить. Затем аккуратно закрепляют капилляр с веществом на шарик термометра с помощью резинки. Помещают термометр в собранный заранее прибор (рис.17а) для определения температуры плавления. Колбу закрепляют в лапке штатива на расстоянии 2 см от поверхности плитки и нагревают. При переходе вещества в жидкое состояние отмечают температуру плавления вещества.
Опыт №2. Определение температуры кипения.
Реактивы: реактив по указанию преподавателя. Оборудование: прибор для определения температуры кипения вещества, капилляры. По указанию преподавателя определяют температуру кипения вещества. Для этого в стеклянную трубочку помещают несколько капель исследуемой жидкости. Туда же погружают тонкий капилляр, запаянный с верхнего конца (рис. 17б). Трубку с жидкостью и капилляром прикрепляют к термометру. Термометр закрепляют в лапке штатива на расстоянии 2 см от поверхности плитки и нагревают. Отмечают температуру, при которой начнут выделяться пузырьки воздуха.
Опыт №3. Определение показателя преломления одной из органических жидкостей.
Реактивы: реактив по указанию преподавателя. Оборудование: рефрактометр. На имеющемся в лаборатории рефрактометре определяют показатели преломления некоторых жидкостей по указанию преподавателя (например, этилового спирта, толуола, хлороформа, тетрахлорида углерода, анилина и т.д.) и сравнивают их с литературными данными.
Сравнивают полученные физические константы со справочными данными и делают вывод о точности данных методов определения температур плавлении, кипения и показателя преломления.
Вопросы коллоквиума:
1. Что такое температура плавления, температура кипения? 2. Достаточно ли определения температуры кипения или плавления для установления чистоты вещества? 3. Назовите методы определения плотности веществ. 4. Что такое показатель преломления? Для чего и как используется эта величина? 5. Почему приборы, предназначенные для определения показателя преломления, называются рефрактометрами? 6. От чего зависит значение показателя преломления? Практическая часть
Опыт №1. Открытие углерода и водорода сожжением вещества с оксидом меди (П).
Реактивы: порошок оксида меди (П), сахароза, безводный медный купорос, известковая вода. Оборудование: пробирки, пробка с газоотводной трубкой, вата, сухое горючее. Дня проведения эксперимента в пробирку «а» (рис. 31) насыпают черного порошка оксида меди (П) на высоту около 10 мм. Добавляют одну лопаточку сахарозы, тщательно перемешивают, энергично встряхивают пробирку. В верхнюю часть пробирки «а» вводят в виде пробки небольшой комочек ваты (рис. 3.23.). Насыпают на вату тонкий слой белого порошка - безводного медного купороса. Закрывают пробирку «а» пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в вату с CuSO4. Нижний конец трубки помещают в пробирку «б», предварительно наливают внее около 1-2 мл известковой воды. Конец газоотводной трубки должен быть погружен в известковую воду.
Рис.3.23. Открытие углерода и водорода Нагревают пробирку «а» на пламени горелки. Если пробка плотно закрывает пробирку, то через несколько секундиз газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, вследствие выделения белого осадка СаСОз, пробирку «б» убирают. Пробирку «а» продолжают нагревать по всей длине до ваты, пока пары воды не достигнут белого порошка -обезвоженного медного купороса, находящегося на ватном тампоне, и не вызовут посинения его вследствие образования кристаллогидрата CuSО4 · 5Н2О. Если слишком большой кусок ваты, то она поглотит выделившиеся пары и посинения может не произойти. Опыт №2. Открытие азота сплавлением вещества с металлическим натрием. Реактивы: мочевина, металлический натрий, этиловый спирт, спиртовой раствор фенолфталеина, раствор железного купороса FeS04, 2 н раствора НСl. Оборудование: сухое горючее, пробирки. Для открытия азота 5 - 10 мг испытуемого вещества, например, несколько кристаллов мочевины, помещают в сухую пробирку. Прибавляют к мочевине небольшой кусочек металлического натрия. Нагревают осторожно смесь в пламени горелки, пробирку вносят и выносят из пламени, не нагревая ее постоянно! Когда мочевина расплавится, следят, чтобы она смешалась с натрием (для успеха опыта необходимо чтобы натрий плавился вместе с веществом, а не отдельно от него - не на стенке пробирки!). При этом иногда наблюдается небольшая вспышка. Нагревают, пока получится однородный сплав. Когда пробирка остынет, добавляют в нее 5 капель этилового спирта для устранения остатков металлического натрия, который реагирует со спиртом не так бурно, как с водой. При этом происходит образование алкоголята натрия с выделением водорода: 2С2Н5ОН +2Na →2C2H50Na + Н2 Убедившись, что остаток натрия прореагировал со спиртом (прекращается шипение от выделения пузырьков газа), добавляют в пробирку 5 капель воды и нагревают ее на пламени горенки, чтобы все растворилось. При этом цианид натрия переходит в раствор, а алкоголят натрия с водой образует едкую щелочь: C2H5ОNa + НОН → С2Н5ОН + NaОH Добавляют в пробирку 1 каплю спиртового раствора фенолфталеина. Появление малиново-красного окрашивания показывает, что в растворе образовалась щелочь. После этого внести в пробирку 1 каплю раствора железного купороса FeS04 обычно содержащего примесь соли оксида железа (III) Fe2(S04)3. В присутствии щелочи немедленно образуется грязно - зеленый осадок гидроксида железа (II) в смеси с желтым осадком гидроксида железа (III). При наличии в растворе избытка цианида натрия гидроксид железа (II) образует комплексную желтую кровавую соль: Fe(OH)2 + 2NaCN → Fe(CN)2 + 2 NaOH Fe(CN)2 + 4NaCN → Na4[Fe(CN)6] Пипеткой наносят в центр фильтровальной бумажки каплю жидкости из пробирки. Как только капля впитается, на нее наносят 1 каплю 2 н раствора НСl. После подкисления грязно-зеленый или желтоватый осадок гидроксидов железа (II) и (Ш) растворяется и при наличии азота немедленно появляется синее пятно образовавшейся берлинской лазури: Fe(OH)3 + 3 НСl → FeСl3 + 3 Н2О 3 Na4[Fe(CN)6]+ 4FeСl3 → Fe4[Fe(CN)6]3 + 12 NaСl
Опыт № 3. Открытие серы сплавлением органического вещества с металлическим натрием. Реактивы: тиомочевина или сульфаниловая кислота, металлический натрий, этиловый спирт, раствора ацетата свинца Рb(СН3СОО)2. Оборудование: сухое горючее, пробирки. Для открытия серы испытуемое вещество, например, тиомочевину или сульфаниловую кислоту, помещают в сухую пробирку. Достаточно взять всего несколько кристаллов вещества.(5 – 10мг). Добавляют к веществу кусочек металлического натрия (столбик длиной около I мм). Пробирку нагревают, следя за тем, чтобы натрий плавился не отдельно, а вместе с веществом, иначе, опыт не удастся. Наблюдаемая небольшая вспышка натрия не опасна (см. предыдущий опыт). При этом органическое вещество (тиомочевина) переходит в неорганическое соединение - сульфид натрия. Когда пробирка остынет, прибавляют в нее 5 капель этилового спирта для устранения остатков металлического натрия, который со спиртом образует, алкоголят натрия C2H5ОNa. После окончания реакции (прекращение выделения пузырьков газа - водорода) добавляют для растворения сплава 5 капель воды и кипятят, чтобы ускорить растворение. Сульфид натрия при этом перейдет в раствор вместе с гидроксидом натрия, который, однако, не мешает дальнейшей реакции. Для открытия серы добавляют несколько капель раствора ацетата свинца Рb(СН3СОО)2. При этом выпадает темно-коричневый осадок сульфида свинца: Рb(СН3СОО)2.+ Na2S → PbS ↓ + 2 CH3COONa Это качественная реакция на ион двухвалентной серы S-2.
Опыт № 4. Открытие хлора при действии водорода на органическое вещество.
Реактивы: хлороформ CHСl3, этиловый спирт, металлический натрий, концентрированная азотная кислота HNO3. Оборудование: сухое горючее, пробирки.
Помещают в пробирку I каплю хлороформа CHСl3. Добавляют 5 капель этилового спирта и кусочек металлического натрия (столбик длиной 1 мм). При этом происходит следующая реакция: С2Н5ОН + Na → C2H5ОNa + Н2 Обращают внимание на выделяющийся водород. Его можно зажечь у отверстия пробирки, если предварительно закрыть это отверстие пальцем, чтобы, накопить водород, а потом поднести отверстие к пламени горелки. Водород в момент выделения отщепляет хлор от хлороформа и образует хлористый водород, реагирующий затем с образовавшимся алкоголятом натрия. CHCl3 + 3H2 → CH4 + 3HCl C2H5ONa + HCl → C2H5OH + NaCl После того, как прекращается выделение водорода, для растворения образующегося белого осадка, нерастворимого в этиловом спирте, добавляют 2-3 капли воды. При этом избыток алкоголята натрия реагирует с водой, образуя щелочь: C2H5ОNa + НОН → С2Н5ОН + NaOH В присутствии щелочи нельзя отрывать ион хлора, так как добавление раствора нитрата серебра немедленно дает коричневый осадок оксида серебра, маскирующего осадок хлорида серебра: AgNO3 + 2 NaOH → Ag20 + H20 + 2 NaN03 Поэтому добавляют к раствору сначала 2 - 3капли концентрированной азотной кислоты HNO3 (в вытяжном шкафу) для нейтрализации щелочи, а затем уже 2 капли 0,1 н раствора AgN03. При наличии хлора немедленно выпадает белый творожистый осадок хлорида серебра, нерастворимый в HNO3: NaCl + AgNO3 → AgCl ↓+ NaNO3 Ни в коем случае не следует брать для реакции больше 1 капли хлороформа, так как это только вредит чувствительности реакции. Остаток не вступившего в реакцию хлороформа еще до прибавления нитрата серебра дает с водой прочную эмульсию в виде беловатой мутной жидкости, которая будет маскировать появление белой мути от хлорида серебра.
Опыт № 5. Открытие хлора по зеленой окраске пламени (проба Бейльштейна). Реактивы: хлороформ CHСl3. Оборудование: сухое горючее, медная проволока. Берут медную проволоку длиной около 10 см, загнутую на конце петлей и вставленную другим концом в небольшую корковую пробку. Держа за пробку, прокаливают петлю впламени горелки до исчезновения посторонней окраски пламени (признак загрязнения медной петли). 2Cu + O2 → 2 CuO Остывшую петлю, покрывшуюся черным налетом оксида меди (II), опускают в пробирку, на дно которой помещают испытуемое вещество, например хлороформ. Смоченную веществом петлю вновь вносят в пламя горелки. Немедленно появляется характерная ярко-зеленая окраска пламени вследствие образования летучего соединения меди с хлором. Подобную же окраску пламени дают, помимо хлористых и другие галогенсодержащие органические соединения. 2CHCl3 + 5CuO → CuCl2 +4 CuCl + 2CO2 + H2O Для очистки проволоку можно смочить соляной кислотой и прокалить.
В отчете пишут уравнения соответствующих реакций и делают вывод о наличии анализируемых элементов в веществах.
Вопросы коллоквиума: 1. В какие неорганические соединения переводят углерод-, водород-, азот-, серо- и хлорсодержащие органические соединения для качественного определения соответствующих элементов? Почему именно в эти неорганические соединения? 2. Для чего при открытии таких элементов, как азот, сера, хлор, добавляют этиловый спирт и воду? 3. В чем смысл пробы Бейльштейна? Лабораторная работа № 4 «Функциональный анализ»
Для того чтобы отличить ароматические углеводороды от алифатических, можно использовать некоторые цветные реакции, например реакцию ароматических углеводородов с хлороформом в присутствии хлорида алюминия. Эта реакция сопровождается образованием окрашенных продуктов. Так, при взаимодействии бензола с хлороформом в присутствии AlCl3 кроме основного продукта реакции – бесцветного трифен
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.57.239 (0.022 с.) |

 Рис 3.11. Прибор для возгонки.
Рис 3.11. Прибор для возгонки.
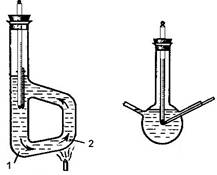





 Рис.3.17. Ареометры:
Рис.3.17. Ареометры:


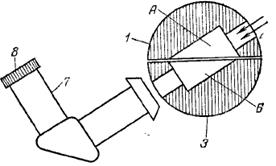 рефрактометра ИРФ-22 (в разрезе):
рефрактометра ИРФ-22 (в разрезе): 7, фокусируют окуляр 8 так, чтобы шкала прибора была отчетливо видна (рис.3.22а). Вращая маховик 2 и наблюдая в окуляр зрительной трубы 8, находят границу раздела света и тени (рис. 3.22б). Если она размыта и окрашена в желто-красный или сине-зеленый цвет, надо при помощи маховика 9, вращая его в любом направлении, добиться, по возможности, более полного обесцвечивания Рис.3.22. Снятие отсчета на
7, фокусируют окуляр 8 так, чтобы шкала прибора была отчетливо видна (рис.3.22а). Вращая маховик 2 и наблюдая в окуляр зрительной трубы 8, находят границу раздела света и тени (рис. 3.22б). Если она размыта и окрашена в желто-красный или сине-зеленый цвет, надо при помощи маховика 9, вращая его в любом направлении, добиться, по возможности, более полного обесцвечивания Рис.3.22. Снятие отсчета на



