Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фениловый эфир бензойной кислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реактивы: фенол, хлористый бензоил, гидроксид натрия, этиловый спирт. Оборудование: колба плоскодонная вместимостью 50, пробка, нутч-фильтр. Фенол, попадая на кожу, может вызывать сильные ожоги! Работы с фенолом проводят в вытяжном шкафу!
В плоскодонной колбе готовят раствор 1 г едкого натрия в 10 мл воды и растворяют в нем 0,6 г фенола. Затем туда же добавляют 1-2 мл хлористого бензоила и колбу энергично встряхивают в течение 15-20 мин до исчезновения запаха хлористого бензоила. При встряхивании постепенно выпадают кристаллы фенилового эфира бензойной кислоты. Осадок отфильтровывают, промывают водой и сушат. Перекристаллизацию ведут из этилового спирта, не доводя его до кипения. Т. пл. 700С.
Определяют выход полученного вещества, температуру плавления, растворимость и сравнивают полученные результаты с теоретическими данными. Делают соответствующий вывод. Использование реакций окисления и восстановления.
Лабораторная работа №19 «Окисление»
Процессы, сопровождающиеся отнятием от субстрата электронов, называют окислением. В этих реакциях окислителями являются соединения, обладающие большим сродством к электрону (электрофильностью), а субстратами – соединения, имеющие склонность к отдаче электронов (нуклеофильность). Процессы окисления связаны либо с присоединением кислорода, либо с дегидрированием – отнятием водорода (точнее, двух электронов и двух протонов). Наиболее распространенными окислителями являются вещества с сильно выраженными электрофильными свойствами: азотная кислота, кислород и пероксидные соединения (пероксид водорода, пероксиды металлов, неорганические и органические надкислоты), сера, бром, хлор. Кислородные кислоты галогенов и их соли. К эффективным окислителям относятся соединения металлов в высших степенях окисления: соединения железа (III), перманганат калия, диоксид марганца, хромовая кислота и ее ангидрид. Практическая часть
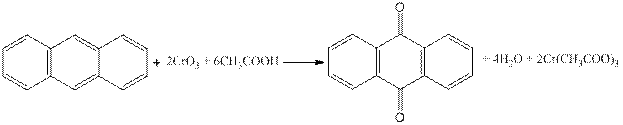
Антрахинон
Реактивы: антрацен, оксид хрома (VI), уксусная кислота (ледяная). Оборудование: колба двухгорлая вместимостью 50 мл; обратный холодильник, стакан на 100 мл, колба коническая на 100 мл.
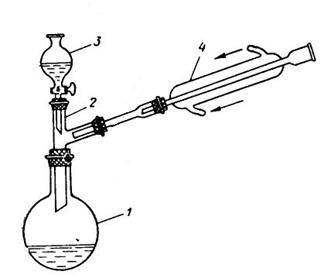
Собирают прибор (рис.3.28.). В двугорлой колбе, снабженной капельной воронкой и обратным холодильником (или в колбе снабженной двурогим форштосом) (рис. 29), растворяют при нагревании 0.32 г (0,0018 моль) антрацена в 12 мл ледяной уксусной кислоты. Содержимое доводят до легкого кипения и из капельной воронки медленно приливают окислительную смесь. Ее готовят заранее из 1 г (0,01 моль) оксида хрома (VI), 1 мл воды и 4 мл уксусной кислоты. После введения всего раствора окислителя, на что требуется приблизительно 1 ч, реакционную массу выдерживают при температуре кипения 15 мин (на окончание реакции указывает окрашивание массы в зеленый цвет). Смесь выливают в стакан с 6 мл воды и оставляют на ночь. Выпавший за это время осадок отфильтровывают, промывают водой и влажный перекристаллизовывают из ледяной уксусной кислоты.
Рис.3.28. Установка для окисления антрахинона. 1 – реакционная колба; 2 – двурогий форштос; 3 – капельная воронка с окислительной смесью; 4 – обратный холодильник Либиха.
Антрахинон – кристаллическое вещество в виде светло-желтых ромбов, нерастворимых в воде, трудно растворим в спирте, эфире, хорошо – в анилине, горячем толуоле, концентрированной серной кислоте. Т. пл. 2860С. Хроматография: элюент: гексан – этилацетат (17:1). R f =0.42. Идентификации полученного соединения провести с помощью инфракрасной спектроскопии (см. раздел 3.5). Определите выход полученного вещества, температуру плавления, растворимость и проведите ТСХ и сравните полученные результаты с теоретическими данными. Сделайте соответствующий вывод.
Бензойная кислота
Реактивы: толуол, перманганат калия, соляная кислота. Оборудование: круглодонная колба вместимостью 100 мл; обратный холодильник, стакан на 100 мл, песчаная баня, колба коническая на 100 мл.
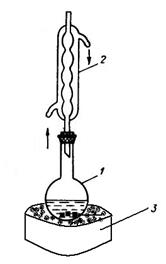
В круглодонной колбе, снабженной обратным холодильником (рис. 3.29.), кипятят на песчаной бане в течение 3 ч 1,2 мл толуола с 40 мл воды и 3,4 г мелко растертого перманганата калия. Для равномерного кипения в колбу бросают несколько «кипелок». После завершения реакции раствор в колбе над осадком диоксида марганца должен быть бесцветным. Если реакционная смесь остается окрашенной, обесцвечивания достигают прибавлением 0,2 мл спирта или 0,1 г щавелевой кислоты при нагревании. Горячий раствор фильтруют через складчатый фильтр, осадок диоксида марганца промывают небольшим количеством горячей воды. Фильтрат упаривают в стакане до объема 10-20 мл и отфильтровывают от вновь выпавшего оксида марганца (IV).
Рис.3.29. Установка для синтеза бензойной кислоты. 1 – реакционная колба; 2 - обратный холодильник. 3 – песчаная баня.
Промыв осадок 5 мл горячей воды, объединенный фильтрат подкисляют концентрированной соляной кислотой до кислой реакции по индикаторной бумаге. При этом осаждается бензойная кислота, которую отфильтровывают, промывают небольшим количеством холодной воды и сушат. Бензойная кислота – белое кристаллическое вещество в виде пластинок, плохо растворяется в холодной воде, лучше – в горячей. Хорошо растворяется в хлороформе, ацетоне, бензоле. Т. пл. 1220С. Хроматография: адсорбент: Sorbfil; элюент: петролейный эфир – этилацетат – ледяная уксусная кислота (17:2:1). R f =0.2. Определяют выход полученного вещества, температуру плавления, растворимость и проводят ТСХ и сравнивают полученные результаты с теоретическими данными. Сделайте соответствующий вывод.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1324; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.198.181 (0.006 с.) |