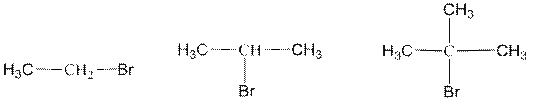Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ органических соединенийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Принадлежность органических веществ к определенным классам устанавливается функциональным анализом, их чистота – хроматографией, строение – всеми существующими физико-химическими методами исследования с учетом способа получения, а в случае необходимости и результатов встречного синтеза. Качественный элементный анализ позволяет определить, из атомов каких элементов построены молекулы органического вещества; количественный элементный анализ устанавливает состав соединения и простейшую формулу. При выполнении элементного анализа органические вещества «минерализуют», т.е. разлагают таким образом, чтобы углерод превратился в СО2, водород – в Н2О, азот – в N2, NH3 или цианид - ионы CN- и т.п. Дальнейшее определение проводят обычными методами аналитической химии. В функциональном анализе применяются химические, физические и физико-химические методы. Для качественных проб на функциональные группы выбирают реакции, при которых происходит изменение окраски или разделение фаз (выпадение осадка, выделение газа). Реакций, характерных только для какой-нибудь одной функциональной группы, известно немного, и для того, чтобы установить, к какому классу соединений относится данное вещество, нужно проделать несколько качественных реакций. Лабораторная работа № 3 «Качественный элементный анализ»
Практическая часть
Опыт №1. Открытие углерода и водорода сожжением вещества с оксидом меди (П).
Реактивы: порошок оксида меди (П), сахароза, безводный медный купорос, известковая вода. Оборудование: пробирки, пробка с газоотводной трубкой, вата, сухое горючее. Дня проведения эксперимента в пробирку «а» (рис. 31) насыпают черного порошка оксида меди (П) на высоту около 10 мм. Добавляют одну лопаточку сахарозы, тщательно перемешивают, энергично встряхивают пробирку. В верхнюю часть пробирки «а» вводят в виде пробки небольшой комочек ваты (рис. 3.23.). Насыпают на вату тонкий слой белого порошка - безводного медного купороса. Закрывают пробирку «а» пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в вату с CuSO4. Нижний конец трубки помещают в пробирку «б», предварительно наливают внее около 1-2 мл известковой воды. Конец газоотводной трубки должен быть погружен в известковую воду.
Рис.3.23. Открытие углерода и водорода Нагревают пробирку «а» на пламени горелки. Если пробка плотно закрывает пробирку, то через несколько секундиз газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, вследствие выделения белого осадка СаСОз, пробирку «б» убирают. Пробирку «а» продолжают нагревать по всей длине до ваты, пока пары воды не достигнут белого порошка -обезвоженного медного купороса, находящегося на ватном тампоне, и не вызовут посинения его вследствие образования кристаллогидрата CuSО4 · 5Н2О. Если слишком большой кусок ваты, то она поглотит выделившиеся пары и посинения может не произойти. Опыт №2. Открытие азота сплавлением вещества с металлическим натрием. Реактивы: мочевина, металлический натрий, этиловый спирт, спиртовой раствор фенолфталеина, раствор железного купороса FeS04, 2 н раствора НСl. Оборудование: сухое горючее, пробирки. Для открытия азота 5 - 10 мг испытуемого вещества, например, несколько кристаллов мочевины, помещают в сухую пробирку. Прибавляют к мочевине небольшой кусочек металлического натрия. Нагревают осторожно смесь в пламени горелки, пробирку вносят и выносят из пламени, не нагревая ее постоянно! Когда мочевина расплавится, следят, чтобы она смешалась с натрием (для успеха опыта необходимо чтобы натрий плавился вместе с веществом, а не отдельно от него - не на стенке пробирки!). При этом иногда наблюдается небольшая вспышка. Нагревают, пока получится однородный сплав. Когда пробирка остынет, добавляют в нее 5 капель этилового спирта для устранения остатков металлического натрия, который реагирует со спиртом не так бурно, как с водой. При этом происходит образование алкоголята натрия с выделением водорода: 2С2Н5ОН +2Na →2C2H50Na + Н2 Убедившись, что остаток натрия прореагировал со спиртом (прекращается шипение от выделения пузырьков газа), добавляют в пробирку 5 капель воды и нагревают ее на пламени горенки, чтобы все растворилось. При этом цианид натрия переходит в раствор, а алкоголят натрия с водой образует едкую щелочь: C2H5ОNa + НОН → С2Н5ОН + NaОH Добавляют в пробирку 1 каплю спиртового раствора фенолфталеина. Появление малиново-красного окрашивания показывает, что в растворе образовалась щелочь. После этого внести в пробирку 1 каплю раствора железного купороса FeS04 обычно содержащего примесь соли оксида железа (III) Fe2(S04)3. В присутствии щелочи немедленно образуется грязно - зеленый осадок гидроксида железа (II) в смеси с желтым осадком гидроксида железа (III). При наличии в растворе избытка цианида натрия гидроксид железа (II) образует комплексную желтую кровавую соль: Fe(OH)2 + 2NaCN → Fe(CN)2 + 2 NaOH Fe(CN)2 + 4NaCN → Na4[Fe(CN)6] Пипеткой наносят в центр фильтровальной бумажки каплю жидкости из пробирки. Как только капля впитается, на нее наносят 1 каплю 2 н раствора НСl. После подкисления грязно-зеленый или желтоватый осадок гидроксидов железа (II) и (Ш) растворяется и при наличии азота немедленно появляется синее пятно образовавшейся берлинской лазури: Fe(OH)3 + 3 НСl → FeСl3 + 3 Н2О 3 Na4[Fe(CN)6]+ 4FeСl3 → Fe4[Fe(CN)6]3 + 12 NaСl
Опыт № 3. Открытие серы сплавлением органического вещества с металлическим натрием. Реактивы: тиомочевина или сульфаниловая кислота, металлический натрий, этиловый спирт, раствора ацетата свинца Рb(СН3СОО)2. Оборудование: сухое горючее, пробирки. Для открытия серы испытуемое вещество, например, тиомочевину или сульфаниловую кислоту, помещают в сухую пробирку. Достаточно взять всего несколько кристаллов вещества.(5 – 10мг). Добавляют к веществу кусочек металлического натрия (столбик длиной около I мм). Пробирку нагревают, следя за тем, чтобы натрий плавился не отдельно, а вместе с веществом, иначе, опыт не удастся. Наблюдаемая небольшая вспышка натрия не опасна (см. предыдущий опыт). При этом органическое вещество (тиомочевина) переходит в неорганическое соединение - сульфид натрия. Когда пробирка остынет, прибавляют в нее 5 капель этилового спирта для устранения остатков металлического натрия, который со спиртом образует, алкоголят натрия C2H5ОNa. После окончания реакции (прекращение выделения пузырьков газа - водорода) добавляют для растворения сплава 5 капель воды и кипятят, чтобы ускорить растворение. Сульфид натрия при этом перейдет в раствор вместе с гидроксидом натрия, который, однако, не мешает дальнейшей реакции. Для открытия серы добавляют несколько капель раствора ацетата свинца Рb(СН3СОО)2. При этом выпадает темно-коричневый осадок сульфида свинца: Рb(СН3СОО)2.+ Na2S → PbS ↓ + 2 CH3COONa Это качественная реакция на ион двухвалентной серы S-2.
Опыт № 4. Открытие хлора при действии водорода на органическое вещество.
Реактивы: хлороформ CHСl3, этиловый спирт, металлический натрий, концентрированная азотная кислота HNO3. Оборудование: сухое горючее, пробирки.
Помещают в пробирку I каплю хлороформа CHСl3. Добавляют 5 капель этилового спирта и кусочек металлического натрия (столбик длиной 1 мм). При этом происходит следующая реакция: С2Н5ОН + Na → C2H5ОNa + Н2 Обращают внимание на выделяющийся водород. Его можно зажечь у отверстия пробирки, если предварительно закрыть это отверстие пальцем, чтобы, накопить водород, а потом поднести отверстие к пламени горелки. Водород в момент выделения отщепляет хлор от хлороформа и образует хлористый водород, реагирующий затем с образовавшимся алкоголятом натрия. CHCl3 + 3H2 → CH4 + 3HCl C2H5ONa + HCl → C2H5OH + NaCl После того, как прекращается выделение водорода, для растворения образующегося белого осадка, нерастворимого в этиловом спирте, добавляют 2-3 капли воды. При этом избыток алкоголята натрия реагирует с водой, образуя щелочь: C2H5ОNa + НОН → С2Н5ОН + NaOH В присутствии щелочи нельзя отрывать ион хлора, так как добавление раствора нитрата серебра немедленно дает коричневый осадок оксида серебра, маскирующего осадок хлорида серебра: AgNO3 + 2 NaOH → Ag20 + H20 + 2 NaN03 Поэтому добавляют к раствору сначала 2 - 3капли концентрированной азотной кислоты HNO3 (в вытяжном шкафу) для нейтрализации щелочи, а затем уже 2 капли 0,1 н раствора AgN03. При наличии хлора немедленно выпадает белый творожистый осадок хлорида серебра, нерастворимый в HNO3: NaCl + AgNO3 → AgCl ↓+ NaNO3 Ни в коем случае не следует брать для реакции больше 1 капли хлороформа, так как это только вредит чувствительности реакции. Остаток не вступившего в реакцию хлороформа еще до прибавления нитрата серебра дает с водой прочную эмульсию в виде беловатой мутной жидкости, которая будет маскировать появление белой мути от хлорида серебра.
Опыт № 5. Открытие хлора по зеленой окраске пламени (проба Бейльштейна). Реактивы: хлороформ CHСl3. Оборудование: сухое горючее, медная проволока. Берут медную проволоку длиной около 10 см, загнутую на конце петлей и вставленную другим концом в небольшую корковую пробку. Держа за пробку, прокаливают петлю впламени горелки до исчезновения посторонней окраски пламени (признак загрязнения медной петли). 2Cu + O2 → 2 CuO Остывшую петлю, покрывшуюся черным налетом оксида меди (II), опускают в пробирку, на дно которой помещают испытуемое вещество, например хлороформ. Смоченную веществом петлю вновь вносят в пламя горелки. Немедленно появляется характерная ярко-зеленая окраска пламени вследствие образования летучего соединения меди с хлором. Подобную же окраску пламени дают, помимо хлористых и другие галогенсодержащие органические соединения. 2CHCl3 + 5CuO → CuCl2 +4 CuCl + 2CO2 + H2O Для очистки проволоку можно смочить соляной кислотой и прокалить.
В отчете пишут уравнения соответствующих реакций и делают вывод о наличии анализируемых элементов в веществах.
Вопросы коллоквиума: 1. В какие неорганические соединения переводят углерод-, водород-, азот-, серо- и хлорсодержащие органические соединения для качественного определения соответствующих элементов? Почему именно в эти неорганические соединения? 2. Для чего при открытии таких элементов, как азот, сера, хлор, добавляют этиловый спирт и воду? 3. В чем смысл пробы Бейльштейна? Лабораторная работа № 4 «Функциональный анализ»
Для того чтобы отличить ароматические углеводороды от алифатических, можно использовать некоторые цветные реакции, например реакцию ароматических углеводородов с хлороформом в присутствии хлорида алюминия. Эта реакция сопровождается образованием окрашенных продуктов. Так, при взаимодействии бензола с хлороформом в присутствии AlCl3 кроме основного продукта реакции – бесцветного трифенилметана, образуется также окрашенная соль трифенилкарбения:
Окрашено Эту реакцию можно также использовать для обнаружения ароматических галогенпроизводных. Опыт. К 1-2 мл хлороформа прибавляют 2-3 капли бензола, тщательно перемешивают и пробирку слегка наклоняют, чтобы смочить стенки. Добавляют 0,5-0,6 г безводного хлорида алюминия таким образом, чтобы часть порошка попала на стенки пробирки. Обращают внимание на окраску порошка на стенке и на цвет раствора. В реакции с бензолом возникает красно-оранжевая окраска, с дифенилом – пурпурная, с нафталином – синяя, с антраценом – зеленая. Для того чтобы различить первичные, вторичные и третичные спирты, используется различная подвижность оксогруппы в реакции спиртов с раствором хлорида цинка в концентрированной соляной кислоте:
Третичные спирты взаимодействуют с этим реактивом с большей скоростью, давая нерастворимые галогеналкилы; первичные спирты реагируют только при продолжительном нагревании или стоянии, вторичные занимают промежуточное положение. Опыт. В три пробирки наливают свежеприготовленный раствор хлорида цинка в соляной кислоте и охлаждают. В каждую пробирку добавляют по 3-4 капли соответственно первичного, вторичного или третичного спиртов, энергично встряхивают и оставляют в стакане с водой при 25-300С. О начале реакции судят по помутнению раствора вследствие образования нерастворимого галогеналкила. Отмечают время помутнения раствора в каждой пробирке. Качественные реакции карбонильных соединений многочисленны и разнообразны, что объясняется склонностью карбонильных соединений вступать в различные реакции замещения и присоединения. Альдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную. В качестве реактива, содержащего ионы Cu2+, применяется реактив Фелинга. Реактив Фелинга готовят перед употреблением, смешивая свежеприготовленный гидроксид меди (II), образующийся при взаимодействии гидроксида натрия с сульфатом меди(II), и раствор сегнетовой соли. При сливании растворов образуется гидроксид меди(II), который с сегнетовой солью дает комплексное соединение типа гликолята меди:
Ароматические альдегиды эту реакцию не дают. Опыт. Приготавливают в пробирке реактив Фелинга, сливая по 1 мл исходных растворов, и прибавляют 2 мл карбонильного соединения. Верхнюю часть содержимого пробирки нагревают и наблюдают появление желтого или красного осадки оксида меди (I).
Практическая часть Студентам выдается набор, состоящий из 6 бесцветных и прозрачных жидкостей, среди которых находятся по одному представителю алканов, ароматических углеводородов, спиртов (первичных, вторичных и третичных) и альдегидов. Названия представителей указываются преподавателем. Задача студента, предварительно ознакомившись с основами функционального анализа, представленного во введении, составить план анализа, чтобы по его завершению можно было сделать вывод о нахождении того или иного соединения в пронумерованной пробирке.
В отчете пишут наблюдаемые явления, протекающие реакции и ход мышления. Делают вывод о принадлежности жидкостей к тому или иному классу и обосновывают его. Лабораторная работа №5 «Тонкослойная хроматография» Хроматография. Одним из наиболее простых и эффективных методов изучения состава смеси органических соединений, а также установление степени чистоты является тонкослойная хроматография (ТСХ). Наиболее широко применяется адсорбционный вариант ТСХ. Процесс хроматографического разделения в этом варианте основан на различии в относительном сродстве компонентов анализируемой смеси к неподвижной фазе (сорбенту) и осуществляется в результате перемещения подвижной фазы (элюента) под действием капиллярных сил по слою сорбента, нанесенного на стеклянную или алюминиевую пластинку. Хроматографирование проводится следующим образом. На пластинке отмечается стартовая и финишная линия (1-1,5 см от края пластинки). На стартовую линию в виде небольших пятен с помощью капилляра (не более 2-3 мм в диаметре) наносят раствор анализируемой смеси. Затем пластинку помещают в закрытую камеру с элюентом. Элюент представляет собой растворитель или смесь растворителей в различном соотношении. В качестве хроматографических камер используют как специальные камеры, так и различную химическую посуду: эксикаторы, стаканы, чашки Петри (рис.3.24.). a) Рис. 3.24. а) Эксикатор, оборудованный для тонкослойной хроматографии; б) использование стакана и чашки Петри для тонкослойной хроматографии.
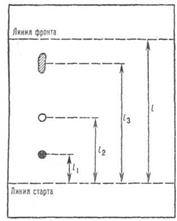
При погружении нижней части пластинки в элюент линия старта должна находиться выше уровня растворителя. Поднимаясь по пластинке снизу вверх, растворитель разделяет нанесенные исследуемые вещества, перемещая их в слое сорбента с различной скоростью в зависимости от природы и свойств вещества. В результате компоненты смеси остаются на различном расстоянии от стартовой линии. Хроматографирование заканчивают, когда граница движущегося элюента достигнет линии финиша. Затем пластинку достают из хроматографической камеры и высушивают на воздухе. Бесцветные соединения обнаруживают оптическим (ультрафиолет) или химическими методами. Последний метод заключается в обработке хроматограммы реагентами, которые взаимодействуют с анализируемыми веществами с образованием окрашенных пятен. Наиболее доступным и универсальным методом обнаружения является обработка парами иода. Для этого хроматограмму помещают на несколько минут в эксикатор, насыщенный парами иода. После проявления пятен рассчитывают коэффициент подвижности R f, который представляет собой отношение расстояний от стартовой линии до центра пятна к расстоянию от стартовой до финишной линий (рис.3.25): R f =Li/L Li – расстояние от линии старта до центра пятна вещества i (см), L – расстояние от линии старта до лини финиша (см).
Рис.3.25. Хроматограмма, полученная при разделении смеси трех компонентов методом тонкослойной хроматографии.
Так же для идентификации веществ, входящие в состав анализируемой смеси, на стартовую линию дополнительно наносят растворы известных веществ – «свидетелей». После проявления пятен и вычисления R f сравнивают характеристики «свидетеля» и анализируемого вещества. Практическая часть
Опыт №1. Обнаружение аскорбиновой кислоты (витамин С) во фруктовых соках.
Реактивы: сок апельсина (лимона, мандарина, рябины, граната и др.), элюент (этанол – гексан 3:1), 1%-ный раствор аскорбиновой кислоты. Оборудование: чашки Петри, стаканы, адсорбент Sorbfil, капилляры. На стартовую линию пластинки наносят пробы отфильтрованного сока апельсина (лимона, мандарина, рябины, граната и др.) и 1%-ного раствора аскорбиновой кислоты так, чтобы расстояние пятен от боковых краев и между собой было не менее 1 см. Когда пятна подсохнут, пластинку помещают в стакан, на дно которого наливают 2 мл элюента (этанол – гексан 3:1). Чтобы элюент не испарялся с поверхности пластинки, накрывают стакан чашкой Петри. После достижения элюента финишной линии, вынимают пластинку и высушивают ее на воздухе. Для обнаружения соединений помещают пластинку в эксикатор с парами иода. Отмечают проявившиеся пятна и определяют значение R f аскорбиновой кислоты.
Опыт №2. Обнаружение лимонной кислоты в лимоне.
Реактивы: сок лимона, раствор лимонной кислоты, элюент (этанол – гексан 3:1). Оборудование: чашки Петри, стаканы, адсорбент Sorbfil, капилляры. Аналогично предыдущему опыту на пластинку наносят пробы сока лимона и раствора лимонной кислоты («свидетель»). Выполняют хроматографирование и обнаружение аналогично опыту №1. Определяют значение R f лимонной кислоты.
Опыт №3. Обнаружение кофеина в чае и кофе.
Реактивы: растворы чая, кофе и кофеина, элюент этанол. Оборудование: чашки Петри, стаканы, адсорбент Sorbfil, капилляры. На линию старта пластинки наносят капли водного раствора чая, кофе и кофеина («свидетель»). Пластинку помещают в хроматографическую систему с этанолом в качестве элюента. Детектирование кофеина проводят парами иода. Определяют величину R f кофеина.
Опыт №4. Выделение кофеина и качественная реакция на него.
Реактивы: сухой чай, 30%-ный водный раствор пероксида водорода, концентрированный раствор аммиака, 10%-ный раствор соляной кислоты. Оборудование: фарфоровая чашка, воронка, вата, асбестовая сетка, сухое горючее, предметное стекло. Кофеин можно получить из листьев чая. Для этого в фарфоровую чашку насыпают около 0,5 – 1 г сухого чая, накрывают ее воронкой с заткнутым ватным тампоном отверстием и нагревают на асбестовой сетке около 10 мин. Сначала на внутренней части воронки конденсируются капельки воды, а затем начинает возгоняться кофеин, белые тонкие кристаллы которого осаждаются на холодных стенках воронки. Нагревание прекращают и после полного охлаждения фарфоровой чашки кристаллы кофеина счищают со стенок воронки и растворяют в 1 мл воды. Для проверки наличия кофеина 1 каплю полученного раствора наносят на предметное стекло, добавляют 1 каплю 30%-ного водного раствора пероксида водорода и 1 каплю 10%-ной соляной кислоты. Смесь осторожно выпаривают досуха над пламенем сухого горючего. Стекло охлаждают и добавляют 1 каплю концентрированного раствора аммиака, а затем стекло вновь нагревают до полного испарения воды. Пурпурно красный цвет пятна указывает на наличие кофеина.
В отчете делают вывод об обнаружении заявленных компонентов в соках, фруктах и чае (кофе).
Вопросы коллоквиума: 1. На чем основан метод ТСХ? 2. Что такое коэффициент подвижности? 3. Что такое подвижная и неподвижная фаза? 4. Назовите методы проявления бесцветных пятен.
Список рекомендуемой литературы к разделу «Изучение состава органических соединений, их очистка и определение физических констант»
1. Иванов В.Г., Гева О.Н., Гаверова Ю.Г. Практикум по органической химии. - М.: Академия, 2000. 2. Артеменко А.И. Практикум по органической химии. - М.: Высшая школа, 2001. 3. Гинзбург О.Ф. Практикум по органической химии. Синтез и идентификация органических соединений. - М.: Высшая школа, 1989.
3.2. Ознакомительный (малый) практикум.
Лабораторная работа №6 «Алифатические углеводороды»
Углеводороды наиболее простые органические соединения, молекулы которых состоят только из атомов углерода и водорода. Углеводы, в молекулах которых углеродные атомы соединены друг с другом в открытые цепи (прямые или разветвленные), называют ациклическими (алифатическими). От лат. Aliphatic – жирный. Первыми изученными соединениями этого класса были жиры. Алициклические углеводороды – циклические соединения, молекулы которых построены из углеродных атомов, связанных между собой σ-связью. Основными представителями алициклических углеводородов являются циклоалканы (циклопарафины) и циклоалкены (циклоолефины). По характеру связи между углеродными атомами углеводороды могут быть предельными (насыщенными) и непредельными (ненасыщенными). К предельным углеводородам относятся алканы (парафины), к непредельным – алкены (олефины), алкадиены и алкины. В алканах атомы углерода связаны между собой простой (одинарной) связью, в алкенах – двойной связью, алкинах – тройной связью. Алкадиены – это непредельные соединения, в молекулах которых имеются две двойные связи. Предельные углеводороды при обычных условиях обладают большой химической инертностью. Это объясняется тем, что все σ-связи С-С и С-Н весьма прочны (энергии этих связей порядка 380 кДж/моль). К реакциям присоединения они вообще не способны вследствие ненасыщенности всех связей атомов углерода. С большинством химических реагентов алканы или вовсе не реагируют, или реагируют чрезвычайно медленно. Сильные окислители (например, перманганат калия) при комнатной температуре тоже не действуют на алканы. При сравнительно невысоких температурах протекает лишь небольшое число реакций, при которых происходит замена атомов водорода на различные атомы или группы – реакции замещения. Алкены и алкины являются более реакционно-способными из-за наличия двойной и тройной связи соответственно, которые можно считать функциональными группами. Естественно ожидать, что реакции алкенов и алкинов будут происходить по ненасыщенной связи – реакции присоединения. Важными представителями алканов является метан СН4 – главная часть природного (до 95-98%) и попутных газов. В значительных количествах он присутствует в газах переработки. Метан используют в основном в качестве дешевого топлива (в быту и промышленности). Он бесцветен и не имеет запаха. Для обнаружения его утечки в газопроводах добавляют небольшое количество сильно пахнущего вещества (одоранта). Метан является ценным сырьем для химической промышленности. Из него получают ацетилен, галогенпроизводные, метанол, формальдегид и другие вещества. Метан служит для производства синтез - газа (водяного газа). Изооктан (2,2,4-триметилпентан) С8Н18 – главная составная часть высококачественного горючего (бензина) для карбюраторных двигателей внутреннего сгорания. Средние члены гомологического ряда метана С7 – С17 используют как горючее для двигателей (бензин, керосин), а также в качестве растворителей. Высшие алканы С18 – С44 – сырье для производства моющих средств, смазочных масел, пластификаторов. К высшим алканам относится озокерит (горный воск), состоящий в основном из твердых алканов с разветвленной цепью углеродных атомов, число которых превышает 25-30. Многие алкены широко используют в качестве мономеров (исходных продуктов) для получения высоко молекулярных соединений (полимеров). Ацетилен используют для сварки и резки металлов, т.к. при горении в кислороде ацетилен создает высокотемпературное пламя (31500С). Так же ацетилен – ценный продукт для химической промышленности. Из него получают синтетический каучук, уксусный альдегид и уксусную кислоту, этиловый спирт и многие другие вещества.
Практическая часть Опыт №1. Получение метана и его свойства.
Реактивы: ацетат натрия, натронная известь, бромная вода, раствор перманганата калия. Оборудование: пробирка с газоотводной трубкой, штатив, лапка штатива, горелка. В пробирку с газоотводной трубкой помещают смесь, состоящую из одной части обезвоженного тонкоизмельченного ацетата натрия и двух частей натронной извести (NaOH и CaO). Общий объем смеси 1-2 см (около 1/3 по высоте пробирки). Закрепляют пробирку в штативе в горизонтальном положении, нагревают ее в пламени горелки. Поджигают метан у выхода газоотводной трубки через 2 минуты после выделения газа, т.е. после того, как улетучится гремучая смесь (смесь взрывоопасна!). Обращают внимание, что метан горит светящимся пламенем. Выделяющийся метан пропускают через растворы бромной воды и KMnO4.
Изменяется ли окраска растворов? Почему?
Опыт №2. Бромирование гексана.
Реактивы: гексан, бромная вода. Оборудование: пробирка, стаканчик со льдом, горелка, пипетка. А) Демонстрационный опыт. В две кюветы помещают 3 мл гексана и добавляют 4-5 капель раствора брома в четыреххлористом углероде и перемешивают. Одну кювету ставят под источник УФ-света, а другую накрывают бумагой и оставляют под тягой. Через 3-4 минуты сравнивают кюветы. Б) В сухую пробирку помещают 1 мл гексана и несколько капель бромной воды. Содержимое пробирки перемешивают на холоде. Отмечают, исчезает ли окраска брома. Нагревают содержимое пробирки на водяной бане до исчезновения окраски. Реакция сопровождается выделением HBr. Как можно обнаружить выделение HBr?
Опыт №3. Получение этилена и изучение его свойств.
Реактивы: этиловый спирт, серная кислота, песок, бромная вода, раствор перманганата калия. Оборудование: коническая колба на 50 мл с газоотводной трубкой, пробирки, горелка. В коническую колбу с газоотводной трубкой помещают 4-5 мл смеси этилового спирта и серной кислоты (1:5) и добавляют немного «кипелок» для равномерного кипения. Нагревают колбу со смесью в пламени горелки. Выделяющийся газ пропускают через раствор бромной воды, не прекращая нагревания. Отмечают, исчезает ли окраска брома. Далее опускают конец газоотводной трубки в заранее приготовленную пробирку с 3-4 мл раствора KMnO4, продолжая нагревание колбы. Отмечают, исчезает ли окраска розового раствора KMnO4. После пропускания этилена через бромную воду и раствор перманганата калия этилен можно поджечь у конца газоотводной трубки. Он горит несветящимся пламенем.
Опыт №4. Получение ацетилена и изучение его свойств.
Реактивы: карбид кальция, бромная вода, раствор перманганата калия. Оборудование: пробирка с газоотводной трубкой, пробирки. В сухую пробирку помещают кусочек карбида кальция и приливают воду, быстро закрывают пробирку пробкой с газоотводной трубкой и выделяющийся газ пропускают последовательно в пробирки с бромной водой, раствором KMnO4. Как изменяется окраска растворов? Поджигают газ у конца отводной трубки. Ацетилен горит коптящим пламенем. В отчете пишут наблюдения, уравнения всех проделанных реакций и называют полученные вещества. Делают вывод о сходстве и различии свойств алифатических углеводородов.
Вопросы коллоквиума: 1. Предложите радикальный цепной механизм бромирования гексана и ионный механизм бромирования этилена. 2. Напишите уравнения реакций получения ацетилена и уравнение реакции ацетилена с аммиачным раствором оксида серебра [Ag(NH3)2OH]. 3. Приведите примеры углеводородов, содержащие первичный, вторичный и третичный атом углерода. Дайте им название. 4. Дайте определение изомерии. Изобразите возможные изомеры пентана и дайте им название. 5. Нахождение в природе важнейших углеводородов и их применение.
Лабораторная работа №7 «Галогеналканы»
Галогенпроизводными углеводородов называются органические соединения, образующиеся при замене атомов водорода в углеводородах на атомы галогенов. Соответственно галогеналканами называют производные алканов, в молекулах которых один или несколько атомов водорода замещены на атомы галогена. В зависимости от числа атомов водорода, замещенных галогеном, различают моно-, ди-, тригалогенпроизводные и т.д. Например: СН3Сl (хлорметан, метилхлорид), СН2Сl2 (дихлорметан, метиленхлорид), CHCl3 (трихлорметан, хлороформ), CCl4 (тетрахлорметан, четыреххлористый углерод, тетрахлорид углерода). В зависимости от типа атома углерода, связанного с галогеном, галогеналканы классифицируют как первичные, вторичные и третичные. Также как и среди углеводородов, различают предельные, непредельные, циклические и ароматические галогенпроизводные углеводородов.
бромэтан 2-бромпропан 2-бром-2-метилпропан (этилбромид) (изопропилбромид) (трет -бутилбромид) первичный вторичный третичный галогеналкан галогеналкан галогеналкан
хлорциклобутан бромциклогексан бромбензол
Низшие алкилгалогениды – газообразные вещества, средние – жидкости, высшие – твердые вещества. Галогеналкилы почти нерастворимы в воде. Низшие члены ряда обладают характерным запахом. Химические свойства галогенпроизводных определяется главным образом атомом галогена, связанного с радикалом. Галогенпроизводные вступают в реакции замещения и отщепления. Наличие кратной связи приводит к увеличению реакционной способности. Реакции с нуклеофилами – наиболее распространенные превращения галогеналканов.
Практическая часть
Опыт№1. Получение 2-бромпропана (бромистого изопропила).
Реактивы: изопропиловый спирт, концентрированная серная кислота, бромид калия. Оборудование: пробирки с газоотводной трубкой, лед, штативы, стаканчики, плитка. В пробирку с газоотводной трубкой наливают 1,5-2 мл изопропилового спирта и 2 мл концентрированной серной кислоты. Смесь охлаждают и добавляют 1-2 мл воды. Продолжая охлаждение, всыпают в пробирку 1,5 г бромида калия. Присоединив газоотводную трубку, укрепляют пробирку наклонно в лапке штатива. Конец отводной трубки погружают в другую пробирку - приемник, содержащую 1 мл воды и помещают в стаканчик с водой и льдом. Реакционную смесь осторожно нагревают до кипения до тех пор, пока в приемник не перестанут поступать маслянистые капли, опускающиеся на дно. В случае сильного вспенивания реакционной массы нагревание на короткое время прерывают. По окончании реакции при помощи делительной воронки 2-бромпропан отделяют от воды, собирая его в сухую пробирку или плоскодонную колбу. Для осушения 2-бромпропана добавляют несколько кусочков хлорида кальция. Полученный продукт используют для следующего опыта.
Опыт№2. Отщепление галогена от галогеналкилов при действии щелочей.
Реактивы: 2-бромпропан (опыт №1), раствор гидроксида натрия, азотная кислота, 1%-ный раствор нитрата серебра. Оборудование: Делительная воронка, пробирки, лед. Полученный в опыте №1, 2-бромпропан промывают в делительной воронке дистиллированной водой. Воду сливают, а 2-бромпропан переливают в пробирку, в которую затем добавляют 1-2 мл раствора гидроксида натрия. Смесь нагревают до начала кипения, охлаждают в ледяной бане. В этих условиях происходит щелочной гидролиз галогеналкилов с образованием галогенида натрия. Далее для обнаружения иона галогена небольшую часть смеси подкисляют азотной кислотой и добавляют несколько капель 1%-ного раствора нитрата серебра. Что происходит?
Опыт№3. Свойства хлороформа (трихлорметана).
Реактивы: хлороформ, 10% раствор гидроксида натрия, раствор иода в иодиде калия, 1%-ный раствор нитрата серебра, 10% раствор аммиака, 20% раствор азотной кислоты; Оборудование: пробирки, обратные холодильники, стаканы на 100 мл, лед. 3.1. В пробирку наливают 1 мл хлороформа и 1 мл воды. Закрывают пробирку пробкой и интенсивно встряхивают. Через некоторое время образуются два слоя, так как хлороформ практически нерастворим в воде. Пояснить где находится слой органического растворителя, а где вода и почему? А так же почему хлороформ не растворяется в воде? 3.2. В пробирку наливают 1 мл хлороформа и добавляют несколько капель раствора иода в иодиде калия. Смесь интенсивно встряхивают. Через некоторое время нижний слой приобретает розовую окраску. Хлороформ хорошо растворяет иод, при встряхивании иод переходит из водного слоя в хлороформ, окрашивая его в розовый цвет. 3.3. Щелочной гидролиз хлороформа. В пробирку наливают 1 мл хлороформа и 3 мл 10% раствора гидроксида натрия. Пробирку закрывают пробкой с обратным холодильником. Смесь осторожно нагревают до начала кипения, охлаждают в ледяной бане. В этих условиях происходит щелочной гидролиз хлороформа с образованием хлорида натрия и натриевой соли муравьиной кислоты: Далее для обнаружения хлорид - иона небольшую часть смеси подкисляют азотной кислотой и добавляют несколько капель 1%-ного раствора нитрата серебра (аналогично опыту №2). Обнаружение муравьиной кислоты в растворе основано на ее способности легко окисляться благодаря наличию к
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 4391; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.175.167 (0.016 с.) |






 б)
б)