Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Производные барбитуровой кислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Барбитураты — сильные снотворные и седативные средства. Имеют кето-енольную и лактим-лактамную таутомерию Пробоподготовка. Изолирование из органов трупа. 1. Общие методы · Изолирование нейтральным ацетоном · Метод Васильевой · Метод Стаса-Отто 2. Частные методы · Метод Валова 100 г измельченного биологического материала + 180 мл воды и 20 мл 10 %-го раствора гидроксида натрияà 30 мин при частом перемешиванииà центрифугируют 30 минà надосадочная жидкость + 120 мл 10 %-го раствора вольфрамата натрия и 1 н. раствор серной кислоты (до рН=2)à нагревают на кипящей водяной бане 20 минà центрифугированиеà центрифугат процеживают через ватный тампонà собирают в делительную воронку + диэтиловый эфирàэфирный слой + 50 мл 10%-го гидроксида натрияà водный слой отделяют + 25 %-ным раствор серной кислоты до рН=2 + диэтиловый эфирà эфирная вытяжка · Метод Швайковой 100 г измельченных органов трупов + 200 мл воды + раствор щавелевой кислоты до рН=2 à 2 ч при перемешиванииà центрифугируют 30 минà центрифугат процеживают через ватный тампон + хлороформ в течение 5 мин (3 раза)à вытяжки соединяют + 25 мл 0,1 н. раствора гидроксида натрия àхлороформная вытяжка + вода + соляная кислота до рН=2 + две порции хлороформа (по 20 мл) 5 минàхлороформная вытяжка. · Метод Попова 100 г измельченного биологического материала + 80 мл р-ра серной кислоты до рН=2...3à настаивают 2 ч при перемешиванииà биологический материал еще 2 раза настаивают с новыми порциями раствора серной кислоты 1 ч. à водные вытяжки процеживают через марлю и центрифугируютà центрифугат сливают с осадка и очищают от примесей методом гель-хроматографииà барбитураты + хлороформ в течение 7 мин à хлороформные вытяжки на водяной бане при 70 °С отгоняют и выпаривают досуха.
Очистка полученного извлечения. Метод экстракции. Основан на способности фенобарбитала практически не растворяться в органических растворителях в лактимной форме. В лактамной форме он легко переходит в органический слой. Метод заключается в многократной реэкстракции препарата при различных значениях pH из водного в органический слой и наоборот. Колоночная хроматография. Очистка вытяжки из биологического материала проводится с использованием колоночной хроматографии. В методе применяются колонки с окисью алюминия. Колонка – мерная пипетка на 10 мл, обрезанная с конца слива. Сорбент смачивают 1-2 мл растворителя - смесь хлороформа и 25% аммиака. Органический экстракт выпаривают в чашечке. Остаток растворяют в минимальном количестве растворителя – хлороформа - переносят в колонку. Затем колонку промывают для удаления соэкстрактивных веществ 8-10 мл хлороформа с добавлением аммиака. Фенобарбитал вымывают из колонки 4-5 мл 0,1 н щелочи (NaOH). Вытекающий из колонки раствор щелочи собирают, доводят до pH=1-2 раствором соляной кислоты и экстрагируют барбитурат хлороформом.
Предварительный этап (ТСХ-скрининг) 1) Исследование в общих системах растворителей НФ – силикагель ПФ - ацетон:хлороформ (1:9) Длина пробега растворителя – 10 см Время насыщения камеры парами растворителя – 15 – 20 мин Д: • дифенилкарбазоном (ДФК) – 0,1% раствор в хлороформе и раствором сульфата ртути – 5% раствор в концентрированной серной кислоте. Исследуемое соединение оказывается во второй хроматографической зоне (барбитураты): Rf=0,31 – 0,41
Непроявленный слой сорбента с анализируемым веществом элюируют ацетоном. 2) исследование в частных системах растворителей НФ – силикагель КСК, забуференный 0,1н раствором борной кислоты. ПФ – хлороформ:н-бутанол:25% раствор аммиака (70:40:5) Время насыщения камеры парами растворителя – 10 мин Высота поднятия фронта растворителя – 10 см Д: • дифенилкарбазоном (ДФК) – 0,1% раствор в хлороформе и раствором сульфата ртути – 5% раствор в концентрированной серной кислоте. Исследуемое соединение оказывается во второй хроматографической зоне (барбитураты): Rf фенобарбитала = 0,4 Характеристикой каждого вещества при (ТСХ) служит значение Rf: Длина пробега вещества от старта Rf = -------------------------------------------------------------------------------------------------------- Длина пробега растворителя от старта Сравниваются значения Rf соединения, находящегося в образце, со значением Rf вещества сравнения. Проведение гомогенного ИФА мочи. Используют следующий набор диагностикума: Реагенты: 1. Реакционная виала, содержащая: • антитело на фенобарбитал • кофермент НАД • конъюгат (фенобарбитал, меченный глюкозо-6-фосфатдегидрогеназой) • хромогенное вещество • буфер • консервант
2. Негативный контроль (холостой образец – моча человека, в которой заведомо нет фенобарбитала, с консервантом – азидом натрия) 3. Позитивный контроль. Контрольный образец, содержащий 1 мкг/мл фенобарбитала, лиофилизированную мочу человека и азид натрия 4. Калибратор. Контрольный образец, содержащий фенобарбитал в концентрации 0,5 мкг/мл. Проведение анализа. 1 Отбор и хранение биообразцов. Образцы мочи отбирают в пластиковые или стеклянные контейнеры. 2. Анализ. • приготовление калибратора и контролей • контроль температуры – 22 – 25С • включение спектрофотометра • мочу помещают в виалу, виалу – в держатель и проводят СФ. 3. Интерпретация результатов 1. Цветные реакции · + изопропиламин и соли Co (р-в Пари) -> фиолетовое · + соли Co и щелочь -> розовое · + мурексидная проба -> розовое · + родамин -> оранжевое (слой в хлороформе) · + пиридин и соли Cu -> аморфный осадок
2. УФ – спектроскопия Вытяжка из биоматериала -> упаривание -> сухой остаток + вода · + NH4OH -> спектр при 240нм (фенобарбитал, барбитал) · + H2SO4 -> спектр не должно быть максимума 290нм – для тиобарбитуратов · + NaOH -> спектр при 240нм (фенобарбитал, барбитал) 305нм – для тиобарбитуратов
Количественное определение ГЖХ-анализ Условия газохроматографического анализа Газовый хроматограф с термоаэрозольным детектором (ТАД) или с беспламенным азотно-фосфорным детектором (NPD). Колонка стеклянная, силанизированная, длиной 1 м, внутренний диаметр 2 - 3 мм. Сорбент - 3%-ный SE-30 на хромосорбе W (HP)- 80 - 100 меш. Скорость газа-носителя - 45 мл/ мин азота для ТАД и 40 мл/мин гелия для NPD. Температура детектора 300ºС. Температура испарителя 250ºС. Температура термостата колонки изменяется по линейной программе от 130 до 290ºС со скоростью 20ºС в минуту. Выдерживание при конечной температуре занимает до 15 минут общего анализа. Объем вводимой пробы - 2,5 мкл. Подготовка пробы: 0,2 мл плазмы/мочи + 1,3 мл воды и ацетатного буфера + смесь этилацетат/диэтиловый эфир à встряхивание 5 минут à центрифугирование à отделение органики à упаривание + ТМАГ à метилирование барбитуратов ВЭЖХ -анализ Условия хроматографирования: • хроматограф жидкостный • хроматографическая колонка (6282 мм), заполненная обращено-фазным сорбентом Сепарон • подвижная фаза - элюент - смесь 0,05М водного раствора двузамещенного фосфата аммония и метанола (60:40) • скорость потока элюирования - 100 мкл/мин • детектирование - при длине волны 240 нм.
Подготовка пробы: кровь/моча + стандарт + вода + ацетатный буфер à перемешивание à центрифугирование à упаривание органики à анализ
Приготовление стандартных образцов. Для приготовления эталонных растворов используется чистые субстанции барбитала, фенофарфитала, циклобарбитала, барбамила и этаминала натрия. Эти растворы служат для идентификации указанных веществ, определения их хроматографических параметров, а также для приготовления контрольных растворов при проведении количественных анализов. Градуировка хроматографа проводится по фенобарбиталу, барбамилу и этаминалу натрия. Качественный анализ. Идентификация проводится следующим образом: • сопоставляют время удерживания и коэффициент емкости определяемого компонента и образца сравнения - фенобарбитала; • сравнивают УФ-спектры предполагаемого компонента и образца сравнения; • оценивают совпадение значений времени удерживания определяемого • сопоставляют УФ-спектры определяемого компонента и образца сравнения при двух длинах волн, и оценивается их спектральное отношение. Концентрация определяемого вещества (Ci) в растворе экстракта из биопробы определяется по формуле
Ck - концентрация "добавки" в растворе подвижной фазы; Vk - объем добавленного контрольного раствора; Vi- объем раствора экстракта с определяемым веществом; hi - высота сигнала определяемого вещества в растворе экстракта из биопробы; hi+k - высота сиrnала определяемого вещества после добавки в раствор экстракта контрольного раствора. Метод внешнего стандарта В соответствии с методом внешнего стандарта и с учетом линейности зависимости выходного сигнала от массы вещества последовательно, с анализом раствора экстракта биопробы, проводят анализ контрольного раствора идентифицированного вещества. концентрация контрольного раствора (Ck) должна быть близка к концентрации определяемого вещества в растворе экстракта. Анализы контрольного раствора и экстракта биопробы должны проводитьсяв одном масштабе регистрации. Концентрация определяемого вещества в растворе экстракта (Ci) рассчитывается по формуле Ci = Ck*hi/Hk, где Ck - концентрация контрольного раствора; hi- высота сигнала определяемого наркотического вещества в растворе экстракта биопробы; hk - высота пика вещества контрольного раствора. Метод внутреннего стандарта В соответствии с методом внутреннего стандарта в биообьект до операции пробоподготовки добавляется известное количество вещества, принятого за стандарт. В анализе барбитуратов в количестве внутренних стандартов рекомендуется использовать одно изследующих веществ: апробарбитал, метилфенобарбитал, фенилubдантоин и другне вещества, которые в данных условиях xpoмaтoграфического разделения должны полностью отделяться от других компонентов образца, должны элюироваться близко к пику анализируемого соединения, не реагировать с другими компонентами, т.е. удовлетворять требованиям, предъявляемым к внутреннему стандарту. Можно использовать одновременно два и более внутренних стандарта. Концентрация определяемогo вещесгва (CI) рассчитывается по формуле Ci = Cbc * Hi /Hbc *1/Fi/bc, где Свс - концентрация внутреннего стандарта; hi - высота пика (или площадь) определяемого вещества; hвс - высота пика (или площадь) стандарта; Fi/вc - относительный калибровочный фактор. Относительный калибровочный фактор компонента Fi/вc вычисляется по формуле Fi/bc = Hi * Cbc/Ci * Hbc, где hl- высота пика (или площадь) компонента известной концентрации (калибровочный раствор); CI - концентрация калибровочного раствора определяемого компонента; hвс - высота пика (или площадь) внутреннего стандарта; Сbc - концентрация внутреннего стандарта УФ-спектрофотометрия. Спектрофотометрическое определение основано на способности фенобарбитала к лактим-лактамной (амидоимидольной) таутомерии. При pH=2,0 барбитурат находится в растворе в лактамной форме, не обладающей специфической абсорбцией в пределах 200-300 нм. При pH=10,0 образуется монолактимная форма, в гетероциклическом ядре возникает двойная связь, наблюдается поглощение при 240 нм. При pH=13 и выше в растворе присутствует дилактимная форма с двумя двойными связями в кольце. Абсорбция наблюдается при 255-260 нм. Для определения рекомендованы методы прямого и дифференциального спектрофотометрирования. Прямая СФМ: проводится при pH=10 и 240 нм. Дифференциальные методы: - при pH=2,0-10,0 и 239 нм - если исследуются внутренние органы трупа; - при pH=10,0-13,0 и 260 нм - если исследуется кровь и моча. Дифференциальные методы дают более надежные результаты, т.к. исключают влияние посторонних веществ, экстрагируемых хлороформом из кислого раствора вместе с фенобарбиталом. УФ-спектральные характеристики фенобарбитала: при pH = 9,2 наблюдается поглощение при 239 нм (εа = 452); при pH = 13,0 поглощение при 254 нм (εа = 342). Для расчета содержания барбитурата пользуются калибровочным графиком или значениями показателя удельного поглощения. В сочетании с хроматографией метод УФ-спектрофотометрии является достаточно специфичным, быстрым и чувствительным. Определяются микрограммовые количества фенобарбитала. Фенобарбитал Депрессант центральной нервной системы. Кристаллическое вещество с температурой плавления 245°. Вещество кислого характера, pKa=7,3. Плохо растворимо в воде, хорошо растворимо в этаноле и в водных растворах щелочей. УФ-спектр имеет два максимума поглощения при щелочных значениях pH (при pH=9,2 λнм=239; при pH=13,0 λнм=254). ИК-спектр имеет следующие характеристические частоты: 1684, 1712, 1770, 1310. Соединение быстро всасывается после орального введения, экскретируется в неизменном виде до 30%. Препарат пролонгированного действия (10-18 часов), период полувыведения 3 дня. Фенобарбитал используется как снотворное и противосудорожное средство. Фенобарбитал дает длительный сон, мало изменяется в организме и выводится в значительной степени почками в неизменном состоянии. В относительно больших дозах фенобарбитал способен вызывать смертельное отравление. (0,6 – 1 г.). ВРД 0,2, ВСД 0,5. В организме человека фенобарбитал подвергается, в основном, в печени ряду превращений: 1) Окислению одного из радикалов 2) Окислению до кислот и кетонов 3) Десульфированию 4) Демитилированию 5) Гидролизу Метод Валова 100 г измельченного биологического материала + 180 мл воды и 20 мл 10 %-го раствора гидроксида натрияà 30 мин при частом перемешиванииà центрифугируют 30 минà надосадочная жидкость + 120 мл 10 %-го раствора вольфрамата натрия и 1 н. раствор серной кислоты (до рН=2)à нагревают на кипящей водяной бане 20 минà центрифугированиеà центрифугат процеживают через ватный тампонà собирают в делительную воронку + диэтиловый эфирàэфирный слой + 50 мл 10%-го гидроксида натрияà водный слой отделяют + 25 %-ным раствор серной кислоты до рН=2 + диэтиловый эфирà эфирная вытяжка Подтверждающие исследования Цветные реакции: • с аммиачным раствором нитрата или ацетата кобальта. При наличии барбитуратов появляется розово-фиолетовое окрашивание. • мурексидная проба. Через некоторое время по краям сухого остатка появляется розовое и красное окрашивание, которое становится интенсивней при смачивании остатка 25% раствором гидрата окиси аммония. Микрокристаллоскопические реакции: • перекристаллизация: на предметное стекло помещают сухой остаток. Через 24 часа наблюдают форму осадка – сферолиты, в виде «ежиков». • с железоиодидным комплексом. Раствор хлорида окисного железа + концентрированная соляная кислота + калия иодид. Через 10 минут наблюдают образование сростков кристаллов.
Бензонал
Кристаллическое вещество с температурой плавления 137°. Вещество кислого характера, pKa=7,3. Бензонал трудно растворяется в воде и этиловом спирте, легче — в диэтиловом эфире, хлороформе и диметилформамиде. Экстрагируется органическими растворителями из кислых водных растворов. Бензонал в основном применяется для лечения судорожных форм эпилепсии. Иногда он применяется для лечения больных, страдающих припадками, не сопровождающимися судорогами. ВРД 0,3, ВСД 0,6. Метаболитами бензонала являются бензойная кислота и фенобарбитал, который, в свою очередь, подвергается метаболизму. Бензонал и его метаболиты в основном выделяются с мочой.
Выделение бензонала из биологического материала. 100 г измельченного биологического материала + 10 мл р-ра соляной кислоты + 50 г сульфата аммонияà перемешивают + 200 мл смеси равных объемов этилового спирта и хлороформаà настаивают 2 ч при перемешиванииàвытяжку сливают и фильтруют через плотный бумажный фильтрà промывают смесью этилового спирта и хлороформа (1: 1)à водную фазу, насыщенную сульфатом аммония, отделяют и не исследуют. Слой органических растворителей выпаривают досуха + 200 мл горячей воды àперемешивают и фильтруютà + три порции хлороформаàхлороформные вытяжки + фосфатный раствор (рН = 7,4) à хлороформный слой фильтруют через бумажный фильтрà хлороформную вытяжку используют для идентификации и количественного определения бензонала. Поскольку бензонал частично разлагается в организме на фенобарбитал и бензойную кислоту, наличие последней определяют в водной фазе. С этой целью водную фазу подкисляют раствором соляной кислоты (1: 1) до рН = 2 и взбалтывают с 10 мл хлороформа. От водной фазы отделяют хлороформную вытяжку, которую исследуют на наличие бензойной кислоты. Подтверждающие исследования 1. Бензонал с изопропиламином и солями кобальта дает фиолетовую окраску 2. С солями кобальта и щелочами бензонал дает сине-фиолетовую окраску 3. Бензонал можно обнаружить по форме кристаллов, которые образуются после прибавления к нему метилового спирта и концентрированной соляной кислоты. Через несколько минут в поле зрения под микроскопом появляются ромбической формы кристаллы или сростки из них. 4. Обнаружение методом хроматографии. НФ: силикагель ПФ: хлороформ:н-бутанол:25% раствор аммиака Д: 0,02 %-м хлороформным раствором дифенилкарбазида, затем раствором сульфата ртути. Пятна бензонала на пластинке имеют Rf =* 0,40...0,45. 10. При наличии барбамила пятна на хроматограмме приобретают сине-фиолетовую или красно-фиолетовую окраску.
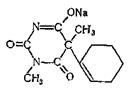
Гексенал
Хорошо растворяется в воде, этиловом спирте и хлороформе, слабо — в диэтиловом эфире. Гексенал экстрагируется органическими растворителями из кислых водных растворов. Гексенал проявляет снотворное действие, а в больших дозах он имеет наркотические свойства. Его применяют для наркоза в сочетании с оксидом азота (I), фторотаиом и с некоторыми другими веществами. Гексенал и сам может применяться для кратковременного наркоза (продолжительностью 15—20 мин). Гексенал относится к барбитуратам короткого периода действия. В организме он подвергается метаболизму несколькими путями: · Гидроксилирование циклогексильной группы à окисление с образованием 3'-кетогексабарбитала à N-деметилирование. · N-деметилирования при атоме азота в третьем положенииà норгексабарбитал. · Определенное количество гексенала, поступившего в организм, метаболизируется путем разрыва цикла барбитуровой кислоты.
Подтверждающие исследования 1. От прибавления солей кобальта и изопропиламина к гексеналу появляется фиолетовая окраска. 2. Гексенал с солями кобальта и щелочью дает розовую или красную окраску. 3. От прибавления концентрированной серной кислоты к гексеналу образуется осадок, состоящий из сростков игольчатых кристаллов. 4. Гексенал с подкисленным спиртовым раствором иодида калия образует кристаллический осадок. 5. Обнаружение гексенала по УФ-спектрам. Гексенал в ходе В ИК-области спектра гексенал (диск с бромидом калия) имеет основные пики при 1712, 1660, 1390, 1358 см-1,
Тиопентал-натрий
Легко растворим в воде, практически нерастворим в бензоле и эфире. Средство для внутривенного наркоза.
Анализ см. «Общая информация»
|
||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1605; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.6.122 (0.01 с.) |

 где
где