
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аминокислоты, строение, классификация, изомерия и номенклатура.Содержание книги
Поиск на нашем сайте Аминокислоты можно рассматривать как замещенные кислоты в радикале которого один или несколько атомов Н замещены аминогруппой NH2 COOH
R NH2
CH3 — COOH CH2 — COOH | NH2
Названия от названий кислот из которых получены с прибавлением приставки — амино - подразделяются: Моноаминокарбоновые NH2 - CH2 - COOH (α — аминоуксусный глицин) Диаминокислоты NH2 - CH2 — СН NH2 — COOH лизин
Аминодикарбоновые НООС — СН2 — СНNH2 — COOH
СООН Ароматические С6Н5 - СН2 - СН · NH2 (фениламин) Гетероциклические
N _______ СН2 - СН — COOH (гистидин)
NH NH2 Изомерия определяется изомерией углеродного скелета и положением аминогруппы. Все аминокислоты (кроме аминоуксусной) содержат ассемитрические атомы углерода, поэтому имеют оптические изомеры
CH3 - CH — COOH | NH2 α — аминопропионовая (аланин)
CH2 - CH2 — COOH | NH2 β — аминопропионовая
4. Способы получения аминокислот 1. Аминокислоты (в основном α — аминокислоты) получают путем гидролиза белков. 2. Синтезом из галогенозамещенных кислот действием аммиака: ClCH2 — COOH + 3NH3 (способ разработан Э. Фишером) 3. Микробиологический синтез. (Лизин, добавляют в пищу, улучшает аппетит) Глутаминовая кислота
· Физические и химические свойства аминокислот Большинство аминокислот — бесцветные кристалические вещества, хорошо растворимые в воде. Многие имеют сладкий вкус (глицин, аланин, серин) некоторые горькие (валин, лейцин, тирозин). tпл разных аминокислот лежит в пределах + 230 ÷ + 280 0C. Аминокислоты, обладая двумя функциональными группами -карбоксильной и аминой, проявляют амфотерные свойства, реагируя как кислоты и как основания. Кроме того аминокислотам характерен ряд спецефических реакций, связанных с взаимным влиянием карбоксильной группы и аминогруппы.
Образование внутренней соли: Внутренние соли представляют собой биополярные ионы
R - CH - COOH‹―› R – CH – COO - | |
NH2 NH+
Противоположные заряды нейтролизуют друг друга поэтому растворы одноосновных моноамино кислот нейтральны на лакмус. Биополярные ионы аминокислот в кислой среде (избыток ионов Н) превращаются в их амониевые катионы
R – CH – COOН │ NH+3
В щелочной среде (избыток гидроксильных ионов в анионы) R – CH – COO - │ NH2
Образование солей с кислотами и щелочами 1. CH 2 - COOH‹―› CH2 – COO - + НCl → CH2 – COOH +.Cl - | | | NH2 NH+3 NH3 хлористоводородная соль глицина
2. CH2 - COOH ‹―› CH2 – COO + NaOH → CH2 – COONa + H 2O | | | NH2 NH3+NH2
· Реакции по карбоксильной группе. Аминокислоты, подобно карбоновым кислотам, способны давать галогеногидриты, амиды, сложные эфиры: O NH2 – CH2 - C Cl хлорангедрид глицина
О NH2 – CH2 – C NH2 амид глицина
О NH2 – CH2 – C О – С2Н5
декарбоксилирование: при нагревании происходит отщепление СО2 t NH2 – CH2 – C ООН → H 2N – CH 3 + CO2
· Реакция по аминогруппе: взаимодействие с азотистой кислотой
NH2 – CH2 - C ООН + НО – N = O → HO – CH 2 - COOH + N 2 ↑ + H2O глицин азотистая оксиуксусная кислота кислота
ацилирование:
СН3СОСl NH2 – CH2 – C ООН → CH 3 + CO – NH – CH2 – COOH
6. Реакции связанные с наличием – СООН и – NH2 при нагревании α — аминокислоты образуют циклические амиды построенные из 2-х молекул α — аминокислот – дикетопиперазины: Н3С О Н3С О СН - С - 2 H2O СН С Н2N OH NH2 NH HO NH2 C HC C - CH O CH3 O CH3
β — аминокислоты легче других теряют молекулу аммиака и превращаются в непроедельные:
СH3 – CH - CH2 – C ООН → CH 3 - CН = CH– COOH | - NH3 NH2
ɤ- аминокислоты образуют внутримолекулярные циклические амиды, - лактамы. H 2C CH2 H3N– CH2 - CH2 – CH2 - CООН→ H2C C = O - H2O NH лактам ɤ- аминомасляной кислоты Образование полипептидов Если α — аминокислоты не подвергать прямому нагреванию, то они могут в особых условиях реагировать друг с другом за счет карбоксила одной молекулы и аминогруппы другой с выделением воды:
O NH -R – C O O O OH +HNH – R – C → NH–R -C NH-R-C +H2O OH OH дипептид, и так далеетрипептид, тетрапептид, т. о. Пептиды и полипептиды являются продуктами поликонденсации α — аминокислот. Из 2-х различных аминокислот можно составить 2 пептида:
O O O CH3–CH-C + HNH–CH2-C → CH3-CH-CO-NH-CH2-C + H2O | OH глицин OH | OH NH2 NH2 аланин аланинглицин
или: CH3 O CH3 O | H O | C – CH – N + C – CH – NY → C - CH – NH – CO – CY – NH +H2O HO H HO HO
из трех аминокислот можно получитьшесть различных трипептидов: АВС, АСВ, ВАС, ВСА, САВ, СВА.
С увеличением числа аминокислот число возможных пептидов значительно возрастает. Образование полипептидов лежит в основе строения молекулы белка. Отдельные представители аминокислот, их применение: Глицин (гликол) аминоуксусная кислота NH2 CH2 ООН оптически недеятельная, содержится почти во всех белках, особенно много в желатине (животный клей) и в натуральном шелке (белка фиброина). Применяется как проявляющее вещество в фотографии. α - аланин кристалическое вещество СH3 – CH - C ООН | NH2 широко распространена аминокислота в животных и растительных организмах. Много в белках шелка. В свободном виде содержится в крови человека.
Цистеин и цистин содержащие аминокислоты. Цистеин является производным аланина
HOOC – CH – CH2S H + O + HS – CH2 - CH - COOH → | | NH2 NH2 Группа SH окисляется, в результате содержится 2 остатка цистеина и образуется аминокислота цистин. HOOC – CH – CH2 - S - S - CH2 - CH -COOH + Н2О; | | NH2 NH2 Связь - S - S дисульфидиал имеет большое значение в строении белков. Цистиина и цистина много в покровных тканях. Применяют для лечения катаракты. Лизин H2N - (CH2)4 – CH (NH2) – COOH незаменимая аминокислота, входит в состав белков. При отсутствии или недостатке лизина в пище животных наблюдается потеря в весе. Применяется как кормовая добавка для восполнения дефицита этой кислоты в растительных белках. Для повышения питательной ценности рациона сельхозживотных к их пище добавляют наиболее дефицитные аминокислоты. Для этой цели организовано крупное промышленное производство лизина, глутаминовой кислоты, метионина. Недостаток лизина, глутаминовой кислоты, метионина. Недостаток лизина вызывает анемию, головную боль, повышенную раздражительность.
Глутаминовая кислота HOOC – CH2 -CH2 – CH (NH2) – COOH добавляется в консервы и пищевые концентраты. * Триптофан __CH2 – CH – COOH | NH2
незаменимая кислота входит в состав белков. При отсутствии триптофана развивается заболевание глаз катаракта. Белки.Первичная, вторичная, третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз, цветные реакции. Биологические функции белков. Полимеры. Белки и полисахариды как биополимеры.Пластмассы. Получение полимеров реакцией полимеризации и поликонденсации. Термопластичные и термореактивные пластмассы. Представители пластмасс. Волокна, их классификация. Получение волокон. Отдельные представители химических волокон. Белками, или белковыми веществами (протеинами), называются высокомолекулярные органические соединения, молекулы которых построены из остатков α-аминокислот. Число последних может колебаться очень сильно и достигать иногда нескольких тысяч. Белки играют исключительную роль в жизни живого организма. Функции их весьма разнообразны. Из них состоит основная масса протоплазмы клеток, они выполняют каталитические, строительные, энергетические, обменные, защитные и многие другие функции. Они составляют основу биомембран. Белкам принадлежит важнейшая роль в формировании «скелета» клетки, защитных и опорных тканей. Важнейшее свойство белка — самоорганизация структуры, его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, заболевание и многое другое) связана с белковыми веществами. Белками являются и многие важнейшие физиологически активные соединения: ферменты, некоторые гормоны и другие вещества. Белки являются необходимой составной частью пищевого рациона человека и животных. Пищевая ценность белков в первую очередь определяется их аминокислотным составом. Несмотря на разнообразие в строении и функциях, элементный состав белковых веществ колеблется незначительно (в % на сухую массу): С 50—55; М 6,5—7,3; О 21,5—23,5; N 15—17,5; S 0,3—2,5. Некоторые белки содержат в небольших количествах фосфор, селен, металлы (железо, цинк, медь). Содержание белковых веществ в животных и растительных организмах неодинаково. Обычно в животных организмах белков больше, чем в растениях. Неодинаково их содержание и в отдельных организмах и тканях. Так, в мышцах 18—23% белков, в мозгу 8—9%, в сердце 16—18 %, в крови 7—8,5%. В растениях содержится от 5 до 20% белковых веществ. Особенно богаты белком семена бобовых и масличных культур (до 20—35%). Различно содержание белковых веществ и в пищевых продуктах. Главным источником белков для человека являются мясо животных (до 20% белков), рыба (до 18%), молоко (до 3%), сыр (до 22,5%), пшеничный хлеб (до 8%), изделия из круп (1-0%). Строение белков Согласно общепринятой теории молекула белка состоит из остатков а-аминокислот, связанных между собой пептидными связями:
Пептидные связи являются не единственными видами связей в белках. Отдельные пептидные цепи или их участки могут быть связаны между собой дисульфидными (—S—S—), солевыми и водородными связями. Солевые связи образуются между свободными аминогруппами (например, N-концевая аминогруппа, расположенная на одном конце полипептидной цепи, или е-аминогруппы лизина) и свободными кислотными группами (С-концевая карбоксильная группа полипептидной цепи, свободные карбоксильные группы двухосновных аминокислот). Водородные связи в белках могут возникать между атомами кислорода кето- или оксигруппы и атомом водорода окси- или аминогруппы:
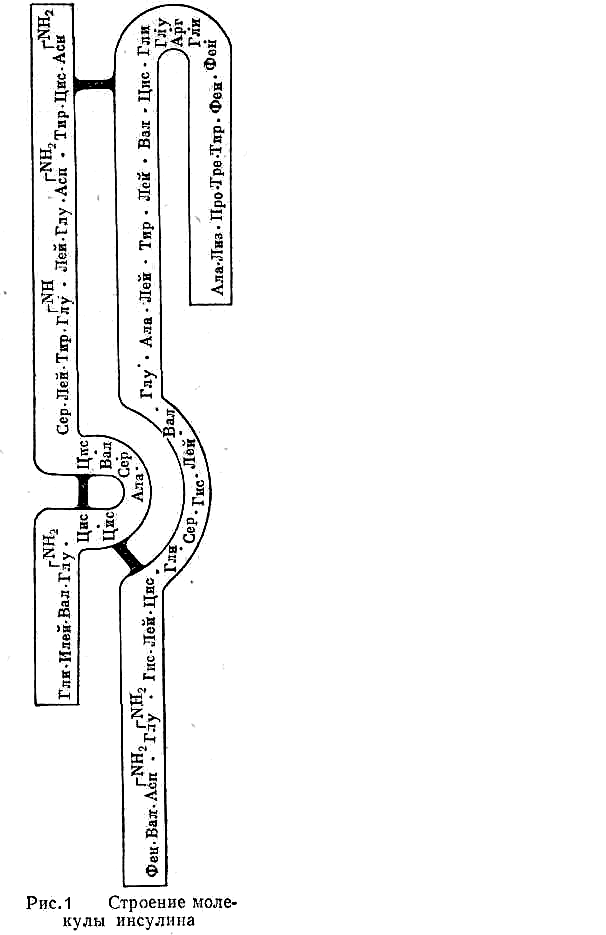
В молекуле белка существуют также и некоторые другие виды взаимодействия. Если определение аминокислотного состава белка может быть в настоящее время проведено относительно быстро, то выяснение последовательности соединения аминокислотных остатков — задача исключительно сложная. Выдающимся достижением в этой области было установление структуры и синтез гормона инсулина (Сенглер, 1963), состоящего из 51 аминокислотного остатка и имеющего молекулярную массу 5733 (рис. 1). Сочетанием из двух и трех букв на рисунке условно обозначаются остатки аминокислот. Черным показаны дисульфидные связи (мостики). Большое значение имело установление структуры фермента рибонуклеазы, молекула которого состоит из 124 аминокислотных остатков и содержит 4 дисульфидных мостика. В настоящее время известны состав и последовательность соединения аминокислотных остатков пептидных цепей большого количества белков (около 400). Различают первичную, вторичную, третичную и четвертичную структуры белковых молекул. Все белки, независимо от того, к какой группе они относятся и какие функции выполняют, построены из относительно небольшого набора Эти структурные компоненты или, как их иногда называют, «строительные блоки» расположены в различной, но всегда строго определенной для данного вида белка последовательности. Под первичной структурой белка понимают вид, число и последовательность аминокислотных остатков в полипептидной цепи. Полипептидные цепи вследствие образования водородных связей между отдельными участками цепи имеют спиралевидную (зигзагообразную) конфигурацию или структуру типа складчатого слоя. Пространственная «укладка» атомов главного цепи называется вторичной структурой белковой молекулы (рис. 2). Полипептидная спиралевидная цепочка может быть по-разному расположена в пространстве. Распределение в пространстве всех атомов белковой молекулы, или, как иногда говорят «упаковка», получило название третичной структуры (рис. 3), Следует отметить, что «свертывание полипептидной цепи с образованием третичной структуры происходит не хаотично, а строго определенно и любые изменения в третичной структуре влияют на биологическую активность белков. В настоящее время сформулировано представление о так называемой четвертичной структуре белковой молекулы. В отдельных случаях молекулы состоят из нескольких полипептидных цепей, связанных между собой водородными, ионными и некоторыми другими нековалентными видами связей. В определенных условиях они способны диссоциировать на более мелкие «субмолекулы», которые могут опять соединяться в первоначальную молекулу. Такое объединение нескольких частиц с третичной структурой получило название четвертичной структуры. Следует отметить, что далеко не у всех белков мы встречаем все четыре структуры.
|
||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 952; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.170 (0.013 с.) |

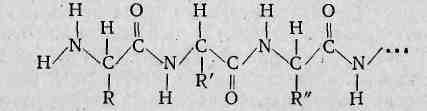
 Впервые мысль о пептидных связях была высказана выдающимся русским биохимиком. А. Я. Данилевским (1838—1923), большую роль в изучении их строения сыграли работы Э. Фишера, Л. Полинга. Состав и последовательность расположения аминокислотных остатков в молекуле белка могут быть различными, вследствие чего разнообразие белков поистине безгранично. Например, для белков, содержащих всего 100 аминокислотных остатков, число изомеров равно 20100.
Впервые мысль о пептидных связях была высказана выдающимся русским биохимиком. А. Я. Данилевским (1838—1923), большую роль в изучении их строения сыграли работы Э. Фишера, Л. Полинга. Состав и последовательность расположения аминокислотных остатков в молекуле белка могут быть различными, вследствие чего разнообразие белков поистине безгранично. Например, для белков, содержащих всего 100 аминокислотных остатков, число изомеров равно 20100.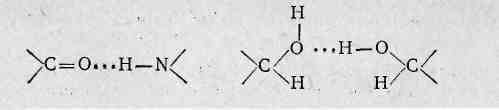
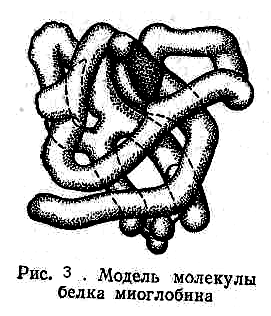 (обычно 20) аминокислот.
(обычно 20) аминокислот. 



