
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и гомологический ряд алкинов.Содержание книги
Поиск на нашем сайте
Ацетиленовые углеводороды содержат в молекуле одну тройную связь С ≡ С
С2Н2 – ацителен, С3Н4 - пропин, С4Н6 – бутин, С5Н8 - пентин. Структурная формула ацетилена: Н – С ≡ С – Н sp – гибридизация
 
  
Ообитали атома углерода в sp – гибридизации
Изомерия и номенклатура Изомерия ацетиленовых углеводородов, также как и этиленовых, определяется изомерией углеродного скелета и положением тройной связи. НС ≡ СН этин, ацетилен НС ≡ С – СН3 пропин, метилацетилен НС ≡ С – СН2 - СН3 1 - бутин СН3 - С ≡ С – СН3 2 - бутин НС ≡ С – СН2 – СН2 - СН3 1- пентин СН3 - С ≡ С – СН2 – СН3 2- пентин НС ≡ С – СН - СН3 3 – метил, 1 - бутин | СН3
Способы получения Ацетилен в промышленности получают двумя способами: 1. 2СН4 СН ≡ СН + 3Н2
2. Разложение карбида кальция водой. Карбид кальция СаС2, получают в электропечах при нагревании кокса с негашеной известью СаО:
3С +СаОСаС2 ≡ СО
+ 2 НОН → НС ≡ СН + Са(ОН)2
Гомологи ацетилена могут быть получены из дигалогенопроизводных алканов, содержащих оба галогена при одном углеродном атоме или двух соседних, путем их нагревания в спиртовом растворе КОН СН3 - СН2 – СНСl2 +2 KOH → СН3 - С ≡ СН + 2 KCl +2H2O; СН3 – СНСl – СНСl - СН3 + 2 KOH → Н3С- С ≡ C – СН3 + 2 KCl +2H2O.
Физические свойства алкинов Изменение физических свойств алкинов в гомологическом ряду сохраняют ту же закономерность, что в алканах и алкенах. С2 – С4 при обычных условиях газы, с С5 – жидкости, а С6 – твердые вещества. Чистый ацетилен не имеет запаха, ацетиленовые не растворяются в воде, но хорошо в органических растворителях, сам ацетилен незначительно растворим в воде. Ацетилен горит сильно коптящим пламенем, что связано с большим процентным содержанием углерода в молекуле.
Химические свойства алкинов Химические свойства ацетиленовых определяются природой тройной связи. Углеродные атомы находятся в третьем валентном состоянии – sp- гибридизации. Для алкинов, как и для олефинов, характерны реакции присоединения, окисления, полимеризации. Кроме того, они дают реакции замещения металлом. Реакции присоединения: Ацетиленовые дают электрофильные и нуклеофильные реакции присоединения. 1. Присоединение водорода

НС ≡ СН СН2 = СН2 СН3 - СН3
2. Присоединение галогенов
НС ≡ СН BrСН = СНBrBr2СН = СНBr2
3. Присоединение галогеноводородов:
НС ≡ СН СН2 = СНClСН3 - СНCl2
(в соответствии с правилом Морковникова)
НС ≡ СН + НОН [СН2 = CHOH] → СН3
Характер гибридизации в алкинах определяет легкость присоединения к ним, в отличие от алкенов, нуклеофильных реагентов. Например присоединение спирта. НС ≡ СН + R – ОН → СН2 = СН - O- R (виниловые эфиры)
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 362; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.211.246 (0.007 с.) |

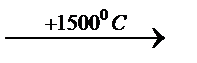 Высокотемпературным, или электротермическим, крекингом алканов, например метана:
Высокотемпературным, или электротермическим, крекингом алканов, например метана:










