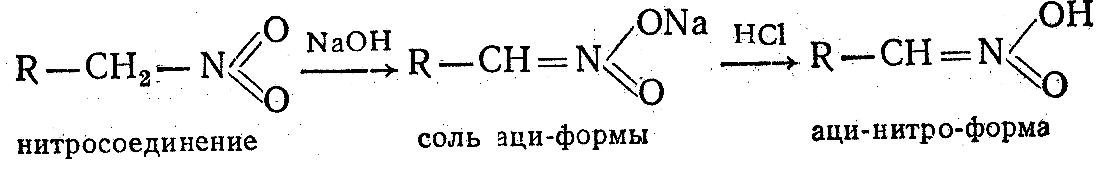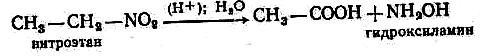Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические и химические свойства нитросоединений.Содержание книги
Поиск на нашем сайте
или
Нитросоединения жирного ряда – жидкости, не растворимые в воде, хорошо растворимы в спирте и эфире. Ароматические нитросоединения – жидкости или твердые вещества со специфическим запахом. Очень важным свойством нитросоединений – при восстановлении переходить в первичные амины. С6Н5 - NO2 + 6 [H] Все нитросоединения ядовиты. Многие ароматические нитросоединения обладают взрывчатыми свойствами. Химические свойства. Химическое поведение нитросоединений определяется наличием в молекуле нитрогруппы и ее особенностями, а также строением углеводородного радикала и их взаимным влиянием.
В зависимости от условий восстановления (в кислой, щелочной или нейтральной средах) и характера восстановителя в ходе реакции образуются различные промежуточные продукты, многие из которых нашли широкое применение в технике.
Взаимное превращение двух форм нитросоединений является типичным примером динамической изомерии (таутомерии). 3. Реакции бензольного ядра ароматических нитросоединений, Нитрогруппа ориентирует вхождение второго заместителя при электрофильном замещении предпочтительно в ж-положение, при нуклеофильном — в о- и n-положения. Примером производных нитросоединений ароматических углеводородов является 2, 4, 6-тринитрофенол (пикриновая кислота): Пикриновая кислота и ее соли применяются в качестве взрывчатых веществ и в аналитической химии.
Отдельные представители. Нитрометан С Н3—NO2. Жидкость, tкип—101,2 °С. Применяется в качестве растворителя, как ракетное топливо. Хлорированием нитрометана получают трихлорнитрометан (хлорпикрин) CCl3NO2, который применяется для борьбы с грызунами в хлебохранилищах и складах, а также в разнообразных синтезах.
Нитроциклогексан C6СH2NО2. Жидкость, tкип=205 °С. Получают нитрованием циклогексана. Применяется в качестве полупродукта в синтезе капролактама. Нитробензол C6H6NО2. Жидкость желтоватого цвета, с запахом горького миндаля, tкип = 211 °С. Плохо растворим в воде и хорошо растворим во многих органических растворителях. Исходный продукт в производстве анилина, широко применяется в анилино-красочной, парфюмерной, фармацевтической промышленностях.
Твердое вещество, tпл = 80°С. Широко применяется в качестве взрывчатого вещества.
|
||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 1896; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.133.206 (0.009 с.) |



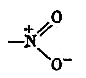 Электронное строение нитрогруппы характеризуется наличие семи полярной (полуполярной) связи:
Электронное строение нитрогруппы характеризуется наличие семи полярной (полуполярной) связи: С6Н5 – NH2 + 2 Н2О
С6Н5 – NH2 + 2 Н2О