
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции, протекающие с разрывом связи С-ОНСодержание книги
Поиск на нашем сайте
Замещение гидроксильной группы в молоке спирта на атом галогена. С2Н5OH + HCl С2Н5Сl + H2O С2Н5OH + PCl → С2Н5Сl + POCl3 + HCl
Дегидратация спиртов Дегидратация или дегидратирование приводит к образованию этиловых углеводородов или простых эфиров. СН3 - СН2ОН → СН2 = СН2 + H2O
При образовании молекулы воды, водород (по правилу Зайцева) всегда отнимается от наименее гидратированного атома «С», находящегося по соседству с атомом углерода несущим гидроксильную группу. Первичные спирты дегидратируются труднее вторичных, легче всего отщепляется молекула воды от третичных спиртов. Окисление спиртов При окислении первичных спиртов образуются альдегиды, вторичных – кетоны, окисление третичных спиртов сопровождается разрывом углеродной цепи, обычно около атома углерода несущего гидроксильную группу

| R- СНОН R – С –R1
Дегидрирование спиртов
| || OH О
Многоатомными называются спирты, соединяющие в молекуле 2 гидроксильные группы и более. В зависимости от числа гидроксильные групп «ОН» они подразделяются на двухатомные (2группы ОН), или диолы, трехатомные (3группы ОН) или триолы, и т.д.
Изомерия многоатомных спиртов обусловлена строением радикала, и положением гидроксильных групп, а также их пространственным расположением. Для наименования многоатомных спиртов к окончанию – ол – прибавляют приставку ди, три и т.д. соответствующее количеству гидроксильных групп, положение которых указывается цифрами.
Двухатомные спирты (гликоли). Строение, номенклатура. Физические свойства. Способы получения. Спирты, содержащие 2 гидроксильные группы – двухатомные (гликоли) СnH2n(ОН)2 – предельные гиликоли
СН2– СН - СН2 - СН3 – α –гликоль, 1.2бутандиол (первично-вторичный гликоль) | | OHOH СН2 OH – СН2 – СН(ОН) - СН3 - β –гликоль 1 2 3 СН2(ОН) - С(ОН) – СН3 – α –гликоль, (первично-третичный гликоль) | СН3 2- метил -1,2 –пропандиол
1 2 3 СН3- С(ОН) – С(ОН) – СН3 2.3 - диметил -2,3 –бутандиол || СН3СН3 Получение гликолей Гидролизом дигалогенпроизводных предельных углеводородов. СН3 - СН2 – CНСl- CН2Сl + 2 Н2О СН3 - СН2 – CНОН – CН2ОН + 2НСl
2) 3) Разбавленный раствор перманганата калия с олефинами образует гликоли (реакция Вагнера) 3 СН2 = СН2 + KMnO4 + 4 Н2О →СН2 – СН2 + MnO2 + KOH | | OHOH Физические свойства Низшие гликоли – густые жидкости, высшие – кристаллические вещества, tk у гликолей выше, чем tk у спиртов. Хорошо растворимы в воде, лучше чем одноатомные спирты, имеют сладкий вкус. Химические свойства гликолей аналогичны свойствам одноатомных спиртов. У гликолей в реакцию могут вступать как одна, так две гидроксильных группы. 1) С щелочными металлами образуют полные и неполные гликоляты. СН2ONa - СН2ONa СН2OH - СН2ONa Гликоли образуются не только со щелочными металлами, но и с оксидами некоторых других металлов.
СН2ONO2 СН2OH + Н2О + | | СН2OH СН2OH + 2 Н2О +СН2ONO2 | СН2ONO2

| →
4)Отщепление воды от гликолей может иметь внутримолекулярный и межмолекулярный характер. Направление отщепления воды зависит от условий реакции (примеры внутримолекулярного выделения воды (для α, β,γ- гликолей)).
СН2OH - СН2 - СН2 OH СН2 =CH - СН2OH
| | СН2 СН2
O (γ- окись) тетрагидрофуран Межмолекулярное выделение воды приводит к образованию окси эфиров. СН2OH + HO - СН2 → Н2О + СН2 – O - СН2 | | | | СН2OH СН2 OH СН2 OH СН2 OH диэтилен гликоль β,β’ – диоксиэтиловйый эфир
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 357; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.195.82 (0.007 с.) |












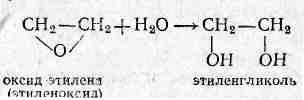


 2)С минеральными и органическими кислотами получаются полные и неполные эфиры
2)С минеральными и органическими кислотами получаются полные и неполные эфиры
 СН2OH - СН2 OH [СН2 =CHOH] → СН3 – CHO
СН2OH - СН2 OH [СН2 =CHOH] → СН3 – CHO СН2OH - СН2 - СН2 -СН2 OH СН2 - СН2
СН2OH - СН2 - СН2 -СН2 OH СН2 - СН2 


