Определение, классификация, строение спиртов и гомологический ряд
Содержание книги
- Методы эмпирического уровня познания
- Методы теоретического уровня познания
- Относительные атомная и молекулярная массы. Количество вещества.
- Значение периодического закона и системы элементов Д.И.Менделеева.
- Строение атома и распределение электронов по оболочкам у элементов малых и больших периодов.
- Понятие о ковалентной полярной связи.
- Распространенные одноатомные катионы
- Химическая связь между ионами называется ионной.
- Дисперсные системы. Понятие о дисперсной системе. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем. Понятие о коллоидных системах.
- Тема. 1. 4: вода. Растворы. Электролитическая диссоциация
- Диссоциация кислот, оснований, солей.
- Гидролиз солей, образованных катионами слабых гидроксидов и анионами
- Обратимость химических реакций. Химическое равновесие и способыегосмещения.
- Следует соблюдать особую осторожность при работе со щелочами.
- Важнейшие соединения галогенов. Загрязнение окружающей среды.
- Раздел 2. Органическая химия
- Положение о химическом строении.
- Строение алканов, их гомологический ряд
- Алкены, строение, гомологический ряд.
- Каучук природный и синтетический. Резина.
- Строение и гомологический ряд алкинов.
- Арены. Бензол. Химические свойства бензола: горение, реакции замещения (галогенирование, нитрование). Применение бензола на основе свойств.
- Определение, классификация, строение спиртов и гомологический ряд
- Реакции, протекающие с разрывом связи С-ОН
- Этиленгликоль, получение, значение
- II. Реакции с участием бензольного кольца
- Биологическая роль соединений фенола
- Оксимы применяются для получения пестицидов, лекарственных веществ, реактивы для анализа.
- Строение карбоновых кислот их классификация
- Электронный характер строения карбоксильной группы.
- Высшие жирные кислоты: стеариновая, пальмитиновая
- Изомерия и номенклатура сложных эфиров
- Понятие об углеводах. Классификация углеводов.
- Тема. 2.4: Азотсодержащие органические соединения. Полимеры
- Физические и химические свойства нитросоединений.
- Аминокислоты, строение, классификация, изомерия и номенклатура.
- Выделение белков и их свойства
Похожие статьи вашей тематики
 
«ОН» - функциональная группа спиртов и фенолов. В фенолах она связана с углеродом ароматического ядра, в спиртах – с любым углеродным атомом.
СН3 – СН2ОН – этиловый спирт
 
СН2 – СН - СН2ОН – аллиловый спирт
Одноатомные спирты имеют общую формулу R – OH, или Ar – (СН2)n- OH,

Спирты могут быть первичные, вторичные, третичные
Номенклатура. Изомерия
3 2 1 4 3 2 1
СН2 = СН – СН2 - СН2ОН СН3 – СН = СН- СН2ОН
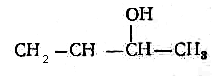
Способы получения
Гидратация алкенов
СН2 = СН2 + Н2О → + Н2О → СН3 - СН2ОН
СН2= СН - СН3ОН → СН3 – СН – СН3
|
OH
В промышленности гидратация олефинов проводится двумя способами: при участии серной кислоты сернокислотная гидратация и прямая гидратация.
СН2 = СН2 + НОSO2OH → СН3 - СН2 – ОSO2ОН
СН3 - СН2– ОSO2ОН + Н2О → СН3 - СН2ОН + H2SO4
Прямую гидратацию проводят в одну стадию:
СН2 = СН2 + Н2О  СН3 - СН2ОН СН3 - СН2ОН
2)  Восстановление альдегидов и кетонов Восстановление альдегидов и кетонов
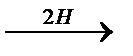 СН3 - СН2ОН СН3 - СН2ОН
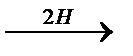
СН3 – С - СН3 СН3 – СН - СН3
|
OH
Восстановление кислот и сложных эфиров

R – COOH 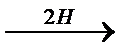 R – СН2ОН R – СН2ОН
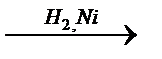
R – СН2ОН + R1 – OH
4) Гидролизом галогеналкилов при нагревании с водой раствором щелочей (в первом случае реакция обратима)
HOH С2Н5OH + HCl
С2Н5Cl
NaOH
С2Н5OH + NaCl
Действием металлорганических соединений на альдегиды и кетоны
 Н2С =О + СН3MgJ →СН3 - СН2ОMgJ СН3 - СН2ОН +MgJ(OH) Н2С =О + СН3MgJ →СН3 - СН2ОMgJ СН3 - СН2ОН +MgJ(OH)
ОMgJ 
 | |
+ СН3MgJ →СН3 – СН СН3 – СН – СН3 +MgJ(OH)
| |
СН3 OH
ОMgJOH
 | | | |
C = O+ СН3MgJ →СН3 – СН - СН3 СН3 – СН – СН3 +MgJ(OH)
| | |
СН3 СН3 СН3
Получение спиртов брожением (этилового и бутилового)
С6Н12OH → 2 СО2 + 2С2Н5OH

 7) Гидролизом сложных эфиров 7) Гидролизом сложных эфиров
 + R1 – OH + R1 – OH
Химические свойства
Химическое поведение определяется в первую очередь наличием в их молекуле функциональной группы ОН.

Особое место занимают два типа реакций замещения, протекающие с разрывом связи С- О и О-Н.
Также для спиртов характерны реакции отщепления (элиминирования). Окисления, дегидратации. Положение гидроксильной группы ОН и молекулярная масса существенно влияет на химическое поведение спиртов.
Реакции с разрывом связи О-Н.
Образование алкоголятов.
Спирты – очень слабые кислоты, но взаимодействуя с металлами (K, Na,Mg, Al), образуют алкоголяты:
2СН3 → СН2ОН +2Na →СН3 - СН2ОNa + Н2↑
СН3 - СН2ОNa + HOH →СН3 - СН2ОH + NaOH
Легче всего замещается атом водорода в металле. Труднее в третичных спиртах.
Образование сложных эфиров. Реакция этерификации
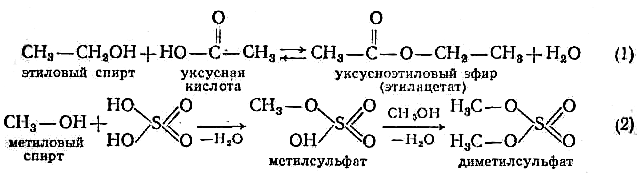
Взаимодействие спиртов с кислотами (органическим и неорганическими) приводит к образованию производных кислот, называемых сложными эфирами.

     Первичные спирты реагируют быстрее вторичных, вторичные быстрее третичных. Первичные спирты реагируют быстрее вторичных, вторичные быстрее третичных.
Легче, чем с кислотами, спирты образуют сложные эфиры при взаимодействии с хлорангидридами и ангидридами кислот.

+ СН3OH → СН3 – С - СН3 + HCl
  
+ СН3OH → СН3 – С - СН3 +
|