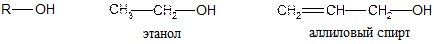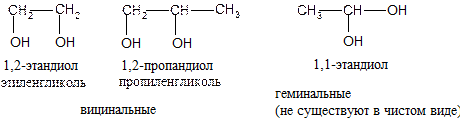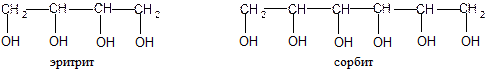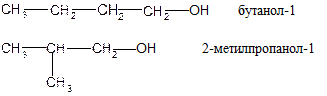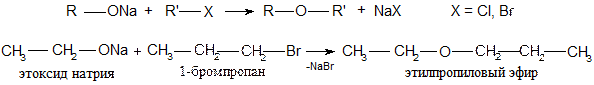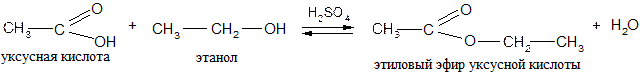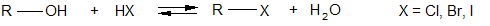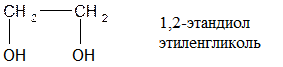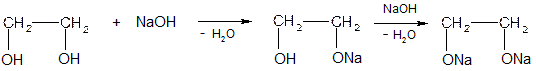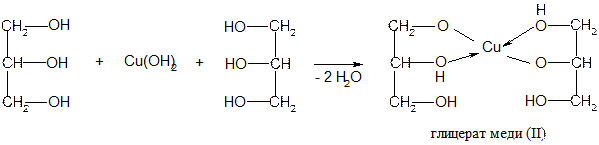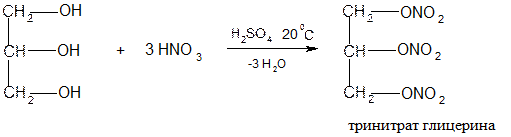Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика спиртов. КлассификацияСодержание книги
Поиск на нашем сайте
Спирты – это производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных ОН – групп, связанных с насыщенным атомом углерода. Номенклатура: систематическая – к названию соответствующего углеводорода добавляют окончание – ол, цифрой указывают положение ОН-группы; применяют тривиальные названия.
КЛАССИФИКАЦИЯ По числу ОН – групп спирты делятся на ● одноатомные
● двухатомные (диолы) ● трехатомные (триолы)
● многоатомные (полиолы)
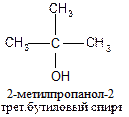
В зависимости от положения ОН-групп различают ● первичные
● вторичные
● третичные
В зависимости от природы радикала R различают ● насыщенные
● ненасыщенные
● ароматические
● алициклические
Изомерия
1. Углеродного скелета
2. Положение функциональной группы:
3. Межклассовая изомерия (спирты изомерны классу простых эфиров)
§3. Способы получения одноатомных спиртов.
1. Гидратация алкенов В зависимости от строения непредельного углеводорода могут образовываться первичные, вторичные и третичные спирты:
этилен этанол
пропилен 2-пропанол
метилпропен 2-метил-2-пропанол
2. Гидролиз галогенпроизводных; осуществляется под действием водного р-ра щелочи:
3. Гидролиз сложных эфиров:
4. Восстановление карбонильных соединений:
5. Некоторые специфические методы получения: а) получение метанола из синтез-газа (давление – 50 – 150атм, температура – 200 - 300°С, катализаторы – оксиды цинка, хрома, алюминия):
б) получение этанола брожением сахаров:
Физические свойства
Метиловый спирт – бесцветная жидкость с характерным спиртовым запахом, Ткип.= 64,7оС, горит бледным пламенем. Сильно ядовит. Этиловый спирт – бесцветная жидкость с характерным спиртовым запахом, Ткип.=78,3оС Спирты С1 – С11 – жидкости, С12 и выше – твердые вещества. спирты С4 – С5 имеют удушливый сладковатый запах; высшие спирты запаха не имеют. Относительная плотность меньше 1, т.е. легче воды. Низшие спирты (до С3) с водой смешиваются в любых соотношениях. С увеличением углеводородного радикала растворимость в воде уменьшается, возрастает гидрофобность молекулы. Спирты способны к межмолекулярной ассоциации:
В связи с этим температуры кипения и плавления у спиртов выше, чем у соответствующих углеводородов и галогенпроизводных. Способность этилового спирта к образованию водородных связей лежит в основе его антисептических свойств.
§5. Химические свойства одноатомных спиртов.
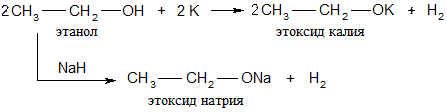
Характерные реакции спиртов определяются наличием в их молекуле гидроксильной группы, которая обуславливает их значительную реакционную способность. 1. Взаимодействие с щелочными металлами:
Алкоголяты металлов R-ОМе – бесцветные твердые вещества, легко гидролизуются водой. Являются сильными основаниями. 2.Основные свойства
3.Образование простых эфиров:
4.Образование сложных эфиров с неорганическими кислотами:
с органическими кислотами:
5.Реакция спиртов с галогенводородами:
Использование галогенидов фосфора:
6. Реакции дегидратации спиртов. Отщепление воды от спиртов происходит в присутствии кислот или над катализаторами при повышенной температуре. Дегидратация спиртов протекает согласно эмпирическому правилу Зайцева: предпочтительно водород отщепляется от наименее гидрогенизированного β-углеродного атома. 1) Дегидратация первичных спиртов протекает в жестких условиях:
2) Дегидратация вторичных спиртов:
3) Дегидратация третичных спиртов:
7.Окисление (окислители – КМnО4, К2Сr2О7 в кислой среде)
8.Дегидрирование спиртов:
Двухатомные спирты (диолы)
Способы получения. 1. Окисление этилена
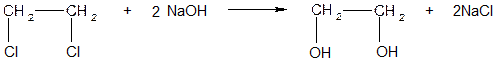
2. Гидролиз дигалогенпроизводного
Физические свойства:
Этиленгликоль – вязкая бесцветная жидкость сладкая на вкус, растворяется в воде; безводный этиленгликоль гигроскопичен.
Химические свойства Реакции в основном аналогичны реакциям одноатомных спиртов, причем реакции могут протекать по одной или по двум гидроксильным группам. 1. Кислотные свойства; этиленгликоль более сильная кислота, чем этанол (рКа = 14,8). Образование гликолятов
С гидроксидом меди образует хелатный комплекс:
2. Реакции замещения на галогены
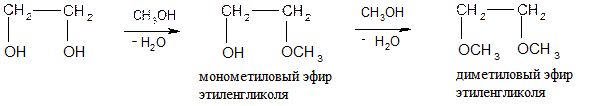
3. Образование простых эфиров
4. Дегидратация
5. Окисление
Трехатомные спирты (триолы)
Способы получения. 1. Гидролиз жиров
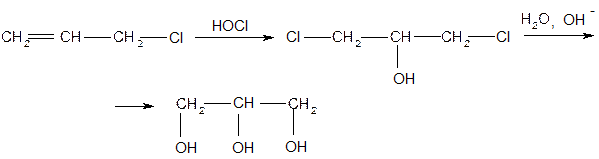
2. Из аллилхлорида
Физические свойства: Глицерин – вязкая жидкость со сладким вкусом. Не ограничено растворим в воде, этаноле; не растворяется в эфире, безводный глицерин гигроскопичен (поглощает до 40% влаги из воздуха).
Химические свойства
Реакции в основном аналогичны реакциям одноатомных спиртов, причем реакции могут протекать по одной, по двум или сразу по трем гидроксильным группам. 1. Кислотные свойства; глицерин более сильная кислота, чем этанол и этиленгликоль. рКа = 13, 5.
С гидроксидом меди образует хелатный комплекс:
2. Реакции замещения
3. Дегидратация
Применение спиртов
Метанол и этанол используются в качестве растворителей, а так же как исходные вещества в синтезе органических веществ. Этанол применяют в фармации для приготовления настоек, экстрактов; в медицине – как антисептик. Этиленгликоль применяют для получение синтетических полиэфирных волокон (например, лавсан), а так же в качестве антифриза (50%-ный р-р) – незамерзающая жидкость для охлаждения двигателей внутреннего сгорания. Глицерин используется как компонент косметических препаратов и мазей. Тринитрат глицерина – лекарственный препарат при лечении стенокардии. Тринитрат глицерина применяют в производстве взрывчатых веществ (динамит). Использование глицерина в пищевой и текстильной промышленности.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 5326; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.149.244 (0.006 с.) |