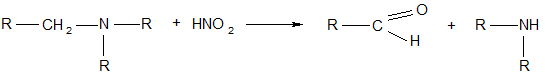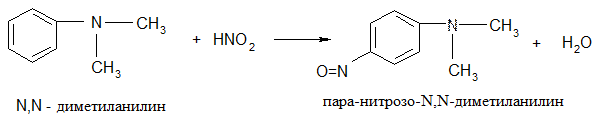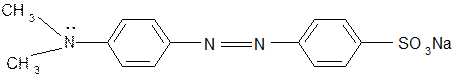Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторно-практическое занятие №8Содержание книги Поиск на нашем сайте
Лабораторно-практическое занятие №8 Тема: Галогенпроизводные углеводородов Цельзанятия: 1. ознакомиться с основными методами синтеза галогенпроизводных углеводородов; 2.изучить особенности химического строения и реакционной направленности галогенпроизводных углеводородов; 3. ознакомиться с химическими свойствами галогеналканов, галогеналкенов, галогенаренов; 4. научиться анализировать качественный состав галогеналкилов.
Контрольные вопросы 1. Галогенпроизводные углеводородов; классификация в зависимости от расположения и числа галогенов в углеводороде, от строения радикала. Номенклатура. 2. Галогеналканы. Физические свойства. Способы получения. 3. Химические свойства галогеналканов. Реакции нуклеофильного замещения. 4. Реакции отщепления (элиминирование). Правило Зайцева. 5. Галогеналкены. Аллил- и винилгалогениды. Причины различной реакционной способности в реакциях нуклеофильного замещения. 6. Галогенарены. Нуклеофильное замещение галогена в ядре. Дезактивирующее влияние и ориентирующее влияние галогена в реакциях электрофильного замещения.
§1. Галогенпроизводные углеводородов; классификация в зависимости от расположения и числа галогенов в углеводороде, от строения радикала. Номенклатура.
Галогенпроизводные углеводородов – это органические вещества, в молекулах которых содержатся атомы галогенов, связанных с углеводородным радикалом.
Классификация
І. По природе у/в радикала: 1. алифатические (насыщенные и ненасыщенные):
2. ароматические
1. алициклические
II. По количеству атомов галогена: 1. моногалогенпроизводные
2. дигалогенпроизводные
3. три- и полигалогенпроизводные
III. По положению атома галогена и характера атома углерода
§2. Галогеналканы. Физические свойства. Способы получения.
Физические свойства. В чистом состоянии галогенуглеводороды – бесцветные соединения, низшие представители имеют сладковатый запах. В воде практически не растворимы, растворяются в эфирах, спиртах; сами являются хорошими растворителями. Ткип. и плотность алифатических галогенуглеводородов с одинаковым числом атомов углерода уменьшается в ряду первичные > вторичные > третичные С увеличением числа атомов галогенов в молекуле Ткип. и плотность возрастают.
Способы получения. 1. Галогенирование алканов, алкенов, алкинов, аренов
хлористый метил
хлористый метилен
хлороформ
четыреххлористый углерод
2. Гидрогалогенирование ненасыщенных углеводородов
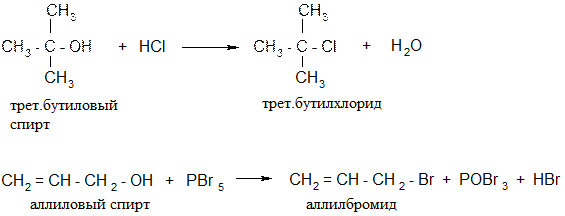
3. Из спиртов:
4. Галогенирование альдегидов и кетонов:
§3. Химические свойства галогеналканов.
В молекуле галогеналкила присутствуют два реакционных центра
І. Реакции нуклеофильного замещения (по электрофильному центру)
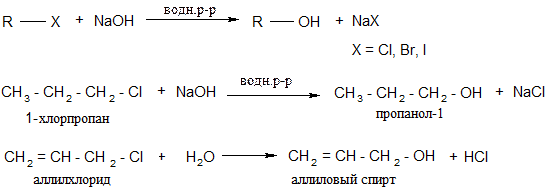
1. Гидролиз (осуществляется под действием водного р-ра щелочи):
2. Реакция с алкоголятами металлов (метод получения простых эфиров):
3. Реакция с солями карбоновых кислот (метод получения сложных эфиров):
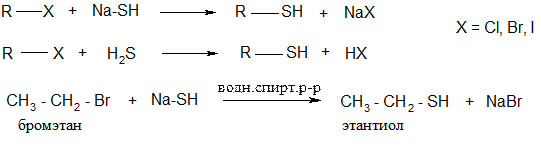
4. Получение серосодержащих производных (тиолов и сульфидов):
5. Реакция с аммиаком и аминами (алкилирование аммиака и аминов):
6. Взаимодействие с нитритами металлов (получение нитросоединений):
7. Взаимодействие с нитрилами:
8. Реакция с ацетиленидами (галогеналкилы как алкилирующие реагенты):
9. Реакция с галогенсодержащими нуклеофилами (замена Сl или Br на I или F):
ІІ. Реакции отщепления (элиминирования): 1. Отщепление галогенводородов осуществляется в присутствии сильного основания (алкоголяты металлов или спиртовые растворы щелочей):
Правило Зайцева: атом водорода отщепляется от соседнего наименее гидрогенизированного атома углерода. 2. Дегалогенирование:
3. Реакция Вюрца:
4. Взаимодействие с магнием (образование реактива Гриньяра):
5. Восстановление галолгенпроизводных:
ІІІ. Галогеналкилы как алкилирующие реагенты:
IV. Полимеризация:
§4. Галогеналкены. Аллил- и винилгалогениды.
Реакционная способность аллил- и бензилгалогенидов: легко вступают в реакции нуклеофильного замещения
Экспериментальная часть Опыт 1. Получение хлороэтана. В пробирку поместите 2 лопатки хлорида натрия, прибавьте 8 – 10 капель этилового спирта и 4 – 5 капель концентрированной серной кислоты. Пробирку закройте газоотводной трубкой и осторожно нагрейте на слабом пламени горелки. Выделяющийся хлорэтан подожгите у отверстия газоотводной трубки. Он загорается, образуя колечко зеленого цвета (образование хлороэтана начинается не сразу). Напишите уравнения получения хлороэтана. Опыт 2. Проба Бейльштейна. При прокаливании органического галогенсодержащего вещества с оксидом меди (ІІ) происходит его окисление. Углерод превращается в оксид углерода (ІV), водород – в воду, галогены (кроме фтора) – в летучие галогениды меди(ІІ), окрашивающие пламя в ярко-зеленый цвет (проба Бейльштейна). Реакция высокочувствительна, но ее нельзя использовать для обнаружения галогенов в соединениях, имеющих азотсодержащие заместители, так как они тоже окрашивают пламя. Медную проволоку длиной 10 см одним концом закрепляют в пробке, а на другом конце делают петлю. Держа пробку в руке, прокалите петлю в пламени горелки до прекращения окрашивания пламени и образования на поверхности проволоки черного налета оксида меди (ІІ). Остывшую петлю смочите хлороформом и введите в пламя горелки. Сначала пламя становится светящимся (так как сгорает углерод), а затем появляется интенсивное зеленое окрашивание. По окончании работы для очистки проволоку смочите хлороводородной кислотой и прокалите. Проделайте пробу Бейльштейна с бромпроизводным. Изомерия
1. Углеродного скелета
2. Положение функциональной группы:
3. Межклассовая изомерия (спирты изомерны классу простых эфиров)
§3. Способы получения одноатомных спиртов.
1. Гидратация алкенов В зависимости от строения непредельного углеводорода могут образовываться первичные, вторичные и третичные спирты:
этилен этанол
пропилен 2-пропанол
метилпропен 2-метил-2-пропанол
2. Гидролиз галогенпроизводных; осуществляется под действием водного р-ра щелочи:
3. Гидролиз сложных эфиров:
4. Восстановление карбонильных соединений:
5. Некоторые специфические методы получения: а) получение метанола из синтез-газа (давление – 50 – 150атм, температура – 200 - 300°С, катализаторы – оксиды цинка, хрома, алюминия):
б) получение этанола брожением сахаров:
Физические свойства
Метиловый спирт – бесцветная жидкость с характерным спиртовым запахом, Ткип.= 64,7оС, горит бледным пламенем. Сильно ядовит. Этиловый спирт – бесцветная жидкость с характерным спиртовым запахом, Ткип.=78,3оС Спирты С1 – С11 – жидкости, С12 и выше – твердые вещества. спирты С4 – С5 имеют удушливый сладковатый запах; высшие спирты запаха не имеют. Относительная плотность меньше 1, т.е. легче воды. Низшие спирты (до С3) с водой смешиваются в любых соотношениях. С увеличением углеводородного радикала растворимость в воде уменьшается, возрастает гидрофобность молекулы. Спирты способны к межмолекулярной ассоциации:
В связи с этим температуры кипения и плавления у спиртов выше, чем у соответствующих углеводородов и галогенпроизводных. Способность этилового спирта к образованию водородных связей лежит в основе его антисептических свойств.
§5. Химические свойства одноатомных спиртов.
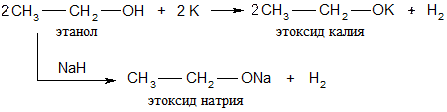
Характерные реакции спиртов определяются наличием в их молекуле гидроксильной группы, которая обуславливает их значительную реакционную способность. 1. Взаимодействие с щелочными металлами:
Алкоголяты металлов R-ОМе – бесцветные твердые вещества, легко гидролизуются водой. Являются сильными основаниями. 2.Основные свойства
3.Образование простых эфиров:
4.Образование сложных эфиров с неорганическими кислотами:
с органическими кислотами:
5.Реакция спиртов с галогенводородами:
Использование галогенидов фосфора:
6. Реакции дегидратации спиртов. Отщепление воды от спиртов происходит в присутствии кислот или над катализаторами при повышенной температуре. Дегидратация спиртов протекает согласно эмпирическому правилу Зайцева: предпочтительно водород отщепляется от наименее гидрогенизированного β-углеродного атома. 1) Дегидратация первичных спиртов протекает в жестких условиях:
2) Дегидратация вторичных спиртов:
3) Дегидратация третичных спиртов:
7.Окисление (окислители – КМnО4, К2Сr2О7 в кислой среде)
8.Дегидрирование спиртов:
Двухатомные спирты (диолы)
Способы получения. 1. Окисление этилена
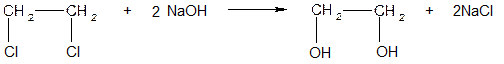
2. Гидролиз дигалогенпроизводного
Физические свойства:
Этиленгликоль – вязкая бесцветная жидкость сладкая на вкус, растворяется в воде; безводный этиленгликоль гигроскопичен.
Химические свойства Реакции в основном аналогичны реакциям одноатомных спиртов, причем реакции могут протекать по одной или по двум гидроксильным группам. 1. Кислотные свойства; этиленгликоль более сильная кислота, чем этанол (рКа = 14,8). Образование гликолятов
С гидроксидом меди образует хелатный комплекс:
2. Реакции замещения на галогены
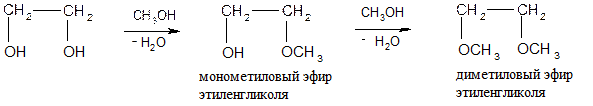
3. Образование простых эфиров
4. Дегидратация
5. Окисление
Трехатомные спирты (триолы)
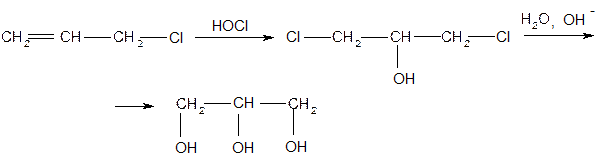
Способы получения. 1. Гидролиз жиров
2. Из аллилхлорида
Физические свойства: Глицерин – вязкая жидкость со сладким вкусом. Не ограничено растворим в воде, этаноле; не растворяется в эфире, безводный глицерин гигроскопичен (поглощает до 40% влаги из воздуха).
Химические свойства
Реакции в основном аналогичны реакциям одноатомных спиртов, причем реакции могут протекать по одной, по двум или сразу по трем гидроксильным группам. 1. Кислотные свойства; глицерин более сильная кислота, чем этанол и этиленгликоль. рКа = 13, 5.
С гидроксидом меди образует хелатный комплекс:
2. Реакции замещения
3. Дегидратация
Применение спиртов
Метанол и этанол используются в качестве растворителей, а так же как исходные вещества в синтезе органических веществ. Этанол применяют в фармации для приготовления настоек, экстрактов; в медицине – как антисептик. Этиленгликоль применяют для получение синтетических полиэфирных волокон (например, лавсан), а так же в качестве антифриза (50%-ный р-р) – незамерзающая жидкость для охлаждения двигателей внутреннего сгорания. Глицерин используется как компонент косметических препаратов и мазей. Тринитрат глицерина – лекарственный препарат при лечении стенокардии. Тринитрат глицерина применяют в производстве взрывчатых веществ (динамит). Использование глицерина в пищевой и текстильной промышленности.
Способы получения фенолов
1. Из каменноугольной смолы. 2. Кумольный метод
3. Сплавление солей ароматических сульфокислот с щелочью:
4. Разложение солей диазония:
5. Гидролиз галогенпроизводных
§11. Химические свойства фенолов.
1. Кислотные свойства: фенолы образуют соли:
Фенол – более слабая кислота, чем угольная Н2СО3:
2. Реакции с участием ОН-группы.
а) алкилирование (образование простых эфиров)
б) ацилирование (образование сложных эфиров):
3. Реакции замещения ОН-группы:
Фенол с NH3 и R – NH2 не взаимодействует.
4. Реакции электрофильного замещения, характерные для аренов. Замещение протекает быстрее, чем у бензола. ОН-группа направляет новый заместитель в орто- и пара-положения. а) галогенирование (обесцвечивание бромной воды – качественная реакция на фенол):
б) нитрование
в) сульфирование:
5. Реакции конденсации
а) с формальдегидом
б) с фталевым ангидридом
6. Окисление а) на воздухе белые кристаллы фенола розовеют; б) фенол с раствором FeCl3 дает красно-фиолетовое окрашивание; крезол – голубое окрашивание; в) окисление сильными окислителями
7. Восстановление
8. Карбоксилирование (реакция Кольбе – Шмитта):
Применение 1. Фенол применяется в производстве фенолформальдегидных смол, капролактама, пикриновой кислоты, красителей, инсектицидов, лекарственных средств. 2. Пирокатехин и его производные используются в производстве лекарственных средств (получен синтетический гормон – адреналин) и душистых веществ. 3. Резорцин применяют в синтезе красителей; в медицине в качестве дезинфицирующего средства. Экспериментальная часть
Опыт 1. Влияние радикала и количества гидроксильных групп на растворимость спиртов. В три пробирки внесите 4-5 капель этилового, изоамилового спиртов и глицерина. В каждую пробирку добавьте по 5-6 капель воды, взболтайте. Что наблюдали? Опыт 2. Обнаружение воды в этиловом спирте и его обезвоживание. В сухую пробирку внесите 10 капель этилового спирта, добавьте немного обезвоженного сульфата меди, тщательно перемешайте, дайте отстояться. Если спирт содержит воду, осадок сульфата меди окрасится в голубой цвет вследствии образования медного купороса СuSO4 · 5H2O. Сохраните обезвоженный спирт для дальнейшего опыта. Опыт 3. Образование этилата натрия. Поместите в сухую пробирку маленький кусочек натрия, добавьте 3 капли обезвоженного этилового спирта (из предыдущего опыта) и закройте отверстие пробирки пальцем. Тут же начинается выделение водорода. По окончании реакции, не отрывая пальца от отверстия пробирки, поднесите ее к пламени горелки. При открытии пробирки водород воспламеняется с характерным звуком, образуя колечко голубоватого цвета. На дне пробирки остается беловатый осадок этилата натрия или его раствор. При добавлении в пробирку 1 капли спиртового раствора фенолфталеина появляется красное окрашивание. Напишите уравнения протекающих реакций. Опыт 4. Окисление этилового спирта хромовой смесью. Введите в пробирку 3-4 капли этилового спирта. Добавьте 1 каплю 2н раствора серной кислоты и 2 капли 0,5н раствора бихромата калия. Полученный оранжевый раствор нагрейте над пламенем горелки до начала изменения цвета. Обычно уже через несколько секунд цвет раствора становится синевато-зеленым. Одновременно ощущается характерный запах уксусного альдегида, напоминающий запах яблок. Метод можно применять для распознавания первичных и вторичных спиртов. Напишите уравнения реакций. Опыт 5. Получение этилацетата. В сухую пробирку поместите немного порошка обезвоженного ацетата натрия (высота слоя около 2мм) и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и нагрейте осторожно над пламенем горелки. Через несколько секунд появляется характерный приятный освежающий запах уксусноэтилового эфира. Уравнения реакции:
Опыт 6. Реакция глицерина с гидроксидом меди (II) в щелочной среде. Поместите в пробирку 3 капли 0,2н раствора СuSO4, 2 капли 2н раствора NаОН и перемешайте. Появляется студенистый осадок гидроксида меди (II): При нагревании в щелочной среде до кипения полученный гидроксид меди (II) разлагается. Это обнаруживается по выделению черного осадка оксида меди (II):
Повторите опыт, но перед кипячением гидроксида меди (II) добавьте в пробирку 1 каплю глицерина. Взболтайте. Нагрейте до кипения полученный раствор и убедитесь в том, что раствор глицерата меди при кипячении не разлагается. Здесь образуется хелатное соединение
Опыт 7. Образовавние акролеина из глицерина. Поместите в пробирку 3-4 кристалла бисульфата калия и 1 каплю глицерина. Нагрейте на пламени горелки. Признаком начавшегося разложения глицерина служит побурение жидкости в пробирке и появление тяжелых паров образующегося акролеина, обладающего очень резким запахом.
Опыт 8. Растворимость фенола в воде. Поместите в пробирку 1 каплю жидкого фенола, добавьте 1 каплю воды и взболтайте. Получится мутная жидкость – эмульсия фенола. При стоянии такая эмульсия расслаивается, причем внизу будет раствор воды в феноле, или жидкий фенол, а вверху – раствор фенола в воде, или карболовая вода. Прибавляйте по каплям воду, каждый раз встряхивая пробирку, пока не получится прозрачный раствор фенола в воде. Сохраните полученную фенольную воду для последующих опытов. Опыт 9. Цветные реакции на фенольную воду. Поместите в пробирку 3 капли прозрачной фенольной воды и добавьте 1 каплю 0,1н раствора FeCl3 – появляется фиолетовое окрашивание. Более чувствительной реакцией на фенол является цветная индофеноловая проба. Поместите в пробирку 1 каплю прозрачной карболовой воды. Добавьте к ней 3 капли 2н раствора NН4ОН и затем 3 капли насыщенного раствора бромной воды. Через несколько секунд на белом фоне бумаги можно заметить синее окрашивание, постепенно увеличивающееся за счет образования красящего вещества – индофенола. Опыт 10. Образование трибромфенола. Поместите в пробирку 3 капли бромной воды и добавьте 1 каплю прозрачной карболовой воды. Фенолы со свободными орто- и пара-положениями обесцвечивают бромную воду и образуют при этом продукты замещения, которые обычно выпадают в осадок.
Опыт 11. Доказательство кислотного характера фенола. К остатку фенольной воды добавьте еще 1 каплю фенола и встряхните. К вновь полученной эмульсии добавьте 1 каплю 2н раствора NаОН. Моментально образуется прозрачный раствор фенолята натрия, так как он хорошо растворяется в воде.
§10. Задачи для самостоятельного решения.
1. Напишите структурные формулы следующих соединений: 3-метил-2-пентанол; 2-метил-3-бутин-2-ол; 1-фенилпропанол-1. 2. Реакцией Гриньяра получите следующие спирты: 1) 2-метил-3-пентанол; 2) 2,3-диметил-3-пентанол; 3) 2,2-диметил-1-пропанол. 3. Получите гидратацией соответствующих этиленовых углеводородов следующие спирты: а) 2-метилпентанол-2; б) 3,3-диметилбутанол-2. 4. Напишите реакции окисления вторичного бутилового спирта; 2-метилбутанола-1. 5. Подвергните 2-пентанол дегидратации, затем продукт реакции окислите водным раствором перманганата калия. Полученное соединение обработайте уксусной кислотой. Напишите уравнения реакций и назовите все продукты. 6. Получите фенол из бензола и 1-бутена через стадию образования гидроперекиси втор.бутила. 7. Опишите схему следующих превращений:
8. Расположите следующие соединения в порядке убывания кислотных свойств:
Методы получения 1. Аммонолиз спиртов: катализатор – Аl2O3, SiO2, температура – 300 – 500оС давление – 1 – 20 МПа
2. Каталитическое гидрирование нитрилов: катализатор – Ni, Co температура – 150 – 250оС давление – 0,1 – 10 МПа
3. Восстановление нитросоединений (получение ароматических аминов):
4. Реакция Гофмана:
5. Алкилирование аммиака галогеналкилами
Физические свойства
Метил-, диметил- и триметиламины – газы, хорошо растворимы в воде, обладают запахом аммиака; остальные низшие амины – жидкости с запахом аммиака; более сложные амины – жидкости с неприятным запахом рыбы. Растворимость в воде уменьшается. Высшие амины – твердые вещества без запаха, в воде не растворимы. Анилин – бесцветная жидкость со слабым запахом, похожим на запах бензола, при стоянии на воздухе окисляется, приобретает желто-коричневый цвет и неприятный запах. В воде практически не растворим. Ароматические амины – токсичны. Амины образуют слабые межмолекулярные водородные связи (связь N-H менее полярна, чем О-Н), поэтому температуры кипения и плавления у них меньше, чем у соответствующих спиртов:
Химические свойства 1. Основные свойства.
Алкиламины – сильные основания; основность проявляется уже в водных растворах:
Диалкиламины более сильные основания, чем алкиламины; третичные амины в неводных растворах – самые сильные основания, но в водных растворах они слабее, чем вторичные, из-за специфической сольватации третичного амина молекулами воды.
Ариламины – более слабые основания, это связано с электроноакцепторным влиянием бензольного кольца: р,π – сопряженная система, +М > - I
Алкилирование аминогруппы увеличивает основность: Кв (С6Н5NНСН3) = 7,1 · 10-10 Кв (С6Н5N(СН3)2) = 1,1 · 10-9
2. Алкилирование аминов спиртами, алкилгалогенидами:
3. Ацилирование – нагревание аминов с карбоновыми кислотами или их производными (хлорангидридами, ангидридами, сложными эфирами):
4. Реакции с азотистой кислотой НNО2 а) алифатические первичные амины образуют спирты
б) алифатические вторичные амины образуют нитрозосоединения
в) алифатические третичные амины при обычной температуре с НNО2 не реагируют; при нагревании в слабокислой среде расщепляются с образованием вторичного амина и альдегида
Реакции применяются для идентификации алифатических аминов. г) ароматические амины ● первичные
● вторичные
● третичные
5. Слабые кислотные свойства первичных и вторичных аминов
6. Реакции окисления
Первичные амины окисляются в жестких условиях:
Строение солей диазония. Диазосоединения содержат азогруппу =N2, связанную с одним органическим радикалом. Например,
Классификация. 1. Алифатические диазосоединения - диазоалканы:
RR'СN2 R, R' = H, Al
CH2N2 – диазометан (CH3)2CN2 – 2-диазопропан
Диазосоединения – вещества от желтого до красного цвета, ядовиты Низшие диазосоединения – взрывоопасные газы Высшие диазосоединения – жидкости и твердые (более устойчивы) Длина связи N – N = 0,113 нм Длина связи С – N = 0,132 нм
Получение диазометана
Диазометан – желто-зеленый газ, взрывоопасен, поэтому в свободном виде его не выделяют, а используют в растворе диэтилового эфира. Сильно раздражает слизистые оболочки глаз и дыхательных путей, действует на ЦНС. Диазометан (и диазоалканы) – высоко реакционноспособные вещества.Используют в качестве метилирующего агента, а также для получения карбоновых кислот, эфиров и других органических соединений.
1. Образование сложного и простого эфиров:
2. Реакция с галогенводородами:
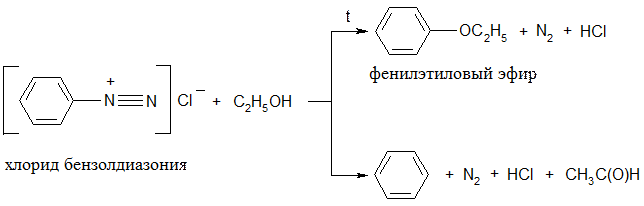
Реакции солей диазония I. Реакции солей диазония с выделением азота 1) Кипячение
2) Замещение на иод
3) Замещение на другие атомы или группы атомов протекает в присутствии катализаторов:
4) Восстановление с помощью спиртов
II. Реакции солей диазония без выделения азота
Реакция азосочетания
Азосоединения – окрашенные вещества, т.к. содержат хромофорную группу - N = N, способствующую поглощению света в видимой области спектра. Ауксохромные группы –ОН и NH2 – группы углубляют цвет и способствуют связыванию красителей с волокнами. Азосоединения используются как индикаторы; метиловый оранжевый (гелиантин, 4-диметиаминоазобензол-4-сульфонат натрия)
Переход окрашенных форм в зависимости от реакции среды определяется равновесием:
Экспериментальная часть
I. Реакция с HNO2 1.Первичные алифатические амины при действии HNO2 выделяют азот: R – NH2 + HNO2 ® ROH + N2 + H2O Ароматические амины превращаются в диазосоединения, которые дают азокрасители: Ar – NH2 + NaNO2 + 2HCI ® ArN2CI + 2H2O ArN2CI + b-C10H7ONa ® ArN = NC10H6OH + NaCI b - нафтол Опыт: растворяют 0,2г сульфаниловой кислоты в 0,5мл 2М NaOH при нагревании и каплю полученного раствора наносят на фильтровальную бумагу. На образовавшееся пятно наносят каплю 10%-ного раствора NaNO2, 1 каплю 1М HCI, а затем каплю раствора b - нафтола в 2М NaOH. Сразу же появляется оранжевое окрашивание. 2.Вторичные амины (алифатические и ароматические) при действии HNO2 образуют нитрозамины: R2 – NH + HONO ® R2N – N = O + H2O 3.Третичные амины (алифатические и чисто ароматические) не реагируют с HNO2. Жирноароматические третичные амины при обработке HNO2 образуют С-нитрозопроизводные: R2N – Ar + NaNO2 + 2HCI ® 2R2N – Ar – N = O Опыт: в пробирку помещают 1 каплю диметиланилина и добавляют 2 капли концентрированной соляной кислоты. Содержимое пробирки охлаждают холодной водой. Затем добавляют 2 капли 30%-ного NaNO2. После прибавления каждой капли пробирку закрывают пробкой и сильно встряхивают, охлаждая при этом водой. Смесь окрашивается в желто-бурый цвет вследствие образования солянокислой соли n-нитрозодиметиланилина. Для выделения свободного n-нитрозодиметиланилина в пробирку постепенно прибавляют по каплям 5%-ный раствор соды до образования зеленой окраски, а затем 2мл эфира и встряхивают. Эфирный слой приобретает изумрудно-зеленую окраску n-нитрозодиметиланилина. II. Реакция с гексацианоферратом (II) калия; характерна для третичных аминов всех типов: 2R3N + K4[Fe(CN)6] + 4HCI ® (R3NH)2H2[Fe(CN)6] + 4KCI Опыт: к 2 каплям пиридина (хинолина, диметиланилина) приливают 2мл воды и взбалтывают. Эту смесь добавляют к 1-2мл концентрированного раствора гексацианоферрата (II) калия. При подкислении соляной кислотой выпадает осадок кислого гексацианоферрата (II) ариламмония. III. Изонитрильная проба (дают только первичные амины). Появление характерного запаха свидетельствует об образовании изонитрила: R – NH2 + CH3CI + 3NaOH ® R - NºC + 3NaCI + 3H2O Опыт. В пробирку поместите 1 каплю анилина, 2-3 капли концентрированного раствора гидроксида натрия, 2 капли хлороформа, 5 капель этанола. Смесь медленно нагревайте над пламенем горелки до начала кипения. Появляется характерный неприятный запах изонитрила. Полученный изонитрил подвергните гидролизу. Для этого в пробирку с изонитрилом прилейте 10 капель 10%-ного раствора серной кислоты и прокипятите до исчезновения запаха.
§12. Задачи для самостояте |
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 934; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.231.160 (0.017 с.) |













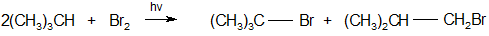




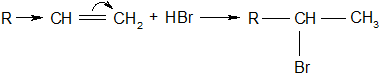




















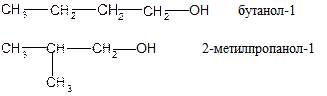













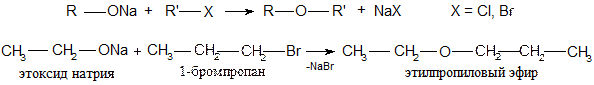

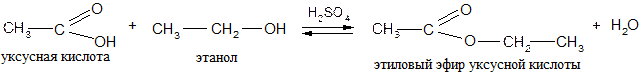
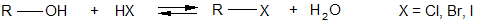









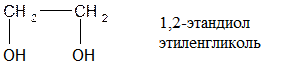

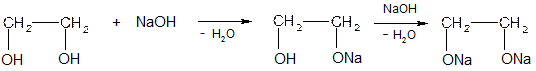







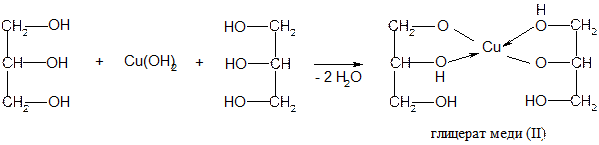
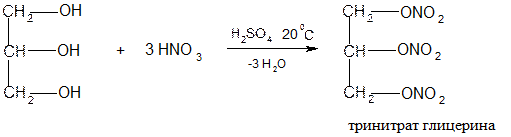







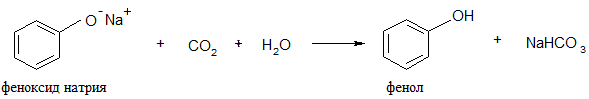











 СН3С(О)ОNа + НОSО3Н NаНSО4 + СН3С(О)ОН
СН3С(О)ОNа + НОSО3Н NаНSО4 + СН3С(О)ОН С2Н5ОН + НОSО3Н Н2О + С2Н5ОSО3Н
С2Н5ОН + НОSО3Н Н2О + С2Н5ОSО3Н СН3С(О)ОН + НОSО3Н Н2SО4 + СН3С(О)О С2Н5
СН3С(О)ОН + НОSО3Н Н2SО4 + СН3С(О)О С2Н5