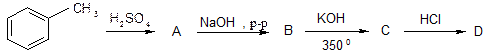Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фенолы. Классификация. Физические свойстваСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
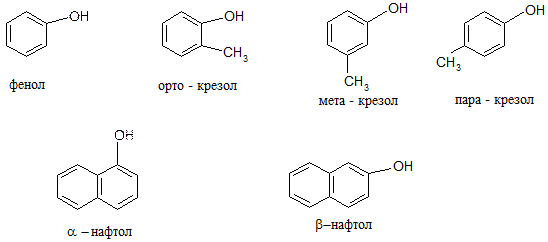
Фенолы – это производные аренов, у которых один или несколько атомов водорода ароматического кольца замещены на ОН-группу. Классификация. 1. Одноатомные фенолы:
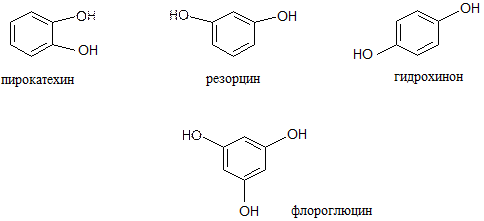
2. Многоатомные фенолы:
Физические свойства:
Фенол и его низшие гомологи – бесцветные низкоплавкие кристаллические вещества или жидкости с характерным запахом. Фенол умеренно растворим в воде. Фенол способен образовывать водородные связи, что лежит в основе его антисептических свойств. Водные растворы фенола вызывают ожоги тканей. Разбавленный водный раствор фенола называется карболовой кислотой. Фенол – токсичен, токсичность гомологов фенола уменьшается, бактерицидная активность увеличивается по мере усложнения алкильного радикала.
Способы получения фенолов
1. Из каменноугольной смолы. 2. Кумольный метод
3. Сплавление солей ароматических сульфокислот с щелочью:
4. Разложение солей диазония:
5. Гидролиз галогенпроизводных
§11. Химические свойства фенолов.
1. Кислотные свойства: фенолы образуют соли:
Фенол – более слабая кислота, чем угольная Н2СО3:
2. Реакции с участием ОН-группы.
а) алкилирование (образование простых эфиров)
б) ацилирование (образование сложных эфиров):
3. Реакции замещения ОН-группы:
Фенол с NH3 и R – NH2 не взаимодействует.
4. Реакции электрофильного замещения, характерные для аренов. Замещение протекает быстрее, чем у бензола. ОН-группа направляет новый заместитель в орто- и пара-положения. а) галогенирование (обесцвечивание бромной воды – качественная реакция на фенол):
б) нитрование
в) сульфирование:
5. Реакции конденсации
а) с формальдегидом
б) с фталевым ангидридом
6. Окисление а) на воздухе белые кристаллы фенола розовеют; б) фенол с раствором FeCl3 дает красно-фиолетовое окрашивание; крезол – голубое окрашивание; в) окисление сильными окислителями
7. Восстановление
8. Карбоксилирование (реакция Кольбе – Шмитта):
Применение 1. Фенол применяется в производстве фенолформальдегидных смол, капролактама, пикриновой кислоты, красителей, инсектицидов, лекарственных средств. 2. Пирокатехин и его производные используются в производстве лекарственных средств (получен синтетический гормон – адреналин) и душистых веществ. 3. Резорцин применяют в синтезе красителей; в медицине в качестве дезинфицирующего средства. Экспериментальная часть
Опыт 1. Влияние радикала и количества гидроксильных групп на растворимость спиртов. В три пробирки внесите 4-5 капель этилового, изоамилового спиртов и глицерина. В каждую пробирку добавьте по 5-6 капель воды, взболтайте. Что наблюдали? Опыт 2. Обнаружение воды в этиловом спирте и его обезвоживание. В сухую пробирку внесите 10 капель этилового спирта, добавьте немного обезвоженного сульфата меди, тщательно перемешайте, дайте отстояться. Если спирт содержит воду, осадок сульфата меди окрасится в голубой цвет вследствии образования медного купороса СuSO4 · 5H2O. Сохраните обезвоженный спирт для дальнейшего опыта. Опыт 3. Образование этилата натрия. Поместите в сухую пробирку маленький кусочек натрия, добавьте 3 капли обезвоженного этилового спирта (из предыдущего опыта) и закройте отверстие пробирки пальцем. Тут же начинается выделение водорода. По окончании реакции, не отрывая пальца от отверстия пробирки, поднесите ее к пламени горелки. При открытии пробирки водород воспламеняется с характерным звуком, образуя колечко голубоватого цвета. На дне пробирки остается беловатый осадок этилата натрия или его раствор. При добавлении в пробирку 1 капли спиртового раствора фенолфталеина появляется красное окрашивание. Напишите уравнения протекающих реакций. Опыт 4. Окисление этилового спирта хромовой смесью. Введите в пробирку 3-4 капли этилового спирта. Добавьте 1 каплю 2н раствора серной кислоты и 2 капли 0,5н раствора бихромата калия. Полученный оранжевый раствор нагрейте над пламенем горелки до начала изменения цвета. Обычно уже через несколько секунд цвет раствора становится синевато-зеленым. Одновременно ощущается характерный запах уксусного альдегида, напоминающий запах яблок. Метод можно применять для распознавания первичных и вторичных спиртов. Напишите уравнения реакций. Опыт 5. Получение этилацетата. В сухую пробирку поместите немного порошка обезвоженного ацетата натрия (высота слоя около 2мм) и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и нагрейте осторожно над пламенем горелки. Через несколько секунд появляется характерный приятный освежающий запах уксусноэтилового эфира. Уравнения реакции:
Опыт 6. Реакция глицерина с гидроксидом меди (II) в щелочной среде. Поместите в пробирку 3 капли 0,2н раствора СuSO4, 2 капли 2н раствора NаОН и перемешайте. Появляется студенистый осадок гидроксида меди (II): При нагревании в щелочной среде до кипения полученный гидроксид меди (II) разлагается. Это обнаруживается по выделению черного осадка оксида меди (II):
Повторите опыт, но перед кипячением гидроксида меди (II) добавьте в пробирку 1 каплю глицерина. Взболтайте. Нагрейте до кипения полученный раствор и убедитесь в том, что раствор глицерата меди при кипячении не разлагается. Здесь образуется хелатное соединение
Опыт 7. Образовавние акролеина из глицерина. Поместите в пробирку 3-4 кристалла бисульфата калия и 1 каплю глицерина. Нагрейте на пламени горелки. Признаком начавшегося разложения глицерина служит побурение жидкости в пробирке и появление тяжелых паров образующегося акролеина, обладающего очень резким запахом.
Опыт 8. Растворимость фенола в воде. Поместите в пробирку 1 каплю жидкого фенола, добавьте 1 каплю воды и взболтайте. Получится мутная жидкость – эмульсия фенола. При стоянии такая эмульсия расслаивается, причем внизу будет раствор воды в феноле, или жидкий фенол, а вверху – раствор фенола в воде, или карболовая вода. Прибавляйте по каплям воду, каждый раз встряхивая пробирку, пока не получится прозрачный раствор фенола в воде. Сохраните полученную фенольную воду для последующих опытов. Опыт 9. Цветные реакции на фенольную воду. Поместите в пробирку 3 капли прозрачной фенольной воды и добавьте 1 каплю 0,1н раствора FeCl3 – появляется фиолетовое окрашивание. Более чувствительной реакцией на фенол является цветная индофеноловая проба. Поместите в пробирку 1 каплю прозрачной карболовой воды. Добавьте к ней 3 капли 2н раствора NН4ОН и затем 3 капли насыщенного раствора бромной воды. Через несколько секунд на белом фоне бумаги можно заметить синее окрашивание, постепенно увеличивающееся за счет образования красящего вещества – индофенола. Опыт 10. Образование трибромфенола. Поместите в пробирку 3 капли бромной воды и добавьте 1 каплю прозрачной карболовой воды. Фенолы со свободными орто- и пара-положениями обесцвечивают бромную воду и образуют при этом продукты замещения, которые обычно выпадают в осадок.
Опыт 11. Доказательство кислотного характера фенола. К остатку фенольной воды добавьте еще 1 каплю фенола и встряхните. К вновь полученной эмульсии добавьте 1 каплю 2н раствора NаОН. Моментально образуется прозрачный раствор фенолята натрия, так как он хорошо растворяется в воде.
§10. Задачи для самостоятельного решения.
1. Напишите структурные формулы следующих соединений: 3-метил-2-пентанол; 2-метил-3-бутин-2-ол; 1-фенилпропанол-1. 2. Реакцией Гриньяра получите следующие спирты: 1) 2-метил-3-пентанол; 2) 2,3-диметил-3-пентанол; 3) 2,2-диметил-1-пропанол. 3. Получите гидратацией соответствующих этиленовых углеводородов следующие спирты: а) 2-метилпентанол-2; б) 3,3-диметилбутанол-2. 4. Напишите реакции окисления вторичного бутилового спирта; 2-метилбутанола-1. 5. Подвергните 2-пентанол дегидратации, затем продукт реакции окислите водным раствором перманганата калия. Полученное соединение обработайте уксусной кислотой. Напишите уравнения реакций и назовите все продукты. 6. Получите фенол из бензола и 1-бутена через стадию образования гидроперекиси втор.бутила. 7. Опишите схему следующих превращений:
8. Расположите следующие соединения в порядке убывания кислотных свойств:
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 2897; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.82.108 (0.011 с.) |






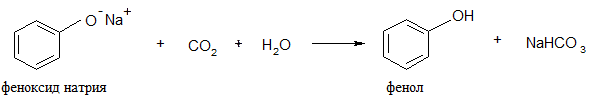











 СН3С(О)ОNа + НОSО3Н NаНSО4 + СН3С(О)ОН
СН3С(О)ОNа + НОSО3Н NаНSО4 + СН3С(О)ОН С2Н5ОН + НОSО3Н Н2О + С2Н5ОSО3Н
С2Н5ОН + НОSО3Н Н2О + С2Н5ОSО3Н СН3С(О)ОН + НОSО3Н Н2SО4 + СН3С(О)О С2Н5
СН3С(О)ОН + НОSО3Н Н2SО4 + СН3С(О)О С2Н5