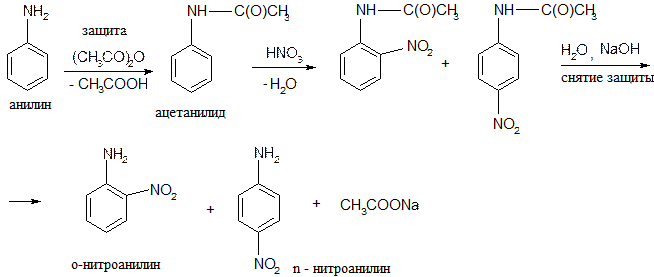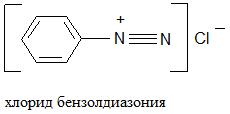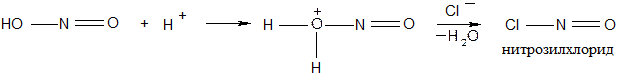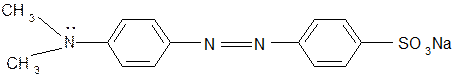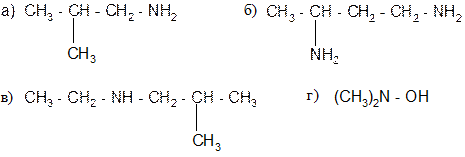Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства ароматических аминовСодержание книги
Поиск на нашем сайте
Реакции электрофильного замещения у ароматических аминов. NH2 – группа – ориентант I рода – направляет новый заместитель в орто- и пара-положения.
1) Нитрование; сопровождается окислением, поэтому для получения нитропроизводных аминогруппу защищают ацилированием
2) Галогенирование 3) Сульфирование
§7. Биороль аминов. Многие амиды используются в качестве лекарственных препаратов:
Амиды сульфаниловой кислоты являются лекарственными веществами с антибактериальной активностью (сульфаниламидные препараты):
Диазосоединения. Классификация. Номенклатура. Строение солей диазония. Диазосоединения содержат азогруппу =N2, связанную с одним органическим радикалом. Например,
Классификация. 1. Алифатические диазосоединения - диазоалканы:
RR'СN2 R, R' = H, Al
CH2N2 – диазометан (CH3)2CN2 – 2-диазопропан
Диазосоединения – вещества от желтого до красного цвета, ядовиты Низшие диазосоединения – взрывоопасные газы Высшие диазосоединения – жидкости и твердые (более устойчивы) Длина связи N – N = 0,113 нм Длина связи С – N = 0,132 нм
Получение диазометана
Диазометан – желто-зеленый газ, взрывоопасен, поэтому в свободном виде его не выделяют, а используют в растворе диэтилового эфира. Сильно раздражает слизистые оболочки глаз и дыхательных путей, действует на ЦНС. Диазометан (и диазоалканы) – высоко реакционноспособные вещества.Используют в качестве метилирующего агента, а также для получения карбоновых кислот, эфиров и других органических соединений.
1. Образование сложного и простого эфиров:
2. Реакция с галогенводородами:
Ароматические диазосоединения
Ar N2 X X – остаток кислоты
Соли диазония (ионная связь):
Диазосоединения (связь ковалентная):
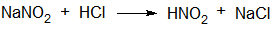
Соли диазония – это кристаллические вещества; в сухом состоянии взрывоопасны; характеризуются низкой термической стабильностью. Получение солей диазония – реакция диазотирования первичных аминов азотистой кислотой:
Азотистая кислота образуется по реакции:
Однако непосредственное участие в реакции диазотирования принимают образующиеся из азотистой кислоты активные электрофильные реагенты. При проведении реакции в соляной кислоте основным электрофильным реагентом является нитрозилхлорид:
Условия реакции диазотирования: 1) сильное охлаждение – 0 – 50С; 2) сильнокислотная среда; кислота необходима для ● выделения азотистой кислоты из нитрита натрия; ● получения нитрозирующего реагента; ● предотвращения образования побочного продукта; ● повышения устойчивости солей диазония.
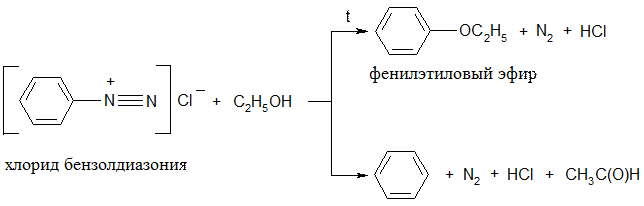
Реакции солей диазония I. Реакции солей диазония с выделением азота 1) Кипячение
2) Замещение на иод
3) Замещение на другие атомы или группы атомов протекает в присутствии катализаторов:
4) Восстановление с помощью спиртов
II. Реакции солей диазония без выделения азота
Реакция азосочетания
Азосоединения – окрашенные вещества, т.к. содержат хромофорную группу - N = N, способствующую поглощению света в видимой области спектра. Ауксохромные группы –ОН и NH2 – группы углубляют цвет и способствуют связыванию красителей с волокнами. Азосоединения используются как индикаторы; метиловый оранжевый (гелиантин, 4-диметиаминоазобензол-4-сульфонат натрия)
Переход окрашенных форм в зависимости от реакции среды определяется равновесием:
Экспериментальная часть
I. Реакция с HNO2 1.Первичные алифатические амины при действии HNO2 выделяют азот: R – NH2 + HNO2 ® ROH + N2 + H2O Ароматические амины превращаются в диазосоединения, которые дают азокрасители: Ar – NH2 + NaNO2 + 2HCI ® ArN2CI + 2H2O ArN2CI + b-C10H7ONa ® ArN = NC10H6OH + NaCI b - нафтол Опыт: растворяют 0,2г сульфаниловой кислоты в 0,5мл 2М NaOH при нагревании и каплю полученного раствора наносят на фильтровальную бумагу. На образовавшееся пятно наносят каплю 10%-ного раствора NaNO2, 1 каплю 1М HCI, а затем каплю раствора b - нафтола в 2М NaOH. Сразу же появляется оранжевое окрашивание. 2.Вторичные амины (алифатические и ароматические) при действии HNO2 образуют нитрозамины: R2 – NH + HONO ® R2N – N = O + H2O 3.Третичные амины (алифатические и чисто ароматические) не реагируют с HNO2. Жирноароматические третичные амины при обработке HNO2 образуют С-нитрозопроизводные: R2N – Ar + NaNO2 + 2HCI ® 2R2N – Ar – N = O Опыт: в пробирку помещают 1 каплю диметиланилина и добавляют 2 капли концентрированной соляной кислоты. Содержимое пробирки охлаждают холодной водой. Затем добавляют 2 капли 30%-ного NaNO2. После прибавления каждой капли пробирку закрывают пробкой и сильно встряхивают, охлаждая при этом водой. Смесь окрашивается в желто-бурый цвет вследствие образования солянокислой соли n-нитрозодиметиланилина. Для выделения свободного n-нитрозодиметиланилина в пробирку постепенно прибавляют по каплям 5%-ный раствор соды до образования зеленой окраски, а затем 2мл эфира и встряхивают. Эфирный слой приобретает изумрудно-зеленую окраску n-нитрозодиметиланилина. II. Реакция с гексацианоферратом (II) калия; характерна для третичных аминов всех типов: 2R3N + K4[Fe(CN)6] + 4HCI ® (R3NH)2H2[Fe(CN)6] + 4KCI Опыт: к 2 каплям пиридина (хинолина, диметиланилина) приливают 2мл воды и взбалтывают. Эту смесь добавляют к 1-2мл концентрированного раствора гексацианоферрата (II) калия. При подкислении соляной кислотой выпадает осадок кислого гексацианоферрата (II) ариламмония. III. Изонитрильная проба (дают только первичные амины). Появление характерного запаха свидетельствует об образовании изонитрила: R – NH2 + CH3CI + 3NaOH ® R - NºC + 3NaCI + 3H2O Опыт. В пробирку поместите 1 каплю анилина, 2-3 капли концентрированного раствора гидроксида натрия, 2 капли хлороформа, 5 капель этанола. Смесь медленно нагревайте над пламенем горелки до начала кипения. Появляется характерный неприятный запах изонитрила. Полученный изонитрил подвергните гидролизу. Для этого в пробирку с изонитрилом прилейте 10 капель 10%-ного раствора серной кислоты и прокипятите до исчезновения запаха.
§12. Задачи для самостоятельного решения 1. Назовите следующие соединения:
2. Напишите формулы промежуточных и конечных продуктов в следующей схеме: HCI KOH HCI NaOH HOH NH3 C2H5OH а) CH3-CH2-CH2-CH=CH2 ¾® A ¾¾® В ¾® С ¾¾® Д ¾® Е ¾® F -¾® Д спирт.р-р спирт р-р HBr KCN H2 H2 б) СH3-CH=C-CH3 ¾® A ¾® В ¾® С ¾® Д CH3 NH3 NaBrO NaNO2+HCI в)CH3-CH2-CH2-COOH ¾® A¾®B¾¾¾®C 3. Расположите соединения в порядке возрастания их основных свойств: этиламин, диметиламин, мочевина, гидроокись тетраметиламмония, этилдиметиламин. 4. Из бромистого изобутила получите изобутилпропиламин. Напишите для последнего реакции с азотистой кислотой и уксусным ангидридом. 5. Какие продукты образуются при взаимодействии нитрита натрия и соляной кислоты а) с амиламином; б) с диметиламином. 6. Используя толуол в качестве исходного основного продукта получите следующие соединения: а) бензиламин; б) бензилдиметиламин; в) n-броманилин. 7. Получите бензилметиламин и напишите для него реакцию с азотистой кислотой.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1918; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.104 (0.005 с.) |