Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическая роль соединений фенолаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Альдегиды. Понятие об альдегидах. Альдегидная группа как функциональная. Формальдегид и его свойства: окисление в соответствующую кислоту,восстановление в соответствующий спирт. Получение альдегидов окислением соответствующих спиртов. Применение формальдегида на основе его свойств.
альдегиды - кетоны
Альдегиды и кетоны (как и спирты) в зависимости от природы радикала делятся на предельные и непредельные жирного ряда и циклические.



Электронное строение альдегидов:
  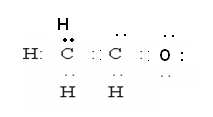
 Между С=С и С=О есть общее, но и имеется существенное различие, связанное с сильной поляризацией группы Между С=С и С=О есть общее, но и имеется существенное различие, связанное с сильной поляризацией группы
спиртах (), так как в образовании связи участвуют электроны π-связи, обладающие повышенной подвижностью. Изомерия альдегидов определяется только изомерией радикала. Первые три - изомеров не имеют, с 4 атомами углерода имеет 2 изомера.
По номенклатуре ИЮПАК к названию углеводорода добавляют окончание – аль. Изомерия кетонов определяется изомерией радикала и положением функциональной группы.
Способы получения Муравьиный альдегид – газ, следующие альдегиды – жидкости или твердые вещества, температура кипения альдегидов возрастает с увеличение молекулярной массы. Кипят они при более низкой температуре, чем соответствующие спирты. Д > 1. Муравьиный и уксусный альдегиды хорошо растворяются воде, последующие хуже. Низшие альдегиды имеют резкий запах, некоторые высшие – приятный (С9- С10 – запах цветов). Физические свойства кетонов в гомологическом ряду изменяются в основном так же, как и у альдегидов, но газообразных кетонов не бывает. Кетоны имеют приятный запах, хорошо смешиваются с водой, растворяются в спирте, эфире.
Высокая поляризация определяет электрофильные свойства углерода карбонильной группы и его способность реагировать с нуклеофильными соединениями, например, присоединять анионы реагирующей молекулы. Кислород карбонильной группы обладает нуклеофильными свойствами. Основными типами химических реакций альдегидов является 1) окисление, 2) присоединение по карбонильной группе, 3) замещение (по карбонильной группе и по радикалу в предельных альдегидах), 4) конденсация и полимеризация. Для кетонов характерны те же реакции, но некоторые из них протекают в иных условиях. Реакции окисления: качественная реакция на альдегидную группу с аммиачным раствором оксида серебра, с соединениями оксида меди. Окисление альдегидов протекает очень легко с образованием кислот, что используется как один из способов их получения:


+ о →; + О →
Окисление альдегидов оксидом серебра в аммиачном растворе: При нагревании оксид серебра окисляет альдегид и сам восстанавливается до чистого серебра:
Восстановленное серебро, покрывая стенки сосуда тонким слоем, образует серебряное зеркало. Окисление альдегидов гидроксидом меди:
+ 2Сu (OH)2 + 2СuOH + Н2O
2СuOHСu2О + Н2O окисд меди(I) Свежеприготовленный голубой осадок гидрооксида меди Сu(OH)2, окисляя альдегид восстанавливается до кирпично-красного осадка оксида меди(I). Эти реакции служат качественными реакциями на альдегиды. Реакции присоединения к альдегидам протекают легко 1. Присоединение водорода (реакция восстановления) с образованием первичных спиртов, а при восстановлении кетонов – вторичных спиртов.


R –C - R + H2 → R – CH - R
2. Взаимодействие альдегидов со спиртами приводит вначале к образованию неполных эфиров, так называемых полуацеталей:
+ НО – R’ → R – C - OR1
альдегид полуацеталь
Полуацетали имеют большое значение для изучения свойств углеводов и определяют ряд химических превращений. При нагревании альдегидов с избытком спирта в присутствии следов минеральных кислот получаются полные простые эфиры – ацетали:
+ R – C - OR’ + Н2O
Ацетали в отличии от простых эфиров при нагревании с разбавленными кислотами гидролизуются с образованием исходных веществ. Бисульфатная реакция
| R – C - СН3 + HОSO2Na→ R – CH - R + SO3Na

Реакции замещения кислорода карбонильной группы: Реакции с гидроксиламином


|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 496; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.105.46 (0.007 с.) |