
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химический элемент, химическое соединениеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ОСНОВЫ ХИМИЧЕСКОГО ЯЗЫКА УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ к семинарским, лабораторным занятиям и самостоятельной работе по общей химии Санкт-Петербург
ББК 24.1 и 73 П 69 УДК 546(076.5) Печатается по решению кафедры неорганической химии РГПУ им. А.И. Герцена
Учебно-методическое пособие включает в себя теоретическое введение, примеры решения задач, упражнения, лабораторные работы и индивидуальные задания для самостоятельной работы по общей химии. Предназначено для студентов естественно-научных факультетов педагогических Вузов.
Составитель – д-р. хим. наук., проф. К.П. Балашев, к. хим. наук., доцент С.В. Васильева
Предисловие В соответствии с государственными образовательными стандартами высшего профессионального образования РФ «химия» входит в программу подготовки специалистов практически всех естественно-научных направлений. Это определяется тем, что химия по своей природе является центральной, фундаментальной наукой, тесно связанной с любым проявлением наших контактов с материальным миром. Трудности, с которыми сталкивается большинство студентов при изучении химии, в значительной степени связаны с особенностями химического языка, включающего не только много специфических и профессиональных терминов, но и химическую символику. Пожалуй, никакая другая наука, кроме математики, не создала столь удобного и емкого способа записи информации. Именно основам химического языка (химической номенклатуре) и посвящено настоящее учебное пособие, состоящее из девятнадцати разделов. Каждый раздел пособия содержит краткое теоретическое введение, примеры решения типовых задач и упражнения для самостоятельной аудиторной и внеаудиторной работы студентов. Для эффективного усвоения материала пособие содержит описание четырех лабораторных работ, а также два набора индивидуальных заданий. В конце пособия приведены справочные материалы, а также ответы к упражнениям.
ОГЛАВЛЕНИЕ Стр. Предисловие.............................................................................................3 Химический элемент, химическое соединение 1. Химический элемент – символы и названия………… ………………5-6 2. Классификация химических элементов ………………………………6-8
3. Классификация химических соединений по составу…………………8-10 4. Принципы химической номенклатуры – химическая формула, химическое название соединения..……………………………………10-11 5. Систематические и традиционные названия простых веществ……...11-12 6. Систематические и специальные названия одноэлементных ионов...12-13 7. Степень окисления элементов в химических соединениях…...……...13-14 8. Систематические и специальные названия бинарных соединений.....14-15 9. Функциональная классификация сложных неорганических соединений.................................................................................................15-16 9.1. Оксиды……………………....………………...………………… ……...16-20 9.2. Гидроксиды – основные (основания), амфотерные, кислотные……...20-25 9.3. Пероксокислоты………………….…………………..…………..………25 9.4. Тиокислоты, политионовые и другие замещенные оксокислоты. ……25-26 9.5. Бескислородные кислоты………………….………………….…………26-27 9.6. Галогенангидриды……………...………………………………...……...27-29 9.7. Соли……………………...………………………………………………..29-36 10. Основные положения координационной теории………………………36-41 10.1. Номенклатура комплексных соединений……………………………....42-45 11. Соединения постоянного и переменного состава (дальтониды и бертолиды)…..…………………………………………………………...45-46 12. Аддукты………..…………………………………………………………46-47 Лабораторная работа № 1 «Основные классы неорганических соединений»...........................................................................................................47 -49 13. Количественные характеристики химических элементов и соединений….............................................................................................49-55 13.1. Определение простейших и молекулярных формул соединений…….55-58 Индивидуальное домашнее задание №1 ………….…...……………………..58-67 Приложение 1. Название химических элементов.……………………………68-73 Приложение 2. Тривиальные названия некоторых веществ, смесей, сплавов.........................................................................................................…….73-74 Приложение 3. Соотношение между внесистемными единицами и единицами международной системы СИ ….............................……....................................74 Приложение 4. Физико-химические постоянные ……………………………75 Приложение 5. Численные приставки...............................................................75
Приложение 6. Ядовитые вещества и меры первой помощи при отравлении.........................................................................................................75-77 Приложение 7 Огнеопасные и взрывчатые вещества......................................77-78
Оксиды.
Pb2O3 (PbO×PbO2), Pb3O4 (2PbO×PbO2), называемые ранее смешанными оксидами, следует рассматривать как свинцовые соли метасвинцовой (H2PbO3) и ортосвинцовой (H4PbO4) кислот.
Систематические названия оксидов и пероксидов образуются в соответствии с общими правилами для названий бинарных соединений. Названия складываются из слова оксид (пероксид) и русского названия элемента в родительном падеже с указанием (для элементов с переменной степенью окисления) римскими цифрами в круглых скобках степени окисления элемента: Na2O - оксид натрия, Fe2O3 - оксид железа (III), H2O2 - пероксид водорода, BaO2 – пероксид бария. Либо в названиях оксидов используются латинские числовые приставки: Na2O - оксид динатрия, Fe2O3 - триоксид дижелеза. Некоторые оксиды и пероксиды имеют тривиальные названия (приложение 2.), используемые в основном в технической литературе. В зависимости от способности оксидов к образованию солей при взаимодействию с кислотами, кислотными оксидами, или основаниями и основными оксидами, они подразделяются на солеобразующие и несолеобразующие (CO, NO, N2O) оксиды. Солеобразующие оксиды подразделяются на основные, амфотерные и кислотные:
Схема 3. Классификация солеобразующих оксидов.
Основные оксиды с преимущественно ионным характером химической связи Э-О образуют прочные ионные кристаллические решетки с высокими температурами кипения и плавления. В результате этого при нормальных условиях они существуют в виде твердых кристаллических веществ. Такие оксиды образуют наименее электроотрицательные элементы периодической системы с относительно низкой степенью окисления – например, катионы щелочных и щелочноземельных металлов, ряд переходных металлов в низких степенях окисления. Для кислотных оксидов с преимущественно ковалентным характером связи Э-О характерны менее прочные молекулярные кристаллические решетки с относительно низкими температурами кипения и плавления. Как следствие этого, типичные кислотные оксиды при нормальных условиях являются газами – CO2, SO2, летучими жидкостями, или лекгоплавкими твердыми веществами – (SO3)3 (tкип. = 44,8 оС, tпл. = 16,8 оС). Кислотные оксиды образуют электроотрицательные химические элементы (неметаллы или переходные металлы с высокой степенью окисления). Амфотерные оксиды характеризуются ионно-ковалентным характером химической связи Э-О и в основном образуют полимерные структуры. При нормальных условиях это твердые вещества. Образованию амфотерных оксидов способствует как промежуточное значение относительной электроотрицательности химического элемента, так и средние значения его степени окисления. Например, увеличение степени окисления хрома: Сr2+®Cr3+®Cr6+ приводит к ослаблению степени ионности и усилению ковалентности связи Cr-O в оксидах и, как следствие этого, к закономерному переходу от основного оксида CrO к амфотерному Cr2O3 и кислотному оксиду CrO3 В соответствии с характером химической связи основные и кислотные оксиды взаимодействуют с водой с образованием соответствующих основных и кислотных гидроксидов – оснований и кислородсодержащих кислот (оксокислот): BaO + H2O = Ba(OH)2 SO3 + H2О = Н2SO4 {SO2(OH)2)} Взаимодействие основных оксидов с кислотами, а кислотных оксидов с основаниями сопровождается образованием соли и воды: BaO + 2HCl = BaCl2 + H2O SO3 + 2NaOH = Na2SO4 + H2O Различный характер химической связи Э-О в кислотных и основных оксидах определяет эффективное взаимодействие их между собой с образование оксосолей: BaO + SO3 = BaSO4 Кислотно-основные свойства амфотерных оксидов выражены значительно слабее. С водой большинство амфотерных оксидов практически не взаимодействуют. Их кислотно-основная двойственность проявляется при взаимодействии с сильными основаниями и кислотами, а также с типично основными и кислотными оксидами:
ZnO + 2HCl = ZnCl2 + 2H2O ZnO + 2NaOH + H2O = Na2[Zn(OH)4] ZnO + 2NaOH (сплав) = Na2ZnO2 + H2O ZnO + SO3 = ZnSO4 ZnO + Na2O (сплав) = Na2ZnO2 Следует отметить, что образование оксосолей на основе амфотерных оксидов происходит только в расплавах. В водных растворах продуктами их взаимодействия с основаниями являются соли, содержащие в качестве аниона гидроксокомплексы.
10. Приведите систематические названия оксидов, распределите оксиды по классам: K2O, BeO, Al2O3, OsO4, CO, CO2, ZnO, N2O, NiO, N2O5, Cr2O3, CrO3, Mn2O7. Какие из данных оксидов будут вступать в реакцию: а) с соляной кислотой, б) с гидроксидом натрия, в) и с соляной кислотой, и с гидроксидом натрия; записать уравнения химических реакций. 11. Указать, какая из приведенных графических формул отвечает оксиду Mn (VII) и почему:
12. Приведите молекулярные и графические формулы оксидов: магния, алюминия, азота (IV), азота (I), фосфора (V), серы (VI), хлора (VII), марганца (VII), хрома (III). Приведите реакции гидратации (взаимодействия с водой) этих оксидов. 13. Напишите реакции, демонстрирующие кислотный характер следующих оксидов: CrO3, TeO3, Сl2O3, NO2, SeO2. 14. Приведите графические формулы, отражающие молекулярный состав оксидов фосфора(III) P4O6 и фосфора(V) P4O10. 15. На основании структурных формул объясните, какие из приведенных бинарных кислородных соединений относятся к оксидам:
16. Приведите реакции, демонстрирующих кислотно-основные свойства оксидов: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7, CrO, Cr2O3, CrO3.
Пероксокислоты.
При записи формул пероксокислот рекомендуется пероксидную группу заключать в круглые скобки и записывать в правой части формулы. Традиционные названия пероксокислот образуются из названия соответствущей оксокислоты с добавлением приставки пероксо-. При наличии в составе пероксокислоты нескольких пероксидных группировок их количество указывается численной приставкой: ди-, три-, тетра- и т.д. Например: HNO2(O2) пероксоазотная кислота, H3PO2(O2)2 дипероксофосфорная кислота.
9. Приведите традиционные названия и графические формулы следующих пероксокислот: H3PO2(O2), H4P2O6(O2), H3BO2(O2).
9.4. Тиокислоты, политионовые и другие замещенные оксокислоты*- раздел для углубленного изучения.
Оксокислоты, в которых часть или все атомы кислорода замещены на атомы серы, называют тиокислотами. При записи формул тиокислот рекомендуется серу помещать на последнее место справа - H3PO3S, H3PO2S2, H3POS4, H3PS4:
Традиционные названия тиокислот образуются из названия соответствующей оксокислоты с добавлением приставки тио-;при замещении двух и более атомов кислорода на атомы серы их количество указывается численными приставками: ди-, три-, тетра- и т.д.
Оксокислоты общей формулы H2(O3S-Sn-SO3) (n = 0¸4) называют политионовыми. Характерной особенностью их строения (за исключение H2S2O6) является наличие мостиковых атомов серы, объединяющих две структурные {SO3}-группировки:
В дитионовой кислоте две структурные группировки объединениы непосредственно атомами серы-кислотообразователями H2(O3S-SO3). Традиционные названия политионовых кислот состояи из чмсловой приставки, указывающей общее количество атомов серы в составе и группового окончания –тионовая кислота.
Кислотные гидроксиды, в которых часть гидроксидных группировок или атомов кислорода замещена на другие атомы галогенов или -NH2, =NH группировки, называют замещенными кислотами. Традиционные названия таких кислот образуются от названия соответствующей оксокислоты с добавлением приставки, составленной из названия замещающих атомов галогенов или групп (NH2 – амид, NH – имид) и соединительной гласной –о. В формулах таких кислот замещающие атомы или группы помещают на последнее место.
По традиции, замещенные серные кислоты называют сульфоновыми кислотами: HSO3F - фторсульфоновая, HSO3Cl - хлорсульфоновая, HSO3(NH2) – амидосульфоновая, H2S2O4(NH) - имидодисульфоновая кислота.
10. Приведите традиционные названия замещенных оксокислот: HSeO3F, HAsO2Cl2, H2CS3, H3POS3, H2AsO3(NH2). 11. Приведите молекулярные и графические формулы кислот: тиосерная, тритионовая, дитиосурьмяная, амидосульфоновая, диброммышьяковая, амидоугольная.
Бескислородные кислоты.
Систематическое название бескислородных кислот образуется из русского названия элемента или специального названия псевдогалогенидной группировки с добавлением соединительной гласной –о и словосочетания водородная кислота: HF - фтор оводородная кислота, H2Te - теллур оводородная кислота, HCN - циан оводородная кислота, HNCS - тиоцианат оводородная кислота, HN3 - азид оводородная кислота (или азотист оводородная кислота). Исторически для водных растворов ряда бескислородных кислот в химической практике применяют и тривиальные названия (см. приложение 2): HF - плавиковая кислота, HCl - соляная кислота, HCN - синильная кислота, H2S - сероводородная вода.
Упражнение: 12. Приведите систематические и тривиальные названия бескислород-ных кислот: HCl, HCN, HBr, HNCS, HI, H2S, HF, H2Se. 13. Приведите формулы следующих кислот: синильная, бромоводородная, плавиковая, азидоводородная, сероводородная, родановодородная, иодоводородная, циановодородная, тиоционатоводородная кислота.
Галогенангидриды.
Некоторые галогенангидриды могут быть рассмотрены как производные неустойчивых оксокислот – например, CCl4 и PCl5 формально являются хлорангидридами полностью гидратированных кислотных гидроксидов углерода (IV) H4CO4 и фосфора (V) H5PO5, в которых число гидроксидных групп совпадает со степенью окисления элемента-кислотообразователя. Галогенангидриды могут содержать либо атомы только одного галогена, либо атомы разных галогенов: POCl3, POBrCl2, POIBrCl. В химической практике для галогенангидридов используют несколько методов построения их названий: - по правилам систематической номенклатуры для сложных соединений с использованием латинских числовых приставок указывающих количество электроотрицательных галогенидных и оксидных ионов галогенангидрида: PCl3 - трихлорид фосфора, PCl5 - пентахлорид фосфора, POCl3 - трихлорид-оксид фосфора, POBrCl2 - дихлорид-бромид-оксид фосфора; - по правилам систематической номенклатуры для бинарных соединений с указанием по методу Штока римскими цифрами в круглых скобках степени окисления элемента: PCl3 - хлорид фосфора (III), PCl5 - хлорид фосфора (V); - традиционные названия образуют с помощью числовых приставок, указывающих количество атомов галогенов, русского названия галогенов, окончания – ангидрид и названия килоты в родительном падеже: PCl3 - трихлорангидрид фосфористой кислоты, POCl3 - трихлорангидрид фосфорной кислоты, POBrCl2 - дихлорбромангидрид фосфорной кислоты; - для галогеннгидридов серной и сернистой кислоты допускается ограниченное использование специальных названий, в которых применяются специальные названия катионов: SO22+ - сульфурил и SO2+ - тионил: SO2Cl2 - сульфурилхлорид, SO2FCl - сульфурилхлоридфторид, SOBr2 - тионилбромид, SOF2 - тионилфторид. Характерным химическим свойством галогенангидридов является их эффективное взаимодействие с водой с образованием галогеноводородной и оксокислоты: PCl5 + 3H2O = H3PO4 + 5HCl POBrCl2 + 3H2O = H3PO4 + 2HCl + HBr
14. Приведите систематические и традиционные названия галогенангидридов и напишите реакции их взаимодействия с водой: SbOCl, SeO2F2, NOBr, NO2F2, NF3, AsOCl2F, CO2Cl2, SOCl2, SO2Br2. 15. Приведите молекулярные и графические формулы галогенангидридов: хлорид-оксид бора, бромид кремния(IV), дифторид-оксид кремния, сульфурилфторид, дихлорангидрид селенистой кислоты, сульфурилбромид, тионилхлорид, хлоробромойодоангидрид ортофосфорной кислоты, дихлоробромоангидрид ортомышьяковой кислоты, тионилфторид.
Соли.
Таблица 1.5. Кислотно-основные реакции солеобразования.
В составе солей можно выделить катионную и анионную составляющие, являющиеся производными исходных основных и кислотных соединений и имеющих преимущественно ионный характер химической связи. Вследствие этого в расплавах и растворах соли подвергаются процессу электролитической диссоциации, приводящей к образованию катионов и анионов. В зависимости от состава соли классифицируются по природе катионов и анионов: - соли со сложными катионами на основе двух разных ионов металла или иона аммония и металла ({(KAl)[SO4]2, {(NH4)2Fe}[SO4]2) называются двойными солями, а соли со сложными анионами (Ca[(ClO)Cl], Fe[(SO4)NO3]) – смешанными солями:
- в зависимости от того, анионы каких кислот входят в состав соли, выделяют: соли оксокислот и бескислородных кислот (Na2SO4 и Na2S), а также соли различных замещенных оксокислот (Na2S2O8, Na2SO3S, NaSO3Cl и т.д.):
- cоли, в состав катионов которых входят гидроксидные группировки (Al(OH)[SO4], {Al(OH)}2[SO4], Al(OH)2Cl) и способные проявлять основные свойства за счет образования OH--ионов в результате процесса электролитической диссоциации катиона – например: Al(OH)SO4®Al(OH)2+ + SO42- Al(OH)2+ Û Al3+ + OH- называются основными. Такие соли могут быть рассмотрены как продукты частичного замещения гидроксидных групп в основных гидроксидах на группировки, являющиеся кислотными остатками соответствующих оксо- или бескислородных кислот:
- соли, анионы которых содержат атомы водорода ((NH4)[HSO4], NaHS) и способны проявлять кислотные свойства за счет образования ионов гидроксония при электролитической диссоциации аниона – например: NaHS® Na+ + HS-, HS- Û H+ + S2- называются кислыми. Такие соли могут быть рассмотрены как продукты частичного замещения водорода в кислотах на катионы металла или аммония:
- соли, являющиеся продуктами полного замещения гидроксидных групп на кислотные остатки или атомов водорода на катионы металла (аммония), называются средними или нормальными. Некоторые соли при кристаллизации из водных растворов образуют кристаллические решетки, содержащие молекулы воды – например: CuSO4×5H2O, Na2SO4×10H2O. Такие соли называются кристаллогидратами. Как видно из табл. 1.5, кислые и основные соли образуются в результате реакций нейтрализации при различных соотношениях многосновных кислот и многокислотных оснований и легко переходят как друг в друга, так и в средние соли: Al(H2PO4)3 + Al(OH)3 = Al2(HPO4)3 + 3H2O Al2(HPO4)3 + Al(OH)3 = 3AlPO4 + 3H2O 2AlPO4 + Al(OH)3 = (AlOH)3(PO4)2 (AlOH)3(PO4)2 + 3Al(OH)3 = 2{Al(OH)2}3PO4
{Al(OH)2}3PO4 + H3PO4 = (AlOH)3(PO4)2 + 3H2O (AlOH)3(PO4)2 + H3PO4 = 3AlPO4 + 3H2O 2AlPO4 + H3PO4 = Al2(HPO4)3 Al2(HPO4)3 + H3PO4 = 2Al(H2PO4)3 Систематические названия средних солей бескислородных солей образуют по общим правилам для бинарных соединений: Na2S - сульф ид натрия, FeCl3 - хлор ид железа (III) (трихлорид железа), Cu(CN)2 - циан ид меди (II), AgCNS - тиоцианат серебра. Систематические названия солей оксокислот и их производных образуются по правилам номенклатуры для комплексных соединений, которые будут рассмотрены далее. В то же время, как и для кислот, в химической практике для наиболее распространенных солей оксокислот широко используют традиционные названия. Традиционные названия солей состоят из названий анионов и катионов. Название анионов средних солей распространенных оксокислот строится из корней русских или латинских (Табл. 1.) названий кислотообразующих элементов с соответствующими окончаниями и приставками в зависимости от их степени окисления (Табл. 6, 7) и через дефис групповым словом –ион. Для р-элементов III-VI группы в высшей степени окисления в названии анионов используют окончание –ат, в более низкой степени (N-2) – суффикс –ит и для N+ и P+ - пристаку гипо- и окончание –ит. Для галогенов в степени окисления +7 в названии анионов используют приставку пер- и окончание –ат; для степеней окисления: +5 – окончание - ат, +3 – окончание –ит и для наиболее низкой +1 – приставку гипо- и окончание –ит. Различные приставки: мета-, орто-, ди-, три- и т.д., используемые в названии оксокислот для указания их формы, сохраняются и в названиях анионов. Для оксоанионов образованных d-элементами в основном используются систематические названия и только для ограниченного круга анионов (Табл. I-5.) в химической практике применяют традиционные названия. В целом, традиционное название средних солей оксокислот строится из названия аниона (групповое слово –ион опускается) и русского названия катиона в родительном падеже с указанием римскими цифрами в круглых скобках его степени окисления (если она может быть переменной): Fe2(S2O7) - дисульфат железа (III), Na3PO4 - ортофосфат натрия, Ba5(IO6) - ортопериодат бария, NiSeO3 - селенит никеля (II), NaPH2O2 - гипофосфит натрия, KMnO4 - перманганат калия.
Таблица 6. Традиционные названия оксоанионов p-элементов III-VI групп.
Таблица 7. Традиционные названия оксоанионов p-элементов VII группы.
Таблица 8. Традиционные названия оксоанионов d-элементов.
|
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 697; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.10.108 (0.015 с.) |

 Оксидами называются бинарные соединения элементов с кислородом в степени окисления –2. Характерной особенностью строения оксидов является наличие в них только одного типа химической связи: элемент-кислород. В соответствии с формальными степенями окисления элемента (Эя+, z = 1-8) и кислорода О2- возможно образование оксидов с простейшими формулами: Э2О, ЭО, Э2О3, ЭО2, Э2О5. ЭО3, Э2О7, ЭО4. Истинные молекулярные формулы оксидов соответствуют целому числу структурных единиц, определяемых простейшей формулой. Например, молекулярная формула оксида фосфора (V) P4O10 соответствует его удвоенной простейшей формуле P2O5. В графических формулах оксидов число химических связей, образуемых каждым атомом химического элемента, принимается равным его формальной степени окисления. Каждый атом кислорода может образовывать две химические связи либо непосредственно с одним атомом элемента, либо, выступая в качестве «мостикового атома», по одной связи с двумя атомами элемента. Важно отметить, что в оксиды характеризуются наличием не более одного мостикового атома кислорода между двумя атомами химических элементов. Это показывает, что бинарные соединения с кислородом, характеризующиеся наличием двух и более мостиковых атомов кислорода, к оксидам не относятся. Например, как видно из графических формул:
Оксидами называются бинарные соединения элементов с кислородом в степени окисления –2. Характерной особенностью строения оксидов является наличие в них только одного типа химической связи: элемент-кислород. В соответствии с формальными степенями окисления элемента (Эя+, z = 1-8) и кислорода О2- возможно образование оксидов с простейшими формулами: Э2О, ЭО, Э2О3, ЭО2, Э2О5. ЭО3, Э2О7, ЭО4. Истинные молекулярные формулы оксидов соответствуют целому числу структурных единиц, определяемых простейшей формулой. Например, молекулярная формула оксида фосфора (V) P4O10 соответствует его удвоенной простейшей формуле P2O5. В графических формулах оксидов число химических связей, образуемых каждым атомом химического элемента, принимается равным его формальной степени окисления. Каждый атом кислорода может образовывать две химические связи либо непосредственно с одним атомом элемента, либо, выступая в качестве «мостикового атома», по одной связи с двумя атомами элемента. Важно отметить, что в оксиды характеризуются наличием не более одного мостикового атома кислорода между двумя атомами химических элементов. Это показывает, что бинарные соединения с кислородом, характеризующиеся наличием двух и более мостиковых атомов кислорода, к оксидам не относятся. Например, как видно из графических формул:
 Характерной особенностью строения пероксидов является наличие в их структурах кислородной группировки из O22- с непосредственной химической связью между двумя атомами кислорода {-O-O-} – например, Na2O2, BaO2. В связи с этим, несмотря на формальное подобие молекулярных формул ЭО2, BaO2 относится к пероксидам, а PbO2 – к оксидам.
Характерной особенностью строения пероксидов является наличие в их структурах кислородной группировки из O22- с непосредственной химической связью между двумя атомами кислорода {-O-O-} – например, Na2O2, BaO2. В связи с этим, несмотря на формальное подобие молекулярных формул ЭО2, BaO2 относится к пероксидам, а PbO2 – к оксидам.


 :
:




 Упражнения:
Упражнения:

 Кислотные гидроксиды, содержащие пероксидную группу –О-О- получили групповое название пероксокислоты. Пероксидная группа в составе пероксокислот может замещать как атом кислорода в гидроксидной группировке, так и мостиковый кислородный атом, объединяющий атомы элемента кислотообразователя в полиядерных кислотных гидроксидах:
Кислотные гидроксиды, содержащие пероксидную группу –О-О- получили групповое название пероксокислоты. Пероксидная группа в составе пероксокислот может замещать как атом кислорода в гидроксидной группировке, так и мостиковый кислородный атом, объединяющий атомы элемента кислотообразователя в полиядерных кислотных гидроксидах:
 Упражнение:
Упражнение:

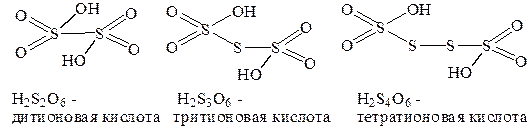

 Водные растворы водородных соединений халькогенов (H2S, H2Se, H2Te) и галогенов (HF, HCl, HBr, HI), а также псевдогалогенов (HCN, HNCS, HCNO, HN3), в которых роль электроотрицательных составляющих (анионов) играют группы атомов, обладающих галогенидоподобными свойствами, проявляют кислотные свойства и диссоциируют с образованием ионов гидроксония. Они образуют семейство бескислородных кислот.
Водные растворы водородных соединений халькогенов (H2S, H2Se, H2Te) и галогенов (HF, HCl, HBr, HI), а также псевдогалогенов (HCN, HNCS, HCNO, HN3), в которых роль электроотрицательных составляющих (анионов) играют группы атомов, обладающих галогенидоподобными свойствами, проявляют кислотные свойства и диссоциируют с образованием ионов гидроксония. Они образуют семейство бескислородных кислот.

 Упражнения:
Упражнения: Соли являются одним из наиболее емких по числу химических соединений классов неорганических соединений. Они образуются в результате самых разнообразных химических процессов и, в частности, являются продуктами кислотно-основных реакций взаимодействия основных и кислотных бинарных ЭnXm и полиэлементных химических соединений, характеризующихся соответственно преимущественно ионным и ковалентным характером химической связи Э-Х (табл. 1.5).
Соли являются одним из наиболее емких по числу химических соединений классов неорганических соединений. Они образуются в результате самых разнообразных химических процессов и, в частности, являются продуктами кислотно-основных реакций взаимодействия основных и кислотных бинарных ЭnXm и полиэлементных химических соединений, характеризующихся соответственно преимущественно ионным и ковалентным характером химической связи Э-Х (табл. 1.5).






