
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные положения координационной теории.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Совокупность центрального атома (иона) комплексообразователя и лигандов составляет внутреннюю координационную сферу комплекса, которая и представляет собой собственно комплексную (координационную) частицу, существующую при определенных условиях как единое целое. В зависимости от соотношения зарядов координационного центра и лигандов комплексная частица может быть как нейтральной, так и положительно или отрицательно заряженной. Компенсация избыточного отрицательного или положительного заряда комплексной частицы происходит в результате ее электростатического взаимодействия с противоположно заряженными с катионами или анионами, которые образуют внешнюю сферу комплекса. Внутреннюю сферу комплекса при записи химической формулы, как правило, отделяют от внешней квадратными скобками: K4[Fe(CN)6], [Co(NH3)5Cl]Cl2, Na2[SO4], [NH4]Cl. Следует отметить, что в формулах часто встречающихся солей, кислот квадратные скобки часто опускаются. Однако с точки зрения координационной теории в этих соединениях также можно выделить внутрисферную и внешнесферную составляющие. Например, в сульфате натрия внутреннюю сферу образуют атом серы (гипотетический ион S6+) и непосредственно координированные к нему четыре эквивалентных атома кислорода (оксидных O2—иона), каждый из которых образует по одной s-связи с серой и участвует в образовании двух делокализованных по всей внутренней сфере p-связей. Суммарный отрицательный заряд комплекса [SO4]2- компенсируется двумя катионами Na+, связанными с комплексным сульфат-ионом преимущественно ионной связью.
K4[Fe(CN)6] ® [Fe(CN)6]4- + 4K+ [Fe(CN)6]4- Û Fe2+ + 6CN- Это служит одним из экспериментальных приемов установления состава внутренней и внешней сферы комплексных соединений. Например, при проведении реакции взаимодействия комплекса [Co(NH3)5Cl]Cl2 с нитратом серебра в результате обменной реакции: [Co(NH3)5Cl]Cl2 + 2AgNO3 = 2AgCl¯ + [Co(NH3)5Cl]NO3 осаждается только два хлоридных иона, что указывает на присутствие третьего иона хлора в составе внутренней сферы комплекса.
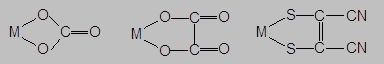
В результате этого каждая молекула этилендиамина занимает два координационных места во внутренней сфере комплекса. Такие лиганды, занимающие в координационной сфере центрального атома (иона) несколько координационных мест, называются полидентатными (би-, три-, тетра-, пента-, гексадентатными) лигандами. Нарядус органическими диаминами, бидентатными лигандами могут выступать и другие соединения с двумя донорными атомами:
В настоящее время известны комплексы с разнообразными полидентатными лигандами, некоторые из которых представлены в табл. I-7. Полидентатные лиганды, строение которых приводит к образованию циклов при их комплексообразовании, называются хелатными [**] лигандами, а соответствующие комплексы на их основе хелатными комплексами.
Таблица 9. Полидентатные хелатные лиганды.
Полидентатные лиганды своими разными донорными атомами часто образуют с координационным металлическим центром два типа связей – донорно-акцепторные и ковалентные. Это характерно, в частности, для аминокислот и других органических соединений, содержащих одновременно атом азота и гидроксидную группу. В этом случае бидентатный лиганд образует с центральным атомом одну ковалентную связь за счет неспаренного электрона атома кислорода, остающегося после отщепления атома водорода от гидроксидной группы, а другую донорно-акцепторную связь за счет неподеленной электронной пары атома азота. Примером такого взаимодействия может служить комплекс никеля (II) c двумя молекулами диметилглиоксима, в каждой из которых происходит отщепление атома водорода только от одной гидроксидной группы. Такого рода комплексные соединения называются внутрикомплексными. Они обладают высокой устойчивостью и часто характерной яркой окраской – например, NiDMG имеет ярко-красную окраску, что определяет широкое использование внутрикомплексных соединений в аналитической практике для определения многих металлов.
В зависимости от заряда комплексы подразделяются на катионные ([Co(NH3)6]3+, [Сu(H2O)4]2+), нейтральные (Ni(CO)4, [Pt(NH3)2Cl2]), анионные ([FeCl6]3-, [Hg(CN)4]2-) и катионно-анионные ([Cr(NH3)6][Cr(CN)6], [CuEn2][Ag(CN)2]2), тогда как по природе лигандов – на смешанно-лигандные комплексы ([Cu(NH3)(H2O)Cl(NO2]) и комплексы с однородным лигандным окружением центрального атома. Среди наиболее часто встречающихся в химической практике комплексов с однородным лигандным окружением можно выделить: - аммиачные и аминные, содержащие во внутренней сфере молекулы аммиака и органических аминов: [Cu(NH3)4](NO3)2, [Ni(En)2]Br2; - аква-, гидроксо- и оксокомплексы, в качестве лигандов у которых выступают молекулы воды и продукты их кислотной диссоциации – гидроксидные ОН- и оксидные О2--ионы: [Zn(H2O)4]2+ Û [Zn(OH)4]2- + 4H+ [Zn(OH)4]2- Û [ZnO2]2- + 2H2O; -ацидокомплексы, содержащие во внутренней сфере разнообразные кислотные остатки: [NiCl4]2-, [HgBr4]2-, [TiF6]2-, [Co(NO2)6]3-, [Pd(CN)4]2-, [Fe(NCS)6]2-. Изомерия в комплексных соединениях. Сложное многокомпонентное строение комплексных соединений приводит к существованию различных изомерных соединений с одинаковой простейшей эмпирической формулой, но разным строением и свойствами. Среди характерных для комплексов типов изомерии можно отметить: - координационную изомерию - различное распределение лигандов между двумя комплексообразователями в катионно-анионных комплексах: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6]; - координационную полимерию – комплексные соединения одного эмпирического состава, но разной молекулярной массы: [Pt(NH3)4][PtCl4] и [Pt(NH3)4][Pt(NH3)Cl3]2; - ионизационную изомерию (ионизационную метамерию) – комплексы с различным распределением лигандов между внутренней и внешней сферой: [Co(NH3)5SO4]Cl и [Co(NH3)5Cl]SO4; - гидратную изомерию, которая является частным случаем ионизационной изомерии и связана с различным распределением молекул воды между внутренней и внешней сферой: [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2×H2O, [Cr(H2O)4Cl2]Cl×2H2O, [Cr(H2O)3Cl3]×3H2O;
- связевую изомерию – координация амбидентатных лигандов к координационному центру различными донорными атомами: Na2[Pt(NO2)6] и Na2[Pt(NO2)5(ONO)]; - изомерию лигандов (конформационную изомерию) – наличие в составе комплексов изомеров многоатомных лигандов. Например, органический диамин общей формулы C3H6(NH2)2 может существовать в виде 1,2-диаминопропана (pn) и 1,3-диаминопропана (tn). Это приводит к образованию на их основе изомерных комплексов: [Cu(pn)2]Cl2 и [Cu(tn)2]Cl2; - геометрическую изомерию – различное пространственное расположение лигандов во внутренней сфере комплексов. Наиболее часто встречающимся типом этой изомерии является цис-транс изомерия в комплексах с октаэдрическим и плоскоквадратным строением:
- оптическую изомерию – существование комплексов в двух зеркально-симметричных пространственных формах, называемых энантиомерами, которые обладают различной оптической активностью – вращают плоскость поляризации света в противоположных направлениях:
32. Определите координационный центр, его заряд и координационное число, а также лиганды и их заряд в следующих соединениях: SF6, SO2Cl2, [SO4]2-, [CrO4]2-, [ZnO2]2-, [Mn(H2O)6]2+, [NiCl4]2- Ni(CO)4, [Ni(CN)4]2-, [Co(NH3)6]3+, [Al(OH)6]3-. 33. Чем отличается характер химической связи во внутренней и внешней сфере координационного соединения? Определите внутреннюю и внешнюю сферу и их заряды в следующих соединениях: Na2SO4, K2Cr2O7, Ba2[Fe(CN)6], Rb[B(OH)4], H3PO4, [UO2]Cl2, [Co(NH3)5Cl]Cl2, NH4NO3, [Cr(H2O)6][Cr(CN)6]. 34. Что такое дентатность лиганда? Определите дентатность лигандов в следующих комплексных соединениях кобальта (III): Na[Co(NH3)4(CO3)2], [Co(NH3)4CO3]ClO4, Na[CoEn2(CO3)2], Na[Co(ЭДТА)], Na[Co(ЭДТА)Сl2]. 35. Какие комплексы называются: моноядерными, полиядерными, хелатными, внутрикомплексными? Приведите примеры. 36. 37. К какому типу комплексов (моно- или полиядерных; катионных, анионных, нейтральных или катионно-анионных; смешанно-лигандных или аква-, гидроксо-, оксо-, ацидокомплексов, аммиакатов, аминатов) относятся следующие соединения: NaPF6, SO3, Na2S2O7, H2CrO4, UO2(NO3)2, K4[Fe(CN)6], (K2[ZnO2], Ba[Al(OH)4]2, NH4Cl, [Mn(H2O)6]SO4, [Cr(H2O)3Cl3], Li2[NiCl4], Ni(CO)4, Na2[Ni(CN)4], [Co(NH3)4CO3]2(SO4), [Pt(NH3)4][PdCl4]. 38. Приведите по 2 примера различных типов изомерных комплексов: геометрических, связевых, гидратных, ионизационных, координационных.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 862; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.69.58 (0.008 с.) |

 Основы теории координационных соединений были заложены в 1893 г. А. Вернером[†]. В состав комплексного соединения входит координационный центр – центральный атом или ион, называемый комплексообразователем, и непосредственно взаимодействующие с ним (координирующиеся вокруг него) другие структурные элементы (атомы, ионы, молекулы) – лиганды [‡]. Одно из наиболее общих определений[§] гласит - «координационными называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома (акцептора электронов), окруженного лигандами (донорами электронов)”.
Основы теории координационных соединений были заложены в 1893 г. А. Вернером[†]. В состав комплексного соединения входит координационный центр – центральный атом или ион, называемый комплексообразователем, и непосредственно взаимодействующие с ним (координирующиеся вокруг него) другие структурные элементы (атомы, ионы, молекулы) – лиганды [‡]. Одно из наиболее общих определений[§] гласит - «координационными называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома (акцептора электронов), окруженного лигандами (донорами электронов)”. Принципиальным отличием внутрисферных лигандов и внешнесферных частиц комплекса является с одной стороны отсутствие непосредственного взаимодействия внешнесферных частиц с координационным центром, а с другой – различный характер химической связи: преимущественно ионный между внешнесферными частицами и комплексной частицей и ионно-ковалентный (донорно-акцепторный) характер взаимодействия между лигандами и координационным центром во внутренней сфере комплекса. Это приводит к различной эффективности процессов электролитической диссоциации комплексных соединений в водных растворах. Диссоциация комплексных соединений на внутреннюю и внешнюю сферу, называемая первичной диссоциацией, протекает практически нацело по типу сильных электролитов, а вторичная диссоциация – образование в объеме раствора гидратированных компонентов внутренней сферы комплекса по типу слабых электролитов:
Принципиальным отличием внутрисферных лигандов и внешнесферных частиц комплекса является с одной стороны отсутствие непосредственного взаимодействия внешнесферных частиц с координационным центром, а с другой – различный характер химической связи: преимущественно ионный между внешнесферными частицами и комплексной частицей и ионно-ковалентный (донорно-акцепторный) характер взаимодействия между лигандами и координационным центром во внутренней сфере комплекса. Это приводит к различной эффективности процессов электролитической диссоциации комплексных соединений в водных растворах. Диссоциация комплексных соединений на внутреннюю и внешнюю сферу, называемая первичной диссоциацией, протекает практически нацело по типу сильных электролитов, а вторичная диссоциация – образование в объеме раствора гидратированных компонентов внутренней сферы комплекса по типу слабых электролитов: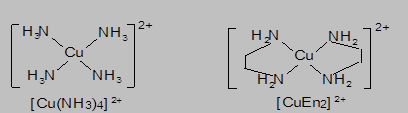 Количественный состав внутренней сферы комплекса определяется величиной координационного числа центрального атома (иона) – числом координированных лигандов. Так, в K[Ag(CN)2], Na2[CO3], [NH4]Cl, Ni(CO)4, PF5, [Co(H2O)6]Cl3 - координационные числа Ag+, C4+, N3-, Ni, P5+, Co3+ составляют: 2, 3, 4, 5 и 6. Количество связей, которые образует один лиганд с комплексообразователем, называется дентатностью лиганда. Каждый из лигандов в рассмотренных выше комплексах занимает одно координационное место. Такие лиганды называются монодентатными. В тоже время, один лиганд может занимать несколько координационных мест во внутренней сфере комплекса в результате образования нескольких донорно-акцепторных связей с координационным центром. Например, в отличие от молекулы аммиака, способной образовывать только одну донорно-акцепторную связь с участием неподеленной пары азота, этилендиамин NH2-CH2-CH2-NH2 (En) характеризуется наличием двух донорных атомов азота и может образовывать две связи с центральным ионом комплексообразователем:
Количественный состав внутренней сферы комплекса определяется величиной координационного числа центрального атома (иона) – числом координированных лигандов. Так, в K[Ag(CN)2], Na2[CO3], [NH4]Cl, Ni(CO)4, PF5, [Co(H2O)6]Cl3 - координационные числа Ag+, C4+, N3-, Ni, P5+, Co3+ составляют: 2, 3, 4, 5 и 6. Количество связей, которые образует один лиганд с комплексообразователем, называется дентатностью лиганда. Каждый из лигандов в рассмотренных выше комплексах занимает одно координационное место. Такие лиганды называются монодентатными. В тоже время, один лиганд может занимать несколько координационных мест во внутренней сфере комплекса в результате образования нескольких донорно-акцепторных связей с координационным центром. Например, в отличие от молекулы аммиака, способной образовывать только одну донорно-акцепторную связь с участием неподеленной пары азота, этилендиамин NH2-CH2-CH2-NH2 (En) характеризуется наличием двух донорных атомов азота и может образовывать две связи с центральным ионом комплексообразователем:
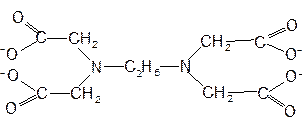
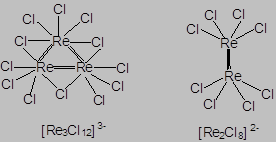
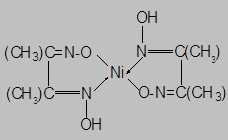 Комплексные соединения, содержа-щие только один координационный центр, называются моноядерными, а несколько – полиядерными комплексами. Наряду с полиядерными комплексами, объединение металлических центров в которых обеспечивается мостиковыми лигандами, существует большой круг полиядерных комплексов, характеризующихся образованием прочных химических связей непосредственно между металлическими центрами. Такие комплексные соединения называются кластерными комплексами.
Комплексные соединения, содержа-щие только один координационный центр, называются моноядерными, а несколько – полиядерными комплексами. Наряду с полиядерными комплексами, объединение металлических центров в которых обеспечивается мостиковыми лигандами, существует большой круг полиядерных комплексов, характеризующихся образованием прочных химических связей непосредственно между металлическими центрами. Такие комплексные соединения называются кластерными комплексами.
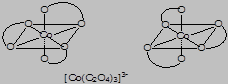
 Упражнения:
Упражнения: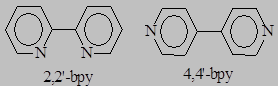 * Какой из гетероциклических дииминов – 2,2’-бипиридил (2,2’-bpy) или 4,4’-бипиридил (4,4’-bpy) может выступать в качестве мостикового лиганда и в качестве хелатирующего лиганда?
* Какой из гетероциклических дииминов – 2,2’-бипиридил (2,2’-bpy) или 4,4’-бипиридил (4,4’-bpy) может выступать в качестве мостикового лиганда и в качестве хелатирующего лиганда?


