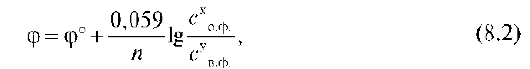Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Координационная теория Вернера.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Теория была создана в 1893г. 1. Комплексные соединения характеризуются наличием центрального иона – комплексообразователя (d – элементы: Fe, Co, Cu, Zn, Mo, Mn; реже p – элементы: Al, Sn, Pb; из s – элементов только Li). 2. Центральный ион окружен лигандами, в качестве них могут быть частицы, имеющие свободную пару электронов (Н2О:,:NH3,:Cl-). Число лигандов определяется координационным числом, которое обычно в два раза больше, чем степень окисления комплексообразователя. 3. Комплексообразователь и лиганд образуют внутреннюю сферу комплекса, заряд которой определяется как алгебраическая сумма зарядов всех комплексообразователей и лигандов. [Co+3(NH3)60]+3Cl3-. 4. В состав внешней сферы входят ионы противоположного знака. Номенклатура. 1. Сначала называют анион, а затем катион. 2. Если лиганд является кислотным остатком, то к его названию добавляют приставки, указывающие на их число, и окончание «о». Затем называют нейтральные лиганды, добавляя приставки, указывающие на их число. 3. Далее называют ион комплексообразователя с указанием степени окисления (на письме обозначается римскими цифрами в круглых скобках). В анионных комплексах к названию комплексообразователя добавляют суффикс «ат». В катионных комплексах даются латинские названия ионам металлов. Например: [Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II); K[Fe(NH3)2(CN)4] – тетрацианодиамминферрат (III) калия; [Co(NH3)6]Cl3 – хлорид гексаамминкобальта (III).
В настоящее время для объяснения химических связей в комплексных соединениях используют метод валентных связей (ВС). Исходя из метода ВС, предполагается, что между лигандом и комплексообразователем возникает донорно-акцепторная связь за счет неподеленной пары электронов лиганда и свободной орбитали центрального иона. Таким образом, лиганд является донором, а комплексообразователь - акцептором. Была установлена связь между строением молекулы и координационным числом. ü Если координационное число равно двум, то это говорит о том, что комплексообразователь предоставляет 2 свободные s и p – гибридные орбитали не поделенным парам лигандов, и комплекс приобретает линейную структуру. кч = 2 s + p = 2q + = 2 ü Если координационное число равно четырем, то это говорит о том, что комплексообразователь предоставляет свободные 1s и 3p – гибридные орбитали не поделенным парам лигандов, и комплекс приобретает тетраэдрическую структуру. кч = 4 s + 3p = 4q ü Если координационное число равно шести, то это говорит о том, что комплексообразователь предоставляет свободные 1s, 3p и 2d – гибридные орбитали не поделенным парам лигандов, и комплекс приобретает октаэдрическую структуру. кч = 6 s + 3p +2d = 6q № 92. Внутрикомплексные соединения и их роль в биологических процессах. Полидентатные лиганды. Строение активного центра биологических комплексов: хлорофилла, гемоглобина, цианкобаламина, каталазы. Токсичность солей тяжелых металлов, взаимодействие их с комплексами биогенных металлов. Внутрикомплексные соединения – это солеобразующие соединения с донорно-акцепторными и ковалентными связями между лигандами и комплексообразователем. Лигандами в этих соединениях могут быть только органические вещества: белки, аминокислоты, гетероциклы. Координационное число определяется аналогично. Внутрикомплексные соединения отличаются высокой прочностью, так как циклические группировки лигандов захватывают центральный ион подобно клешням рака, отсюда появилось еще одно название этих соединений – хелатные (клешневидные). Наиболее важную роль в природе играют те внутрикомплексные соединения, в которых донорные атомы лигандов связаны в единое кольцо. Например: порфириновое кольцо состоит из четырех молекул пиррола, оно входит в состав гемоглобина, витамина В12, фермента каталазы, хлорофилла Очень актуальной на Земле является проблема восстановления кислорода. Восполнение кислорода идет за счет жизнедеятельности фитопланктона и наземных растений. Этот процесс можно представить реакцией, которая идет с участием кванта света и хлорофилла: 6СО2 + 6Н2О → С6Н12О6 + 6О2 Хлорофилл представляет собой порфириновое кольцо, комплексообразователем является Mg+2, координационное число равно четырем. Под действием кванта света ион магния возбуждается и отдает электрон субстрату, но одновременно магний получает электрон от того субстрата, где процесс окисления завершился. Таким образом, возникает круговой поток электронов, при этом выделяется энергия, идущая на синтез АТФ. Гемоглобин представляет собой внутрикомплексное соединение внутри, которого находится порфириновое кольцо, комплексообразователем является Fe+2, координационное число равно шести: четыре вакансии находятся в кольце порфирина, две вакансии направлены перпендикулярно плоскости кольца в противоположные стороны: 5-ая связана с кислородом, 6-ая с атомом азота гистидина (белок). Имеет октаэдрическую форму. Гемоглобин находится в эритроцитах, отвечает за перенос кислорода: Hb + O2 ↔ HbO2. Если во вдыхаемом воздухе будет 0,01% угарного газа или сероводорода, то гемоглобин будет переносить их, а не кислород, что приведет к смерти организма. При отравлении газами необходимо оказать первую помощь: дать подышать кислородом, вынести на свежий воздух. Именно из-за опасения отравлений сероводородом (он тяжелее воздуха) перед спуском в шахты и колодцы делают забор воздуха на его содержание. Каталаза представляет собой внутрикомплексное соединение внутри, которого находится порфириновое кольцо, комплексообразователем является Fe+3, координационное число равно шести: четыре вакансии находятся в кольце порфирина, две вакансии направлены перпендикулярно плоскости кольца в противоположные стороны: 5-ая связана с пероксидом, 6-ая с гидроксид ионом. Каталаза – это фермент, находящийся в крови, отвечает за разрушение продукта метаболизма – перекиси водорода. каталазаFeOH + Н2О2 → каталазаFeOOH + Н2О каталазаFeOOH + Н2О2 → каталазаFeOH + Н2О + O2 2Н2О2 → 2Н2О + O2 Эти же реакции происходят при обработке ран перекисью водорода. Витамин В12 – цианкобаламин представляет собой внутрикомплексное соединение внутри, которого находится порфириновое кольцо, комплексообразователем является Со+3, координационное число равно шести: четыре вакансии находятся в кольце порфирина, две вакансии направлены перпендикулярно плоскости кольца в противоположные стороны: 5-ая связана с цианид ионом, 6-ая с азотом гетероцикла бензимидозола. Витамин В12 участвует в синтезе азлтистых оснований ДНК,метионина, его нехватка вызывает анемию. Витамин В12 не синтезируется в организме, а поступает с продуктами: печень, почки, мозги. Ферменты цитохромы а,b,с представляют собой внутрикомплексные соединения внутри, которых находится порфириновое кольцо, комплексообразователем является Fe+2, Fe+3, координационное число равно шести: четыре вакансии находятся в кольце порфирина, две вакансии направлены перпендикулярно плоскости кольца в противоположные стороны: 5-ая связана с атомом серы белка метионина, 6-ая с атомом азота белка гистидина. Цитохромы участвуют в окислительно-восстановительных процессах, протекающих в организме. Они являются основным звеном в дыхательной цепи. № 93. Антидоты: унитиол, комплексоны, британский антилюизит (БАЛ), тетацин, пенициламин. Хелатотерапия – лечение, основанное на введении в организм антидотов (комплексонов) с целью образования устойчивых хелатных соединений с ионами тяжелых металлов. В качестве антидотов применяют унитиол, БАЛ – британский антилуизин – 1,2-дитиопропанол, трилон А – этилендиаминтетрауксусная кислота (ЭДТА), трилон Б – натриевая соль ЭДТА, тетацин – кальциево-натриевая соль ЭДТА. Каждый антидот действует на определенную группу металлов. Унитиол связывает ионы ртути (II). H2C – SH H2C – S HS – CH2 │ │ Hg │ 2 HC – SH + Hg+2 → HC – SH S – CH + 2H+ │ │ │ H2C – SO3Na H2C – SO3Na NaO3S – CH2
БАЛ связывает ионы свинца (II). H2C – SH H2C – S HS – CH2 │ │ Pb │ 2 HC – SH + Pb+2 → HC – SH S – CH + 2H+ │ │ │ H2C – OH H2C – OH HO – CH2
Трилон А используют при отравлении ионами цинка, кальция, кадмия. НООС – СН2 СН2 - СООН N – CH2 – CH2 –N + Zn+2 → НООС – СН2 СН2 - СООН
НООС – СН2 СН2 - СООН N – CH2 – CH2 –N → СН2 СН2 + 2H+ │ │ О = С – O – Zn – O – С = О
Трилон Б используют при отравлении ионами цинка, кальция, кадмия. NaООС – СН2 СН2 - СООNa N – CH2 – CH2 –N + Cd+2 → НООС – СН2 СН2 - СООН
NaООС – СН2 СН2 - СООNa N – CH2 – CH2 –N → СН2 СН2 + 2H+ │ │ О = С – O – Cd – O – С = О
Тетацин используют при отравлении ионами свинца, кадмия, ртути. NaООС – СН2 СН2 - СООNa N – CH2 – CH2 –N СН2 СН2 + Hg+2 → │ │ О = С – O – Ca – O – С = О
O = C – O – Ca – O – C = O │ │ СН2 СН2 → N – CH2 – CH2 –N + 2Na+ СН2 СН2 │ │ О = С – O – Hg – O – С = О
Хелатотерапия для детей не желательна (побочный эффект – связывание кальция) и имеет ряд побочных эффектов. № 94. Устойчивость комплексных соединений в растворах. Первичная и вторичная диссоциация комплексных соединений. Константа устойчивости и константа нестойкости комплексного иона и их взаимосвязь с устойчивостью комплекса. Внешняя и внутренняя сферы комплексных соединений сильно различаются по устойчивости. Частицы, находящиеся во внешней сфере комплекса легко отщепляются (диссоциируют) – первичная диссоциация. Она протекает полностью, как у сильных электролитов. K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4- Лиганды, находящиеся во внутренней сфере комплекса, прочно связаны с комплексообразователем, отщепляться будут в меньшей степени. Процесс будет идти обратимо. Обратимый распад внутренней сферы – вторичная диссоциация. Она подчиняется закону действующих масс и характеризуется константой равновесия, называемой константой нестойкости комплексного иона - Кн. Чем меньше величина константы нестойкости, тем устойчивее комплекс. [Fe(CN)6]4- ↔ Fe+2 + 6CN- Кн = [Fe+2] ∙ [CN-]6 / [[Fe(CN)6]4-] Существует величина обратная константе нестойкости - константа устойчивости комплексного иона – Куст. Куст = 1 / Кн = [[Fe(CN)6]4-] / [Fe+2] ∙ [CN-]6 Комплексоны используют при лечении различных металл избыточных состояниях: при радиоактивных излучениях (накапливается торий), токсикозах, психических заболеваниях (избыток лития), врожденных ферментопатиях (болезнь Вильсона – Коновалова). № 96. Гетерогенные равновесия и процессы. Константа растворимости. Условия образования и растворения осадков. Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Гетерогенными называют процессы, происходящие в системах, состоящих из нескольких фаз. На границе раздела фаз между осадком и раствором наблюдается процесс. Часть ионов с поверхности осадка, гидротируясь, переходит в раствор. Гидротированные ионы в растворе, сталкиваясь с поверхностью осадка, осаждаются на них. Тогда скорость процесса гидратации становится равной скорости осаждения и наступает химическое равновесие, когда раствор становится насыщенным. Произведение (константа) растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная. Условия образования осадка: 1. Раствор должен стать перенасыщенным; 2. Энергия Гиббса меньше 0; 3. Пс (ионное произведение) > Кс (константа равновесия). Условия растворения осадка: 1. Раствор должен стать ненасыщенным; 2. Энергия Гиббса больше 0; 3. Пс (ионное произведение) < Кс (константа равновесия). № 99. Классификация и сущность методов осадительного титрования. Аргентометрия. Метод осадительного титрования объединяет титриметрические определения, основанные на реакциях образования осадков малорастворимых соединений. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо,, чтобы результат определения не искажался. Наименования отдельных методов осаждения происходят от названий применяемых растворов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Этим методом определяют содержание ионов С1~ и Вг~ в нейтральных или слабощелочных средах. Тиоцианатометрия основана на применении раствора тиоцианата аммония NH4SCN (или калия KSCN) и служит для определения следов С1- и Вг~, но уже в сильнощелочных и кислых растворах. Используют ее и для определения содержания серебра в рудах или сплавах. № 104. Классификация и сущность методов окислительно-восстановительного титрования. Перманганатометрия, иодометрия. Пермангонатометрия основана на реакциях окисления различных веществ перманганатом калия. Окисление проводят в кислой среде, в которой ион MnO4- проявляет наиболее сильные окислительные свойства и имеет наименьший эквивалент (1/5). Иодометрия основана на титрометрической реакции йода с тиосульфатом натрия. Во многих наиболее распространенных реакциях окислительно-восстановительного титрования косвенным участником является иод. Конечная стадия титрования заключается в количественном определении иода при помощи титрования тиосульфатом натрия. В качестве индикатора на иод используют крахмал. Тиосульфат стандартизуют по трииодид-иону (I3–), который получается по реакции между KI и первичным стандартом KIO3. Таким способом определяют, например, степень ненасыщенности жирных кислот, содержание фенола, многоатомных спиртов (глицерина или этиленгликоля). Окислительно-восстановительного титрование подразделяется по веществу титранта на оксидиметрию и редуциометрию. №117. Допишите уравнения, расставьте коэффициенты используя метод электронного или ионно-электронного баланса: 1) Н2О2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 3O2 + K2SO4+4H2O K+7+5e-=K+2 - окислитель 2 2O- -2e=O02 – восстановитель 5 2) 5Na2HAsO3 +2KBrO3 + 2HCl → 5Na2HАsO4 + Br2 +2KCl+H2O As+3-2e- =As+5 - восстановитель 5 2Br+5 -10e- =Br02 - окислитель 1 3) Fe2O3 +3NaNO3 + 4NaOH → 2Na2FeO4 + 3NaNO2+2H2O Fe+3 -3e- =Fe+6 восстановитель 2 N+5 +2e- =N+3 окислитель 3 №118. Используя значения стандартных окислительно-восстановительных потенциалов и учитывая условия направленности процесса, определите, может ли хлор в стандартных условиях окислить: воду до пероксида водорода; бромид ион до брома; ион железа (II) до иона железа (III); ион марганца (II) до перманганат - иона? Cl2 + 2e = 2Cl- +1.358
Мы видим, что самый большой ОВ-потенциал марганца, хлор на 2-м месте, значит, хлор сможет окислять все приведенные вещества кроме марганца, по отношению к которому он будет восстановителем. №119. Смешали 20 мл раствора хлорида железа (III) с концентрацией 0,05 моль/л и 25 мл раствора хлорида железа (II) с концентрацией 0,02 моль/л. Вычислите величину редокс-потенциала этой системы при Т = 2980К.
Fe3+ + e = Fe2+ ф0=+0,771 n=1e- c (хлорида железа 2) =0,02моль/л в.ф с (хлорида железа 3)=0,05моль/л о.ф ф=0,771+0,059/1.lg0,05/0,02=0,771+0,059.0,39=0,794 № 120. Рассчитайте массовую долю аскорбиновой кислоты (М(C6H8O6) = 176,13 г/моль) в процентах, если точную массу ее 0,1235 г растворили в воде и оттитровали раствором йода с молярной концентрацией эквивалента 0,098 моль/л. На титрование затрачено 14,0 мл раствора йода. C 1 V 1 = C 2 V 2 C1V1=0,098моль/л.0,014л=0,00137 C1V1=m/M.Vр-ра.Vр-ра=m/M=0,1235/176,13=0,0007-C1 C=ὠ%×10×ρр-ра/M(x) ὠ=C×M(x)/10× ρр-ра=0,0007×176,13/10×1=0,012% 121. Мидпойнт потенциалы некоторых биологически важных редокс-систем цепи тканевого дыхания при 298 К, рН = 7 имеют значения: φ(Оксалоацетат+2Н+/Малат) = -0,17 В; φ(НАД+/НАДН+Н+/) = -0,32 В; φ(ФАД+2Н+/ФАДН2)=-0,05В; φ(НАДФ+/НАДФН++Н+/)=-0,32В; (Убихинон+2Н+/Убихинол)=+0,04В; φ(Цитохром с-Fe3+/Fe2+) = +0,25 В; φ(Цитохром аа3-Fe3+/Fe2+) = +0,55 В; φ(О2(газ)+4Н+/2Н2О) = +0,82 В. В процессе тканевого дыхания происходит перенос протонов водорода и электронов от окисляемого субстрата на кислород с участием переносчиков, функцию которых выполняют ферменты. Исходя из значений окислительно-восстановительных потенциалов, составьте электронно-транспортную цепь последовательного переноса протонов и электронов от субстрата на акцептор.
№ 122. Классификация химических элементов в организме по В.И. Вернадскому. Роль макро- и микроэлементов в живом организме. Биогенные элементы. Органогенные элементы и их роль в живой клетке. Металлы жизни. Биогенные элементы – элементы, необходимые для построения и жизнедеятельности клетки.- Структурное образование живой клетки включает в себя 6 элементов: С, H, O, N, P, S. Эти неметаллы входят в состав нуклеиновых кислот и аминокислот, они жизненно необходимы, поэтому их называют органогенными. Они входят в состав любой клетки и составляют 97% от количества всех элементов, присутствующих в организме. Среди 24 биогенных элементов особо выделены 10 «металлов жизни»: Na, K, Mg, Ca – макроэлементы (элементы 1 острова, содержание в организме от 1 г до 100 г, s-элементы); Fe, Co, Zn, Cu, Mo, Mn – микроэлементы (элементы 2 острова, содержание в организме от 0,1 г до 0,0001 г, d-элементы). «Металлы жизни» играют большую роль в жизнедеятельности организмов. Они участвуют в построении всех клеток, обеспечивают осмотическое давление, определенный рН среды, элементы второго острова регулируют работу ферментов и гормонов. Вернадский разделил биогенные элементы на группы: 1. Макроэлементы - содержание в организме более 0,01%. 2. Микроэлементы - содержание в организме от 0,01% до 0,00001%. 3. Ультра микроэлементы - содержание в организме менее 0,00001%. Главная функция макроэлементов – это построение тканей, поддержание постоянства осмотического давления и кослотно-основного равновесия. Главная функция микроэлементов – это активация биохимических процессов: размножение, обмен веществ, тканевое дыхание. № 123. Концентрация химических элементов в органах человека. Эндемические заболевания. Внутренние органы по разному концентрируют в себе химические элементы. Большая часть микроэлементов депонируется в костной и мышечной тканях. Некоторые элементы проявляют специфические сродство к отдельным органам или тканям. Йод находится в щитовидной железе, фтор в эмали зубов, молибден - в почках. Выявлено немало заболеваний, связанных с недостатком или избытком в организме биогенных элементов, так, например недостаток фтора приводит к возникновению кариеса зубов, избыток молибдена вызывает эндемическую подагру суставов, недостаток йода – эндемический зоб. Недостаток того или иного элемента чаще обусловлен неправильным питанием. Тем не менее, существуют заболевания, связанные с аномальным содержанием элементов в окружающей среде определённой географической зоны – эндемические заболевания (биогеохимическая провинция – это место, где отмечается частые случаи заболеваний связанных с избытком или недостатком химических элементов). Например, низкое содержание йода зарегистрировано на западе Украины и севере Тюменской области, низкое содержание кобальта – в Ярославской области, высокое содержание молибдена – в Армении. На содержание микроэлементов в организме влияет окружающая среда. Сероводород, оксиды азота (IV и II – валентные), сернистый ангидрид, попадая в организм, нейтрализуют микроэлементы. № 124. Общая характеристика s-элементов. Изменение активности s-элементов в главной подгруппе. Степени окисления, особенности лития и бериллия. Оксиды, надпероксиды, пероксиды щелочных металлов. Биологическая роль s-элементов и применение соединений натрия, калия, кальция, магния и бария в медицине. К S – элементам относятся первые два элемента каждого периода. Всего их 14, они входят в 1 и 2 группу главных подгрупп, только гелий находится в 8 группе. Валентными электронами являются ns1 и ns2. Группа IA: H, Li, Na, K, Rb, Cs, Fr – эти металлы (кроме водорода) называют щелочными, так как растворясь в воде они образуют щёлочь. Особо выделяют литий 1s22s1, который имеет гелевый экран. Энергия ионизации – J – это энергия, необходимая для отрыва одного электрона с внешнего уровня. С увеличением радиуса атома энергия ионизации уменьшается, металлические свойства возрастают, химическая активность возрастает. Радиус атома увеличивается в группах сверху вниз, в периодах справа налево. Все щелочные металлы находятся в степени окисления +1, так как они стремятся завершить свою электронную структуру до 8, то отдают 1 электрон и превращаются в катион. Na 1s22s22p63s1 хранят под слоем керосина, так как легко взрывается. Na+ 1s22s22p63s0 входит в состав поваренной соли, употребляется в пищу, так как инертен. К S – элементам IIA группы относят: Be, Mg, Ca, Sr, Ba, Ra. У бериллия есть гелевый экран. Ca, Sr, Ba, Ra – называют щелочноземельными металлами, а их оксиды – земли. Be – амфотерный металл. У всех элементов на внешнем уровне по 2 не спаренных электрона при возбуждении, поэтому степень окисления равна +2, тип гибридизации – sp. Химические свойства IA группы. 1. Взаимодействие с водородом: 2Ме + Н2 = 2Ме+Н- – гидрид металла. 2. Взаимодействие с галогенами: 2Ме + Hal2 = 2МеHal – галогенид металла. 3. Взаимодействие с кислотами: Ме + Кислота (кроме HNO3) = Соль + H2 Ме + HNO3 (конц.) = МеNO3 + N2O + H2O Ме + HNO3 (разб.) = МеNO3 + NH4NO3 + H2O 4. Взаимодействие с водой: Ме + H2O = Щёлочь + H2 5. Взаимодействие с кислородом: 4Li + O2 = 2Li2O – оксид лития. 2Na + O2 = Na2O2 – пероксид натрия (соль). K + O2 = KO2 – надпероксид калия (соль). 6. Получение оксидов: Na2O2 + 2Na = 2Na2O – оксид натрия. KO2 + 3K = 2K2O – оксид калия. Все соли щелочных металлов хорошо растворимы и подвергаются гидролизу за исключением солей лития. У лития есть один электрон на внешнем уровне и не одного p – электрона поэтому гелевый экран обуславливает его специфические свойства: способен образовывать комплексные соединения. 1. Гидролиз солей: Na2O2 + 2H2O = 2NaOH + H2O2 2KO2 + 2H2O = 2KOH + H2O2 + O2 Соль + H2O = Щёлочь + Кислота
Химические свойства IIA группы. 1. Взаимодействие с кислотами: Ме + Кислота (кроме HNO3) = Соль + H2 Ме + HNO3 (конц.) = МеNO3 + N2O + H2O Ме + HNO3 (разб.) = МеNO3 + NH4NO3 + H2O 2. Взаимодействие с кислородом: 2Ме + O2 = 2МеO – оксид металла. 3. Ве + 2NaOH = Na2BeO2 + H2 ВеО + 2NaOH = Na2BeO2 (берилат натрия) + H2O ВеО + 2NaOH + H2O = Na2[Be(OH)4] – тетрагидроксоберилат (II) натрия BeF2 + 2KF = K2[BeF4] – тетрафтороберилат (II) калия Соединения бериллия имеют сладкий вкус, но очень ядовиты. 4. СаО (негашёная известь) + Н2О = Са(ОН)2 (гашёная известь, известковое молоко) Са(ОН)2 + СО2 = СаСО3 + Н2О 5. ВаCl2 + H2SO4 = BaSO4↓ + 2HCl – качественная реакция на SO42- 2BaO2 (пероксид бария) = 2BaO + O2 так получают кислород на подводных лодках. Биологическая роль S – элементов, применение в медицине. Ионы натрия и калия распределены по всему организму, причём ионы натрия входят в состав межклеточной жидкости, а ионы калия – внутриклеточной. С точки зрения термодинамического равновесия оба этих иона должны бы одинаково располагаться в этих жидкостях, но они переносятся NaK-насосом, который требует энергии, выделяющейся за счёт гидролиза АТФ. В результате гидролиза 1 молекулы АТФ 3 иона натрия выходят из клетки, а 2 иона калия заходят в клетку. Происходит дисбаланс электронных зарядов, который является причиной возникновения разности потенциалов на мембране клетки. Внутри клетки появляется «–» заряд, в то время как снаружи «+» заряд. Ионы Na и K ответственны за поддержание осмотического давления и за сокращение мышц. Na+ необходим для сокращения мышцы, а K+ за расслабление мышцы. Ионы натрия и калия – антагонисты – вещества, обладающие противоположным действием. NaСl 0,9% раствор (физиологический, изотонический) применяют для внутривенного введения при интоксикациях, обезвоживаниях, наружно – для промывания глаз. 5% раствор (гипертонический) применяют для промывания гнойных ран (способствует оттоку гноя). KCl – внутривенно при нарушениях сердечных ритмов (расслабляет сердечную мышцу), отёках. Na2SO4∙10H2O – (английская соль) как слабительное средство NaHCO3 – для нейтрализации ацидоза. Mg+2 – входит в состав хлорофилла, внутрикомплексных соединений. Находится в абрикосах и персиках. Са+2 – находится в костной ткани. Кальций и магний антагонисты. Магний снижает возбудимость нервной системы, находится в основном в клетке, а кальций вне клетки. MgO – (жжёная магнезия) для нейтрализации ацидоза (антацид). MgSO4∙7H2O – (магнезия) как спазмолитическое, желчегонное, успокаивающее, противосудорожное средство. CaCl2∙6H2O – как кровоостанавливающее, противоаллергическое, противоядие при отравлении солями магния. СаО – для нейтрализации ацидоза (антацид). Уровень Са в крови регулируется 2 гормонами: кальцитонином и паратиреоидным. Кальцитонин препятствует освобождению кальция из костей, а паратиреоидный способствует вымыванию кальция из костей. При недостатке магния наблюдается утомляемость, снижение выносливости, депрессия, поэтому на каждые 100 мг ионов кальция в рационе питания должно быть 15 мг ионов магния. Кальций входит в состав зубов, костей, необходим для работы почек, свёртывающей системы крови. Избыток ионов кальция ведёт к ишемии миокарда. Для снятия блокирующего действия больным дают препараты магния (аспаркам, коринфар). При нарушении обмена ионов кальция повышается литогенность желчи (патологическое свойство желчи, ведущее к камнеобразованию), вероятность возникновения катаракты и артритов. № 125. Общая характеристика d-элементов. Изменение химической активности d-элементов в подгруппах в направлении сверху вниз. Закономерности изменения кислотно-основных и окислительно-востановительных свойств d-элементов в зависимости от степени окисления. Характерные степени окисления для d-элементов, встречающихся в организме. d-элементы находятся в 4 – 7 периодах, побочных подгруппах. Валентные электроны расположены на s и d подуровнях. 1. У элементов побочных подгрупп валентные электроны заполняют предвнешний d-подуровень, что ведёт к уменьшению атомного радиуса за счёт d- и f-сжатия, что в свою очередь вызывает увеличение энергии ионизации и снижение химической активности сверху вниз. Золото менее активно, чем медь. 2. Все атомы d-элементов за исключением IIB подгруппы имеют незавершённый d электронный слой. Этим объясняется обширный набор различных степеней окисления (возможно распаривание как s так и d электронов в зависимости от условий реакционной среды). Mn 1s22s22p63s23p64s23d5, валентными являются 2s и 5d электроны, поэтому марганец может проявлять следующие степени окисления: -2, 0, +2, +3, +4, +5, +6,+7. 3. Соединения с высшей степенью окисления, соответствующей номеру группы, проявляют неметаллические свойства, имеют кислотный характер, являются окислителями. В низших степенях окисления проявляют металлические свойства, имеют основной характер, являются восстановителями. В промежуточной степени окисления соединения проявляют амфотерные свойства, могут быть как окислителями, так и восстановителями. Cr+2 Cr+3 Cr+6 Cr2O Cr2O3 CrO3 Cr(OH)2 Cr(OH)3 и H3CrO3 H2CrO4 основные амфотерные кислотные
4. В организме человека d-элементы находятся в меньшей положительной степени окисления: Cr+3, Mn+2, Fe+2, Zn+2. В высших степенях окисления эти же элементы очень токсичны для организма: Cr+6, Mn+7, Fe+6 (используют в современных средствах для похудения). 5. В побочных подгруппах с увеличением заряда ядра увеличивается устойчивость соединений содержащих d элемент в высшей степени окисления. Золото существует в трёх степенях окисления: Au+1, Au+2, Au+3, наиболее устойчивая +3, для неё характерны устойчивые комплексы. Пример: H3[AuCl6]. 6. d-элементы в организме в основном находятся в виде комплексных ионов ([Cr(H2O)6]3+, [Mn(OH)4]2-), образующих в организме внутрикомплексные соединения с белками – биокластеры. Внутри биокластеров есть полость, в которой располагается металл комплексообразователь, окружённый лигандами (органические вещества). Известны примеры – металлоферменты, карбоангидраза, ксантиноксидаза, цитохромы. № 126. Общая характеристика элементов VIБ группы. Электронные формулы для хрома, молибдена, вольфрама и наиболее устойчивые их степени окисления. Характер соединений хрома в степени окисления +2, +3, +6. Биологическая роль Cr+3, Mo+6. Ксантиноксидаза и альдегидоксидаза – ферменты, содержащие Mo+6. Общая характеристика VIB группы. Включает в себя: хром, молибден и вольфрам. Валентные электроны: ns1(n-1)d5. наиболее распространенные степени окисления: +2, +3 – соединения амфотерны, +6. Cr(OH)3 + 3HCl = CrCl3 + 3H2O Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] H2CrO4 – хромовая кислота H2Cr2O7 – двухромовая кислота Биологическая роль VIB группы. Хром – это биогенный микроэлемент, в организме находится в степени окисления +3. Его концентрация высока в клетках ЦНС и крови, входит в состав фермента пепсина. При недостатке хрома снижается чувствительность тканей к действию инсулина, из-за чего возможно развитие сахарного диабета. Соединения хрома +6 очень токсичны для человека. Молибден - это биогенный микроэлемент, в организме находится в степени окисления +6, входит в состав 7 ферментов, которые регулируют окислительно-восстановительные реакции: альдегидоксидазы, ксантиноксидазы и др. Ксантин + Ксантиноксидаза-Мо+6 → Мочевая кислота + Н2О2, при накоплении мочевой кислоты развивается подагра. СН3СОН + Альдегидоксидаза-Мо+6 → 2СО2 + 2Н2О Ион молибдена +6 входит в ферменты бобовых растений, способствующих фиксации азота воздуха и переводу его в органический азот. № 127. Общая характеристика элементов VIIБ группы. Электронные формулы для марганца, технеция и рения. Наиболее устойчивые степени окисления для них. Изменение химической активности в ряду указанных элементов. Соединения марганца в степени окисления +2, +4, +6, +7. Окислительная активность перманганат-иона в зависимости от среды. Биологическая роль Mn+2. Общая характеристика VIIB группы. В нее входят марганец, технеций, рений. Валентные электроны: ns2(n-1)d5. наиболее распространенные степени окисления: +2, +4, +6, +7 у марганца, +6, +7 у технеция, +7 у рения. Характеристика соединений марганца: +2 – основные. MnO, Mn(OH)2, в организме присутствуют только в виде комплексных ионов, например [Mn(H2O)4]. +4 – амфотерные. MnO2, Mn(OH)4, H4MnO4 – ортомарганцоватистая кислота, соли называют манганиты. +6 – кислотные. MnO3, H2MnO4 - марганцовистая кислота, соли называют манганаты. +7 – кислотные. Mn2O7, HMnO4 - марганцовая кислота, соли называют перманганаты. Перманганаты обладают различной окислительной активностью в зависимости от среды: MnO4- (малиновый) + 5ē → Mn+2 (бесцветный); кислая MnO4- (малиновый) + 3ē → MnО2 (бурый); нейтральная, слабощелочная MnO4- (малиновый) + 1ē → MnO42- (зеленый). сильнощелочная Биологическая роль VIIB группы. Марганец в организме находится в виде ионов с зарядом +2, которые концентрируются в костной ткани, печени почках. Марганец образует внутрикомплексные соединения с нуклеиновыми белками и аминокислотами. Марганец участвует во взаимопревращениях АТФ и АДФ. Входит в состав ферментов – холинэстеразы, фосфоглюкомутазы, пируваткарбоксилазы и других. В медицине используют 5% раствор перманганата калия в качестве дезинфицирующего средства. Сульфат марганца и хлорид марганца назначают при анемии и атеросклерозе. № 128. Общая характеристика d-элементов IIБ группы. Электронные формулы для цинка, кадмия и ртути. Характерные степени окисления. Амфотерный характер цинка, его оксида и гидроксида. Строение комплексных соединений данных элементов. Биологическая роль Zn+2. Карбоангидраза, карбоксипептидаза – биологические ферменты, их роль в организме. Хелатотерапия. Соединения цинка и ртути, применяемые в медицине. Токсическое действие на организм ртути и кадмия. Общая характеристика IIВ группы. В эту группу входят цинк, кадмий и ртуть. Электронная формула ns2(n-1)d10. Зависимость свойств от строения аналогична уже описанным ранее побочным подгруппам. Цинк – амфотерный металл, кадмий – амфотерный с преобладанием основных свойств, ртуть – основной. Эти металлы являются комплексообразователями с координационным числом 4, у кадмия координационное число может быть равно 6, если лигандами будут молекулы аммиака. Cd(OH)2 + 6NH3 = [Cd(NH3)6](OH)2 – гидроксид гексаамминкадмия (III). Эти металлы при взаимодействии с кислородом образуют окисную пленку характерного цвета и высокой устойчивости. Оксид цинка – белый, оксид кадмия – желтый, оксид ртути – черный. Эти оксиды не растворимы в воде, но хорошо растворяются в кислотах. ZnO + 2HCl + 3H2O = [Zn(H2O)4]Cl2 хлорид тетрааквацинка (II). ZnO + 2Na
|
||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1057; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.170 (0.016 с.) |